Иммуноглобулины G
- 1 year ago
- 0
- 0

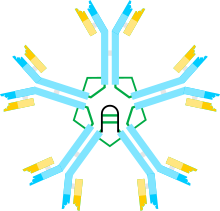
Иммуноглобули́ны M (IgM) — класс антител . Молекулы IgM являются самыми тяжёлыми ( молекулярная масса 990 кДа ) и наиболее сложно организованными иммуноглобулинами. Молекула свободного IgM представляет собой , каждый мономер которого состоит из двух тяжёлых цепей (μ-цепей) и двух лёгких цепей κ- или λ-типов. Мономеры объединены в пентамер посредством дисульфидных мостиков и . При первичном попадании в организм антигена иммуноглобулины IgM из всех антител образуются первыми . Кроме того, они первыми появляются в онто - и филогенезе . У человека и других млекопитающих IgM синтезируются плазматическими клетками , находящимися в селезёнке . IgM наиболее активны в антибактериальном иммунитете и при ряде аутоиммунных заболеваний .
Изучение иммуноглобулинов M началось с опубликованного в 1937 году сообщения о появлении в крови лошадей , гипериммунизированных полисахаридами пневмококка , антител, значительно превосходивших по массе обычные иммуноглобулины G кролика . Из-за большого размера новые антитела сначала получили название «γ-макроглобулины», и возникшее позднее название нового класса антител — IgM — также связано с приставкой macro- . Обычно популяции IgM очень гетерогенны, так как они направлены против самых разных инфекционных агентов; это значительно затрудняло изучение их структуры. Впоследствии были найдены источники гомогенных IgM-антител. Выяснилось, что в некоторых случаях клетки множественной миеломы продуцируют гомогенные IgM . В 1960-х годах были разработаны методы для индукции развития иммуноглобулинпродуцирующих опухолей ( ) у мышей , что позволило получить гомогенные популяции антител многих классов, в том числе и IgM .
Молекула IgM состоит из пяти мономерных субъединиц , располагающихся радиально, причём их F c -фрагменты направлены в центр комплекса, а F ab -фрагменты обращены наружу. В каждом мономере тяжёлая цепь (μ-цепь) включает около 576 аминокислотных остатков (а. о.). Она содержит вариабельный домен (VH-домен) длиной около 110 а. о. и четыре константных домена (C-домена), обозначаемых C μ 1, C μ 2, C μ 3 и C μ 4 соответственно, однако в ней отсутствует шарнирный участок. Функционально его частично заменяет домен C μ 2, содержащий в первичной структуре остатки пролина . Существует предположение, что этот домен стал эволюционным предшественником шарнирной области γ- и α-цепей иммуноглобулинов G и A соответственно. Каждый C-домен состоит примерно из 110 а. о. и имеет хвостовой участок длиной около 20 а. о. По данным рентгеноструктурного анализа , остатки пролина в домене C μ 2 обеспечивают F ab -фрагменту гибкость, необходимую для обнаружения антигенных детерминант на поверхности антигенпрезентирующей или бактериальной клетки. Каждая μ-цепь связана с пятью олигосахаридами , присоединёнными к остаткам аспарагина : один «пришит» к домену C μ 1, три — к домену C μ 3 и один — к хвостовой части цепи . Лёгкие цепи представлены λ- или κ-типом, содержат около 220 а. о. и включают вариабельный домен VL (около 110 а. о. ) и константный домен CL (около 110 а. о. ) .
Мономеры соединяются в пентамер посредством дисульфидных мостиков и J-цепи, с которой у каждого пентамера взаимодействует остаток цистеина , локализованный в C-концевом участке мономера. J-цепь представляет собой небольшой кислый белок длиной около 137 а. о. J-цепь связывает две μ-цепь посредством дисульфидных связей. Однако IgM существует не только в пентамерной форме. Известна мономерная форма IgM, которая находится на поверхности B-лимфоцитов и выполняет роль антигенраспознающего рецептора , а свободный IgM, входящий в состав плазмы крови , существует в виде пентамера. Мембранные мономеры отличаются от мономеров, входящих в состав пентамера, числом аминокислотных остатков в хвостовой части аминокислотной цепи .
Хотя у человека и мыши преобладающей формой IgM является пентамер, у шпорцевых лягушек ( Xenopus sp.) IgM существует преимущественно в гексамерной форме , у костистых рыб — в форме. Пентамерная форма IgM преобладает и у хрящевых рыб (например, акул ) . Причина, по которой IgM человека и мыши существует в основном виде пентамера, неясна, так как теоретически он может формировать и стабильный гексамер . Эксперименты на мышах показали, что у них может образовываться гексамерная форма IgM только в случае невозможности взаимодействия μ-цепей с J-цепью (если она не экспрессируется или в μ-цепях отсутствуют остатки цистеина, необходимые для связывания с J-цепью ). Таким образом, у мыши гексамеры никогда не образуются при наличии J-цепей, а пентамерная форма может существовать как при наличии J-цепи, так и в её отсутствие .
С помощью разнообразных методов, таких как рентгеноструктурный анализ и ЯМР-спектроскопия , была установлена структура доменов C μ 1—C μ 4, которые экспрессировали по отдельности в клетках кишечной палочки Escherichia coli . Как и в случае остальных иммуноглобулинов, μ-цепь IgM содержит 7 перекрывающихся бета-листов , стабилизированных междоменными дисульфидными связями. Константный участок IgM по форме похож на шляпочный гриб , в котором домены C μ 2—C μ 3 образуют « шляпку », а домен C μ 4 формирует подобие « ножки » .
IgM — первые иммуноглобулины, которые начинают синтезироваться в плоде человека (примерно на 20-й неделе) . Иммуноглобулины M могут взаимодействовать с системы комплемента и активизировать классический путь системы комплемента, в результате чего происходит опсонизация антигенов и цитолиз . IgM взаимодействуют с молекулами (plgR), благодаря чему попадают на слизистые оболочки , такие как выстилку кишечника , а также в грудное молоко . В этом взаимодействии участвует J-цепь . При трансплантации органов в организме реципиента вырабатываются IgM, направленные против пересаженного органа, однако они не участвуют в реакции отторжения трансплантанта и могут оказывать защитную роль . При первичном столкновении с антигеном IgM образуются первыми, они появляются и при повторных столкновениях, но в меньших количествах. IgM не проходят через плаценту (через неё проходят только иммуноглобулины G). Наличие в плазме крови IgM против определённых возбудителей свидетельствует о ранних этапах инфекции, а в крови новорождённого — о внутриматочной инфекции (например, ). В норме IgM часто присутствуют с плазме крови в связанном с определёнными антигенами виде, за что их иногда называют «натуральными антителами». Причиной этого явления может служить высокая авидность IgM, из-за чего они связывают антигены с низкой , встречающиеся в плазме крови здорового человека .