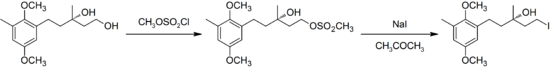Interested Article - Реакция Финкельштейна

- 2021-07-21
- 1

Реакция Финкельштейна — метод синтеза алкилиодидов либо алкилфторидов взаимодействием алкилхлоридов либо алкилбромидов с иодидами или фторидами щелочных металлов, предложен Гансом Финкельштейном в 1910 г. как метод синтеза алкилиодидов .
Реакция Финкельштейна протекает по механизму S N 2 ( бимолекулярного нуклеофильного замещения ) и является равновесной:
В классическом вариант реакции Финкельштейна для повышения выходов алкилиодидов проводится в растворителях, в которых иодиды натрия или калия хорошо растворимы, а образующиеся в ходе реакции хлориды или бромиды щелочных металлов малорастворимы например, взаимодействием алкилгалогенидов с иодидом натрия в безводном ацетоне :
В силу равновесности реакции Финкельштейна возможен и изотопный обмен галогенов между галогенидом металла и алкилгалогенидом:
Реакционная способность алкилгалогенидов в реакции Финкельштейна зависит как от природы галогена, так и строения алкилгалогенида: равновесие сдвинуто в сторону замещения менее нуклеофильного галогена (хлор) на более нуклеофильный (бром и иод). Зависимость реакционной способности алкилгалогенидов типична для реакция S N 2 и уменьшается в ряду первичные — вторичные — третичные алкилгалогениды, соединения аллил- и бензилгалогениды, а также α-галогенкарбонильные соединения:
| Me-Cl | Bu-Cl | i-Pr-Cl | t-BuCH 2 -Cl | CH 2 =CH-CH 2 -Cl | PhCH 2 -Cl | EtOC(O)CH 2 -Cl | MeC(O)CH 2 -Cl |
|---|---|---|---|---|---|---|---|
| 179 | 1 | 0.0146 | 0.00003 | 64 | 179 | 1600 | 33000 |
В современных модификациях реакции Финкельштейна в качестве уходящей группы, обмениваемой на иод, используются не только галогены, но и сульфонаты (обычно или ), что позволяет с высокими выходами превращать спирты в алкилиодиды :
Такое превращение протекает в мягких условиях, что используется для региоселективного замещения спиртового гидроксила на иод с сохранением конфигураций хиральных центров молекулы :
Другой модификацией реакции Финкельштейна является её проведение в условиях . Основным отличием такой модификации от классического метода является возможность синтеза алкилфторидов за счет солюбилизизации фторид-иона в неполярных растворителях, при этом возможно проведение реакции как в системе «органическая фаза / водный раствор фторида», так и в системе «органическая фаза / твердый фторид», в качестве катализаторов межфазного переноса в первом случае обычно применяются ониевые соли, во втором — краун-эфиры , выходы фторидов из первичных алкилбромидов и бензилбромидов составляют 70—90 %. Поскольку слабосольватированный в таких условиях фторид-анион выступает в роли не только нуклеофила, но и основания, в случае неактивированных алкилгалогенидов реакция замещения галогена на фтор конкурирует с реакцией элиминирования , которая в некоторых случаях становится преобладающей (циклогексилхлорид) .
Примечания
- Finkelstein, Ber. Dtsch. Chem. Ges., 1910, 43, 1528.
- Streitwieser, A. Solvolytic Displacement Reactions at Saturated Carbon Atoms (англ.) // : journal. — 1956. — Vol. 56 , no. 4 . — P. 571 . — doi : .
- Bordwell, F. G.; Brannen, W. T. The Effect of the Carbonyl and Related Groups on the Reactivity of Halides in S N 2 Reactions (англ.) // : journal. — 1964. — Vol. 86 , no. 21 . — P. 4645 . — doi : .
- Дата обращения: 14 марта 2012. 9 октября 2007 года.
- Maloney, D. J.; Hecht, S. M. A Stereocontrolled Synthesis of δ- trans -Tocotrienoloic Acid (англ.) // : journal. — 2005. — Vol. 7 , no. 19 . — P. 4297—4300 . — doi : . — .
- Демлов Э., Демлов З. Межфазный катализ. — М. : Мир, 1987. — С. 109—115
- 2021-07-21
- 1