Сульфит калия
- 1 year ago
- 0
- 0

| Перманганат калия | |
|---|---|
| Kalii permanganas | |
| Химическое соединение | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO 4 |
| CAS | |
| PubChem | |
| DrugBank | |
| Состав | |
| Классификация | |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | |
| Лекарственные формы | |
| порошок для приготовления раствора | |
| Другие названия | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |


Пермангана́т ка́лия ( лат. Kalii permanganas , распространённое название в быту — марганцо́вка ) — марганцовокислый калий , калиевая соль марганцовой кислоты . Химическая формула — KMnO 4 . Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии .
Внешний вид: тёмно- фиолетовые кристаллы с металлическим блеском . Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке , ацетоне (2:100), метаноле , пиридине .
| Температура , °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость , г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
| Стандартная энтальпия образования Δ H | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость C p | 119,2 Дж/(моль·K) (т) (при 298 К) |
| Окисленная форма | Восстановленная форма | Среда | E 0 , В |
|---|---|---|---|
| MnO 4 − | MnO 4 2− | OH − | +0,56 |
| MnO 4 − | H 2 MnO 4 | H + | +1,22 |
| MnO 4 − | MnO 2 | H + | +1,69 |
| MnO 4 − | MnO 2 | OH − | +0,60 |
| MnO 4 − | Mn 2+ | H + | +1,51 |


Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия ):
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII) :
При этом в качестве промежуточного продукта может образовываться интересное соединение — . По реакции с фторидом иода(V) можно получить аналогичный :
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации ( диспропорционирование ) на и .
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов ( реакция Вагнера ):
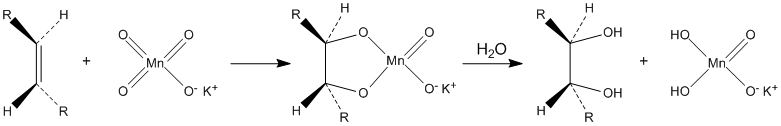 Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Перманганат калия реагирует с концентрированной соляной , бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены :
Во время химической реакции хлорид-анион окисляется до элементарного хлора , а ион в перманганат-анионе восстанавливается до катиона :
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов . В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия .
Антисептическое средство . При соприкосновении с органическими веществами выделяет атомарный кислород . Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии ).
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов ( морфин , аконитин , никотин ), синильной кислотой , фосфором , хинином ; кожи — при попадании на неё анилина ; глаз — при поражении их ядовитыми насекомыми.
Гиперчувствительность.
При передозировке: резкая боль в полости рта, по ходу пищевода, в животе, рвота, диарея; слизистая оболочка полости рта и глотки — отёчная, тёмно-коричневого, фиолетового цвета, возможен отёк гортани, развитие механической асфиксии, ожогового шока, двигательного возбуждения, судорог, явлений паркинсонизма, геморрагического колита, нефропатии, гепатопатии. При пониженной кислотности желудочного сока возможно развитие метгемоглобинемии с выраженным цианозом и одышкой. Смертельная доза для детей — около 3 г , для взрослых — 0,3—0,5 г/кг .
Лечение: метиленовый синий (50 мл 1 % раствора), аскорбиновая кислота (внутривенно — 30 мл 5 % раствора), цианокобаламин — до 1 мг , пиридоксин (внутримышечно — 3 мл 5 % раствора).
В водных растворах для промывания ран (0,1—0,5 %), для полоскания рта и горла (0,01—0,1 %), для смазывания язвенных и ожоговых поверхностей (2—5 %), для спринцевания (0,02—0,1 %) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами ( сахарозой , танинами , глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина , или безводным — всегда) и может привести к взрыву.
Очень опасно растирание сухого перманганата калия с органическими веществами и порошками активных металлов и неметаллов ( кальцием , алюминием , магнием , фосфором , серой и др.) — весьма вероятен взрыв.
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ .