Interested Article - Реакция Стилле

- 2021-07-14
- 1
Реакция Стилле — вариант реакции кросс-сочетания, в которой взаимодействие арил-, алкенил-, алкинил- и алкилстаннанов с арил- или алкенилгалогенидами, трифлатами (трифторметилсульфонатами), арилдиазониевыми или иодониевыми солями, катализируемое различными комплексами Pd(0) ведет к обмену уходящей группы — галогена или псевдогалогена — второго реагента на радикал-заместитель станнана. Реакция нашла широкое применение в органическом синтезе.

X может быть как галогеном (Cl, Br, I), так и псевдогалогенидом ( C F 3 S O 3 - ) .
Реакция Стилле была открыта в 1977 году Джоном Кеннетом Стилле (John Kenneth Stille) и Дэвидом Мильштейном (David Milstein), который был постдоком в той же лаборатории. Реакция Стилле была использована для проведения около 50 % всех реакций кросс-сочетания, опубликованных в 1992 году. Также реакция используется в промышленных процессах, в частности в синтезе фармацевтических препаратов.
Реакции Стилле были посвящены несколько обзорных публикаций.
Общие сведения
Обычно реакцию проводят в атмосфере инертного газа с использованием сухого и дегазированного растворителя , так как кислород воздуха может окислять палладиевый катализатор и провоцировать гомо-сочетание органометаллического соединения, что в свою очередь приводит к уменьшению выхода целевого продукта кросс-сочетания.
Как органические соединения олова, в реакцию могут быть введены триметилстаннильные или трибутилстаннильные производные. Хотя триметилстаннильные производные обладают более высокой реакционной способностью по сравнению с трибутилстаннильными, их токсичность также примерно в 1000 раз выше, чем токсичность последних. Именно поэтому триметилстаннильные производные применяются лишь в случае крайней необходимости.
Механизм реакции
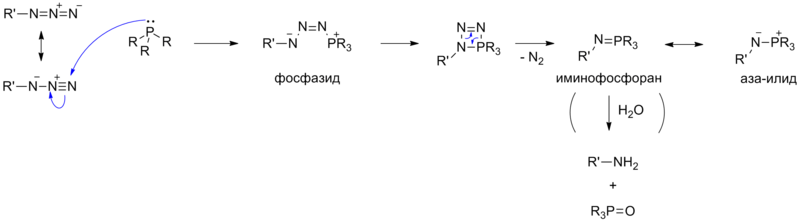
Механизм реакции Стилле довольно хорошо изучен. Первым процессом, инициирующем запуск является восстановление палладиевого катализатора ( 1 ) в активный Pd(0) ( 2 ). Окислительное присоединение органического галогенида ( 3 ) дает цис-интермедиат, который быстро изомеризуется в транс-изомер 4 . органическим производным олова ( 5 ) приводит к формированию интермедиата 7 . Последним процессом в этом каталитическом цикле является восстановительное элиминирование , которое приводит к желаемому продукту кросс-сочетания ( 8 ) и освобождению катализатора ( 2 ). Окислительное присоединение и восстановительное элиминирование проходят с сохранением стереохимической конфигурации исходных соединений.

Относительная скорость реакции с участием замещенных станнанов убывает в ряду заместителей:
- алкинил- > алкенил- > арил- > аллил- = бензил- > α-алкоксиалкил- > алкил-
Низкая реакционная способность алкильных производных олова является недостатком реакции. Однако, его можно преодолеть, если использовать как среду для проведения реакции полярные апротонные растворители, такие как ГМФТА , ДМФА или диоксан .
В 2007 году были проведены масс-спектрометрические исследования механизмов реакции Стилле подверглась изучению с помощью специального типа масс-спектрометрии, при этом было показано существование каталитического интермедиата с нуль-валентным палладием Pd(0)(PPh 3 ) 2 , существование которых постулировалось, но не было до этого времени доказано прямым экспериментом. Также были обнаружены циклические интермедиаты трансметаллирования -Pd(II)-X-Sn-C-. .
Варианты проведения реакции
Для увеличения выхода в реакционную смесь часто добавляют хлорид лития. Этот реагент стабилизирует интермедиат, образуемый окислительным присоединением катализатора, таким образом ускоряя реакцию.
Специфичность реакции Стилле может быть улучшена добавлением стехиометрического количества йодида меди или солей Mn(II).
Было показано, что в присутствии солей Cu(I), эффективным катализатором реакции может быть палладий на угле.
Примечания
- Kosugi, M. et al. Chem. Letters 1977 , 301.
- Milstein, D.; Stille, J. K. 1978 , 100 , 3636. ( doi : )
- Scott, W. J.; Crisp, G. T.; Stille, J. K. , Coll. Vol. 8, p.97 (1993); Vol. 68, p.116 (1990). ( от 9 октября 2012 на Wayback Machine )
- Stille, J. K.; Echavarren, A. M.; Williams, R. M.; Hendrix, J. A. , Coll. Vol. 9, p.553 (1998); Vol. 71, p.97 (1993). ( от 21 октября 2012 на Wayback Machine )
- Stille, J. K. 1986 , 25 , 508—524. ( )
- Farina, V.; Krishnamurthy, V.; Scott, W. J. Org. React. 1998 , 50 , 1-652. ( (недоступная ссылка) )
- Mitchell, T. N. Synthesis 1992 , 803—815. ( )
- Casado, A. L.; Espinet, P. Organometallics 1998 , 17 , 954—959.
- ↑ Casado, A. L.; Espinet, P. 1998 , 120 , 8978-8985. ( doi : )
- The Mechanism of the Stille Reaction Investigated by Electrospray Ionization Mass Spectrometry Leonardo S. Santos, Giovanni B. Rosso, Ronaldo A. Pilli, and Marcos N. Eberlin ; 2007 ; 72(15) pp 5809 — 5812; (Note) doi :
- Liebeskind, L. S.; Peña-Cabrera, E. , Coll. Vol. 10, p.9 (2004); Vol. 77, p.135 (2000). ( от 6 февраля 2012 на Wayback Machine )
- Farina, V.; Kapadia, S.; Krishnan, B.; Wang, C.; Liebeskind, L. S. 1994 , 59 , 5905.
- Liebeskind, L. S.; Fengl, R. W. 1990 , 55 , 5359.
- Roth, G. P.; Farina, V.; Liebeskind, L. S.; Peña-Cabrera, E. 1995 , 36 , 2191.
- Renaldo, A. F.; Labadie, J. W.; Stille, J. K. , Coll. Vol. 8, p.268 (1993); Vol. 67, p.86 (1989). ( от 6 февраля 2012 на Wayback Machine )
См. также
Ссылки
- от группы Маерса (англ).
- на organic-chemistry.org (англ.)
- 2021-07-14
- 1