Interested Article - Пикраты

- 2020-01-25
- 1

Пикраты — группа химических соединений — солей пикриновой кислоты (2,4,6-тринитрофенола C 6 H 2 (NO 2 ) 3 OH). Традиционно в эту группу включают также соединения пикриновой кислоты с некоторыми органическими веществами , которые, как правило, не являются солями. Пикриновая кислота образует пикраты практически со всеми металлами , за исключением олова . Пикраты чаще всего используют как инициирующие взрывчатые вещества или компоненты составов, повышающие их чувствительность .
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил Глаубер , воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог . Считается, что первые печатные сообщения о пикратах опубликованы в 1795 году , однако длительное время их состав и свойства не были точно определены. Первое применение смеси пикрата калия , нитрата калия и угля как взрывчатого вещества было предложено Десиньолем (Designolle) в 1869 . В этом же году Фонтейн (Fountaine) предложил смесь пикрата калия и хлората калия , а Абель (Abel) предложил смесь пикрата аммония и нитрата калия. Первые систематические исследования пикратов металлов были проведены в 1901 Дюпре (Dupre), продолжены Уиллом (Will) в 1906 , Силберрадом (Silberrad) и Филлипсом (Phillips) в 1908 , Кастом (Kast) в 1911 .
Взрывчатые свойства
Общее свойство всех пикратов — образовывать кристаллогидраты с различным количеством молекул воды . Чувствительность в значительной степени зависит от количества остаточной воды, чем её больше, тем менее чувствительны материалы.
В ряду пикратов с различными катионами чувствительность уменьшается в ряду: Pb>Fe>Co>Ni>Ba>Cu>Mn>Zn>Ca, Na, NH 4
Получение
Пикраты могут быть получены действием на пикриновую кислоту гидроксидов или карбонатов соответствующих металлов, а также другими методами.
Отдельные неорганические пикраты
Пикрат алюминия
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 3 Al, молекулярная масса 711,31 а. е. м. Содержание азота 17,73 %. Плавится выше 100 °C, при дальнейшем нагревании взрывается. Может быть получен продолжительным нагреванием из его гидратов (например, ди-, тетра-, дека- или гексадекагидрата) при температуре ниже 100 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 40,6 см (для тротила — 35,6 см).
Дигидрат пикрата алюминия [C 6 H 2 (NO 2 ) 3 O] 3 Al*2H 2 O получается из декагидрата при нагревании до +80 °C. По чувствительности он сравним с безводной солью, а декагидрат имеет низкую чувствительность. Дигидрат пикрата алюминия взрывается при температуре около 360 °C.
Основной пикрат алюминия [C 6 H 2 (NO 2 ) 3 O] 2 AlOH·7H 2 O, молекулярная масса 530,35 а. е. м. Красноватые или палево-желтые игольчатые кристаллы , при нагреве до +80 °C переходят в тетрагидрат жёлтого цвета, который при дальнейшем нагревании взрывается.
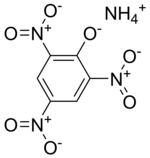
Пикрат аммония
Другие названия: , взрывчатое вещество Д и даннит ( ) (в военном применении в США).
Химическая формула C 6 H 2 (NO 2 ) 3 ONH 4 , молекулярная масса 246,14. Содержание азота 22,77 %. Кислородный баланс с окислением до CO 2 : −52 %. Две формы: стабильная жёлтая и метастабильная красная. Получают реакцией нейтрализации в водном растворе пикриновой кислоты аммиаком в виде газа или водного раствора.
Пикрат аммония — одно из первых бризантных взрывчатых веществ, которые начали применяться в XIX веке для снаряжения боеприпасов, название даннит получил от фамилии майора армии США Данна, предложившего использовать его в снарядах. Под наименованием Explosive D широко использовался и используется в США. Входит в состав нескольких взрывчатых смесей (например, ).
По взрывчатым характеристикам незначительно уступает тротилу, чувствительность меньше, чем у тротила.
Пикрат бария
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Ba, молекулярная масса 594,64 а. е. м. Содержание азота 14,14 %. Жёлтый кристаллический порошок, взрывается при 333—337 °C с умеренной мощностью. Может быть получен нагреванием пентагидрата [C 6 H 2 (NO 2 ) 3 O]Ba·5H 2 O . Пентагидрат — жёлтые призматические игольчатые кристаллы, получаются из концентрированного водного раствора. Безводная соль взрывается при 403 °C, но малочувствительна к удару и трению.
Пикрат кадмия
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Cd, молекулярная масса 569,70 а. е. м. Содержание азота 14,76 %. Жёлтый кристаллический порошок. Взрывается при 336—341 °C. Получается нагревом кристаллогидратов при 80-150 °C. (пента-, гепта- или октогидрата). Чувствительность к удару безводной соли по методу Арсенала Пикатинни с грузом 2 кг составляет 30,5 см (тротил — 35,6 см). Чувствительность октагидрата 88,9 см, он менее чувствителен, чем дымный порох .
Пикрат кальция
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Ca, молекулярная масса 497,38 а. е. м. Содержание азота 16,90 %. Жёлтый кристаллический порошок. Взрывается при 323—328 °C. Получается нагревом декагидрата при +80 °C.
Пикрат церия
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Ce, молекулярная масса 824,45 а. е. м. Содержание азота 15,29 %. Коричневый кристаллический порошок. Взрывается при 306—313 °C. Получается нагревом кристаллогидратов (три-, или ундекагидрата).
Пикрат цезия
Химическая формула C 6 H 2 (NO 2 ) 3 OCs, молекулярная масса 361,01 а. е. м. Содержание азота 11,64 %. Жёлтые иглообразные кристаллы. Взрывается при 277—287 °C. Использовался в США для возбуждения взрыва в зарядах гексогена в магнитогидродинамических генераторах (МГД-генераторах).
Пикрат хрома
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 5 Cr·27H 2 0, молекулярная масса 1695,09 а. е. м. Содержание азота 12,04 %. Зелёный кристаллический порошок. Получается взаимодействием эквивалентных количеств пикрата бария и фиолетовой модификации сульфата хрома (зелёная модификация не полностью реагирует с пикратом бария). Безводная соль получается дегидратацией при 150 °C. Тридекагидрат и моногидрат взрываются при 330 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для тридекагидрата 91,4 см, для моногидрата 20,3 см (для тротила — 35,6 см).
Пикрат кобальта
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Co, молекулярная масса 371,03 а. е. м. Содержание азота 22,66 %. Коричневый кристаллический порошок. Взрывается при 320—325 °C. Получается нагревом кристаллогидратов при 150 °C.
Пикрат меди
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Cu, молекулярная масса 520,85 а. е. м. Содержание азота 16,14 %. Жёлто-зелёный кристаллический порошок, очень гигроскопичный. Взрывается при 282—287 °C, по другим данным при 373 °C. Получается нагревом кристаллогидратов при 80-150 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 30,5 (для тротила — 35,6 см). Тригидрат взрывается при 300 °C, его чувствительность к удару 48,3 см.
Пикрат железа (III)
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 3 Fe·11H 2 O, молекулярная масса 938,4 а. е. м. Содержание азота 13,44 %. Красно-жёлтый игольчатый кристаллический порошок. Получен Кастом в 1911 обработкой горячего насыщенного раствора сульфата железа пикратом бария. Имеет несколько кристаллогидратов, которые взрываются при 295 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — от 15,2 см для материала, высушенного при 150 °C, до 91,4 см для материала, высушенного при +25 °C.
Пикрат железа II
Химическая формула[C 6 H 2 (NO 2 ) 3 O] 2 Fe, молекулярная масса 513,15 а. е. м. Содержание азота 16,38 %. Тёмно-зелёный кристаллический порошок. Взрывается при 315—320 °C. Получается сушкой октагидрата в вакуумном эксикаторе над серной кислотой . Октагидрат был получен обработкой горячего насыщенного раствора сульфата железа (II) пикратом бария. Жёлтые гексагональные призмы октагидрата при хранении приобретают коричневый цвет. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 91,4 см.
Пикрат свинца
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Pb, молекулярная масса 663,41 а. е. м. Содержание азота 12,67 %. Жёлтый кристаллический порошок. Взрывается при 270—281 °C. Получается сушкой моногидрата или тетрагидрата при 150 °C. Тетрагидрат был получен обработкой раствора пикриновой кислоты карбонатом свинца. Чувствительность к удару безводной соли при испытании с грузом 500 г — 4 см (для гремучей ртути — 24 см). Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг — 5 см. Чувствительность к трению также высока.
Моногидрат пикрата свинца был запатентован во Франции в 1872 году для применения в капсюлях и детонаторах. Использовался в Германии для производства зажигательных смесей.
Пикрат лития
Химическая формула C 6 H 2 (NO 2 ) 3 OLi, молекулярная масса 235,05 а. е. м. Содержание азота 17,88 %. Жёлтый кристаллический порошок. Очень гигроскопичен, с образованием моногидрата. Взрывается при 318—323 °C. Получается сушкой гидратов. Плотность 1,724 — 1,740 г/см3.
Пикрат магния
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Mg, молекулярная масса 481,60 а. е. м. Содержание азота 17,45 %. Взрывается при 367—372 °C. Получается сушкой гидратов при 150 °C.
Пикрат марганца
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Mn, молекулярная масса 512,23 а. е. м. Содержание азота 16,41 %. Жёлтый кристаллический порошок. Взрывается при 325—330 °C. Получается сушкой гидратов при 150 °C.
Пикрат никеля
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Ni, молекулярная масса 516,01 а. е. м. Содержание азота 16,29 %. Зелёный кристаллический порошок. Взрывается при 335—340 °C, гексагидрат взрывается при 390 °C. Получается сушкой гидратов. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для безводной соли — 10,1 см.
Пикраты платины
Платина образует комплексные соединения , содержащие ион пикриновой кислоты:
-
[Pt(CH
3
SCH
3
)
4
]·[C
6
H
2
(NO
2
)
3
O]
2
, содержание азота 9,32 %, жёлтые кристаллы, взрывается при нагреве.
- [Pt(C 2 H 5 SCH 2 CH 2 SC 2 H 5 ) 2 ]·[C 6 H 2 (NO 2 ) 3 O] 2 , содержание азота 8,8 %, жёлтые кристаллы, взрывается при нагреве.
Пикрат калия
Химическая формула C 6 H 2 (NO 2 ) 3 OK, молекулярная масса 267,20 а. е. м. Содержание азота 15,73 %. Красновато-жёлтые или зелёные ромбические кристаллы. Взрывается при 310—316 °C. Предположительно, впервые был получен Глаубером в XVII веке растворением древесины в азотной кислоте и нейтрализацией поташом K2CO3. Получается в реакции нейтрализации горячего водного раствора карбоната калия горячим раствором пикриновой кислоты и отделением кристаллов при охлаждении раствора. Растворимость в воде при +15 °C 0,5 г/100 г воды, при 100 °C 25 г/100 г воды. Растворимость в этиловом спирте 0,2 г/ 100 г. Теплота взрывчатого разложения при постоянном объёме 621,8 ккал/моль. Взрывается при 370 °C.
Чувствительность к удару 2 дюйма. Стабильность близка к пикрату аммония (Explosive D), но бризантность меньше. При контакте с огнём детонирует. При любых условиях взрывания выделяется чёрный дым неокисленного углерода. Смеси с окислителями (например, нитратом калия ) могут гореть без детонации, но чувствительны к удару и опасны в обращении.
В 1869 году разработан взрывчатый состав (смесь пикрата калия, нитрата калия и древесного угля ) ( ), а также (Fountain) (смесь пикрата калия и хлората калия ). Пикрат калия использовался в пиротехнических составах для сигнальных свистков (использующих характерный звук, возникающий при горении некоторых пикратов). Использовался в составе баллиститных твёрдых ракетных топлив , в различных инициирующих составах (например, в смесях пикрата калия, пикрата свинца и хлората калия).
Смесь мелкодисперсных пикрата калия с нитратом калия в соотношении 60:40 по массе, плотно упакованная в бумажные или бамбуковые трубочки диаметром от ¼ до ¾ дюйма, горит с громким свистящим звуком. Во время Второй мировой войны немецкая армия применяла такие свистки в качестве дополнительных устройств к бомбам для усиления психологического воздействия. Свистки применялись как сигнальное средство при газовой атаке. Указанная смесь имеет высокую чувствительность и опасна в обращении, поэтому была заменена смесью галловой кислоты и хлората калия.
Пикрат рубидия
Химическая формула C 6 H 2 (NO 2 ) 3 ORb, молекулярная масса 313,58 а. е. м. Содержание азота 13,40 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 300—315 °C. Взрывается при ударе.
Пикрат серебра
Серебро образует комплексные аммиачные соли [Ag(NH 3 ) 2 ]·[C 6 H 2 (NO 2 ) 3 O] 2 , молекулярная масса 682,23. Содержание азота 28,75 %. Жёлтые кристаллы, взрываются при нагреве.
Пикрат натрия
Химическая формула C
6
H
2
(NO
2
)
3
ONa, молекулярная масса 251,10 а. е. м. Содержание азота 16,74 %. Желтоватый игольчатый кристаллический порошок. Взрывается при 310—315 °C. Получается сушкой моногидрата при 150 °C. Моногидрат был получен нейтрализацией водного раствора пикриновой кислоты карбонатом натрия. Моногидрат взрывается при 360 °C. Чувствительность к удару при испытании по методу Арсенала Пикаттини с грузом 2 кг для моногидрата 43,2 см, для безводной соли 38,1 см (для тротила 35,6 см).
Пикрат натрия горит при контакте с пламенем и придаёт эти свойства смесям с другими материалами. Использовался во взрывчатых и пиротехнических составах, в том числе вместо пикрата калия.
Двойные пикраты (например, получаемые совместно пикрат натрия и пикрат свинца) показывают меньшую чувствительность к удару, чем эти соли по отдельности.
Пикрат таллия
Химическая формулаC 6 H 2 (NO 2 ) 3 OTl, молекулярная масса 432,48 а. е. м. Содержание азота 9,72 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 273—275 °C. Получается обработкой раствора пикриновой кислоты карбонатом таллия. Взрывается при нагреве и ударе.
Пикрат тория
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 4 Th, молекулярная масса 1324,68 а. е. м. Содержание азота 12,69 %. Жёлтый игольчатый кристаллический порошок. Температура плавления +52— +53 °C. Взрывается при контакте с пламенем.
Пикрат цинка
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 2 Zn, молекулярная масса 522,67 а. е. м. Содержание азота 16,08 %. Жёлто-коричневый кристаллический порошок. Взрывается при 350—355 °C. Получается сушкой гидратов при 150 °C. Чувствительность к удару 60 см для груза 2 кг, что близко к пикриновой кислоте.
Пикрат циркония
Химическая формула [C 6 H 2 (NO 2 ) 3 O] 4 Zr, молекулярная масса 1032,66 а. е. м. Содержание азота 16,75 %. Жёлтый игольчатый кристаллический порошок. Взрывается при 317—322 °C. Может быть получен действием карбоната циркония на раствор пикриновой кислоты.
Органические пикраты
Пикриновая кислота образует соединения, подобные пикратам, со многими органическими веществами: углеводородами, нитросоединениями, аминами, фенолами и др. Как правило, их можно получить кипячением спиртовых растворов с последующим охлаждением и выпадением кристаллов пикратов. Отдельные примеры таких соединений:
- пикрат аценафтена (acenaphthen) C 12 H 1 0+C 6 H 2 (NO 2 ) 3 OH. Оранжево-красные призматические кристаллы, температура плавления 161—162 °C, взрывается при 412 °C.
- пикрат (allylamine) C 3 H 7 N+C 6 H 2 (NO 2 ) 3 OH. Лимонно-жёлтые игольчатые кристаллы, температура плавления 140—141 °C, взрывается при 270 °C.
- пикрат анилина C 6 H 5 NH 2 +C 6 H 2 (NO 2 ) 3 OH. Жёлтые кристаллы, температура плавления с разложением 165 °C, взрывается при 398 °C.
- пикрат атропина , температура плавления 173—175 °C, взрывается при 460 °C.
- пикрат N 3 CNHNH 2 +C 6 H 2 (NO 2 ) 3 OH. Взрывается при нагреве, к удару нечувствителен.
- пикрат (cinchonidine) 2C 19 H 22 ON 2 +3C 6 H 2 (NO 2 ) 3 OH. Жёлтые кристаллы, температура плавления 194—195 °C, взрывается при 260—268 °C.
- пикрат гуанидина CH 5 N 3 +C 6 H 2 (NO 2 ) 3 OH. Жёлтые кристаллы, взрывается при 498 °C.
- пикрат гексаметилентетрамина C 6 H 12 N 4 +C 6 H 2 (NO 2 ) 3 OH. Жёлтые игольчатые, взрывается при 360 °C.
- пикрат гидразина N 2 H 4 +C 6 H 2 (NO 2 ) 3 OH. Жёлтые игольчатые кристаллы, температура плавления 201 °C, взрывается при 385 °C.
- пикрат индена C 9 H 8 +C 6 H 2 (NO 2 ) 3 OH. Золотисто-жёлтые кристаллы, температура плавления 98 °C, высокая чувствительность в сухом состоянии, на воздухе медленно разлагается.
- пикрат нафталина C 10 H 8 +C 6 H 2 (NO 2 ) 3 OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 149—151 °C, взрывается при 484 °C. Образует с пикриновой кислотой эвтектическую смесь.
- пикрат альфа- нафтола C 10 H 7 OH+C 6 H 2 (NO 2 ) 3 OH. Оранжево-жёлтые игольчатые кристаллы, температура плавления 189—190 °C, взрывается при 458 °C.
- пикрат бета-нафтола C 10 H 7 OH+C 6 H 2 (NO 2 ) 3 OH. Оранжево-красные игольчатые кристаллы, температура плавления 155—157 °C, взрывается при 469 °C.
- пикрат фенантрена C 14 H 10 +C 6 H 2 (NO 2 ) 3 OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 143—145 °C, взрывается при 478 °C.
- пикрат пиридина C 5 H 5 N+C 6 H 2 (NO 2 ) 3 OH. Золотисто-жёлтые игольчатые кристаллы, температура плавления 165—166 °C, взрывается при 432 °C.
- Пикрат карбамида (мочевины) CH 4 ON 2 +C 6 H 2 (NO 2 ) 3 OH. Жёлтые игольчатые кристаллы, температура плавления 142 °C с разложением, взрывается при 489 °C.
См. также
Литература
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P274-P285.
- 2020-01-25
- 1