Interested Article - Ангиотензинпревращающий фермент 2

- 2021-08-06
- 1
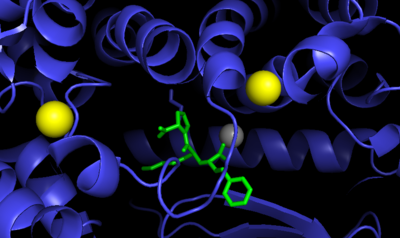
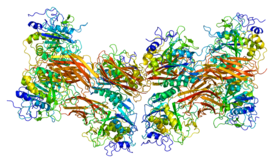
Ангиотензинпревращающий фермент 2 (АПФ2, ACE2; КФ :3.4.17.23) — мембранный белок , экзопептидаза , катализирующая превращение ангиотензина I в ангиотензин 1-9 и ангиотензина II в ангиотензин 1-7 .
АПФ2 человека является рецептором и точкой входа в клетку некоторых коронавирусов .
Структура
Ангиотензин-превращающий фермент 2 представляет собой цинксодержащий металлофермент. Он состоит из 805 аминокислот , молекулярная масса 92,5 кДа. Содержит 7 участков N -гликозилирования. Секретируемая форма образуется за счёт протеолитического расщепления протеазой ADAM17 , а также сериновыми протеазами TMPRSS2 , TMPRSS11D и HPN/ TMPRSS1 .
Каталитическая активность
АПФ2 катализирует следующую реакцию:
- ангиотензин II + H 2 O = ангиотензин (1-7) + L- фенилаланин
Тканевая экспрессия
АПФ2 экспрессируется в большинстве тканей. Главным образом белок находится на мембранах пневмоцитов II типа , энтероцитов тонкого кишечника , эндотелиальных клеток артерий и вен, а также гладкомышечных клеток в большинстве органов. Кроме этого, мРНК для АПФ2 обнаружена в клетках коры головного мозга , полосатого тела , гипоталамуса и ствола головного мозга . Наличие АПФ2 на нейронах головного мозга и глии делает эти клетки чувствительными к инфицированию вирусом SARS-CoV-2 , что может приводить к потере обоняния и развитию неврологического дефицита, наблюдаемых при заболевании COVID-19 . Потеря обоняния и потеря вкуса наблюдается у многих больных COVID-19 и рассматривается как особенность симптоматики заболевания . Академия отоларингологии США считает эти нарушения важными симптомами COVID-19 .
Функции
АПФ2 — карбоксипептидаза, конвертирующая ангиотензин I в ангиотензин 1-9, нонапептид с неизвестной функцией, и ангиотензин II в ангиотензин 1-7, обладающий вазодилаторной активностью . С высокой эффективностью может гидролизовать апелин-13 и динорфин-13 . За счёт конвертации ангиотензина II может играть важную роль в сердечной функции . Участвует в транспорте аминокислот, взаимодействуя с транспортёром SL6A19 в кишечнике и регулируя его перенос, экспрессию на поверхности клеток и его каталитическую активность .
В патологии
Обнаружено, что АПФ2 имеет сродство к S - гликопротеинам некоторых коронавирусов , включая вирусы SARS-CoV и SARS-CoV-2 , и является, таким образом, точкой проникновения вируса в клетку. Более того предполагается, что инфекция SARS-CoV-2 может, подавляя АПФ2, приводить к токсическому избыточному накоплению ангиотензина II и брадикинина , что вызывает острый респираторный дистресс-синдром , отёк лёгких и миокардит .
Механизм течения COVID-19
Группа учёных при изучении механизмов течения коронавирусного заболевания обратила внимание на работу гормональной системы регулирования кровяного давления ( РААС ). Поскольку коронавирус прикрепляется к ангиотензин -рецептору на поверхности клетки и увеличивает синтез АПФ2, попадая с помощью этой молекулы в клетку, это вызывает значительное увеличение концентрации брадикинина ( брадикининовый шторм ) и критические осложнения, особенно у пациентов с гипертонией , принимающих препараты с брадикинином для регулирования кровяного давления :
- неадекватное расширение сосудов = слабость, утомляемость, нарушения ритма сердца;
- увеличение проницаемости сосудов, что приводит к росту миграции иммунных клеток и усилению воспаления, а также риску отёков ;
- усиление синтеза гиалуроновой кислоты (в том числе, в легких), которая вместе с тканевой жидкостью образует гидрогель в просвете альвеол, вызывая проблемы с дыханием и обусловливая неэффективность ИВЛ ;
- потенциальное увеличение концентрации тканевого активатора плазминогена , с ростом риска кровотечений;
- потенциальное повышение проницаемости гематоэнцефалического барьера , вызывающее неврологическую симптоматику.
В исследовании отмечается, что побочными эффектами ИАПФ являются потеря обоняния, сухой кашель и утомляемость, отмечаемые при коронавирусной инфекции .
Академик В.В. Зверев с коллегами (П.О. Шатунова, А.С. Быков, О.А. Свитич) , проанализировав межмолекулярные взаимодействия, установили что SARS-CoV-2 более вирулентен вследствие снижения свободной энергии при связывании с АПФ2 (АСЕ2), транспортирующим вирус в клетку-хозяина. Детальное изучение этого фермента, который является рецептором на поверхности различных тканей организма человека и в норме отвечает за превращение ангиотензина II в ангиотензин (1–7), привело учёных к выводу о том, что перспективным терапевтическим направлением при коронавирусной инфекции может оказаться влияние на ренин-ангиотензиновую систему. Дело в том, что рецептор АПФ2 — нетканеспецифичный: он широко распространен в сердце, почках, тонкой кишке, яичках, щитовидной железе, жировой ткани. Он не только регулирует давление, но также подавляет воспаление, преимущественно в лёгочной ткани , участвует в транспорте аминокислот и поддерживает жизнедеятельность микробиома кишечника. Учёные получили предварительные данные об эффективности применения ингибиторов и блокаторов АПФ2 для лечения пациентов с коронавирусной инфекцией .
Учёные подчёркивают, что смертность от COVID-19 повышается в группах пожилых людей (старше 70 лет) и лиц с хроническими заболеваниями (гипертензией, сахарным диабетом, сердечно-сосудистыми нарушениями), принимающих лекарства, ингибирующие рецепторы АПФ. Поскольку АПФ2, расположенный на альвеолярных эпителиальных клетках, служит котранспортером для SARS-CoV-2 в клетки лёгких человека, изучение этого рецептора является ключом для понимания механизма развития COVID-19 .
АПФ, вакцины и лечение ковида
Академик В.В. Зверев , разъясняя механизм действия вакцин от коронавируса и говоря, что они, по идее, должны помогать от всех штаммов, обратил внимание на риск блокирования АПФ2 в результате образования стимулированных вакциной антител на тот участок вируса, который связывается с рецептором АПФ2, поскольку эти же антитела могут взаимодействовать и с этим самым человеческим белком. «А этот рецептор вовсе не для вируса. Он существует для очень важного фермента клеточного, который участвует в нормализации давления», — подчеркнул академик. Он также отметил, что у детей рецепторов АПФ2 очень мало, поэтому они практически не болеют и их вообще не надо вакцинировать: «Таких детей, которые умирают, вообще нельзя вакцинировать ничем и ни от чего. Это дети с тяжелой „хроникой“, с нарушенным здоровьем. Таких детей надо беречь и лечить правильно» .
Группа учёных под руководством академика Зверева изучала роль АПФ2 в ряде патологических и физиологических состояний и установила, что дефицит этого белка способен вызвать тяжелые заболевания органов дыхания и острые патологические респираторные состояния, причём не только при коронавирусной инфекции. Наличие AПФ2 в яичках и тестикулярных сосудах объясняет большую восприимчивость мужчин к COVID-19. Рост риска смертности для мужчин по сравнению с женщинами и для пожилых людей относительно молодых связан с возрастными и функциональными особенностями механизмов врожденного и адаптивного иммунитета и способностью SARS-CoV-2 вызывать цитокиновый шторм и иммунопатологические нарушения у пациентов с коронавирусной инфекцией .
Напротив, у лабораторных мышей при массивном отёке легких, гипоксии , гиалинозе и воспалительных клеточных инфильтратов , при введении рекомбинантного АПФ2 лёгочная ткань восстанавливалась. АПФ2 также положительно влияет на нереспираторные органы: повышает сократительную способность сердца, предотвращает почечные воспаления, участвует во всасывании аминокислот через тонкий кишечник, регулируя секрецию антимикробных пептидов, влияющих на состав кишечного микробиома. Концентрация AПФ2 может увеличиваться после ишемического инсульта, что является компенсаторной реакцией по устранению избытка Ang1-7 .
Рекомбинантный АПФ2
Создан человеческий рекомбинантный растворимый ангиотензинпревращающий фермент 2 (hrsACE2), который под названием APN01 уже проходит вторую фазу клинических испытаний на способность лечить от пневмонии, вызванной коронавирусом SARS-CoV-2 . Предполагается что APN01, имитируя человеческий АПФ2, позволяет двояко противодействовать болезни. Во-первых, вирус связывается с растворимым АПФ2 / APN01 вместо АПФ2 на клеточной поверхности, что означает, что вирус больше не может заразить клетки. Во-вторых, APN01, действуя как АПФ2, уменьшает вредные воспалительные реакции в лёгких и других органах и защищает их от повреждения
См. также
Примечания
- ↑ - Ensembl , May 2017
- ↑ - Ensembl , May 2017
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ↑ . National Center for Biotechnology Information (NCBI) . U.S. National Library of Medicine (28 февраля 2020). Дата обращения: 10 мая 2020. 24 декабря 2014 года.
- ↑ Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N et al. (англ.) // : journal. — 2000. — Vol. 87 , no. 5 . — P. E1—9 . — doi : . — .
- Keidar S., Kaplan M., Gamliel-Lazarovich A. (англ.) // : journal. — 2007. — February ( vol. 73 , no. 3 ). — P. 463—469 . — doi : . — . 23 января 2009 года.
- Wang W., McKinnie S. M., Farhan M., Paul M., McDonald T., McLean B., Llorens-Cortes C., Hazra S., Murray A. G., Vederas J. C., Oudit G. Y. Angiotensin Converting Enzyme 2 Metabolizes and Partially Inactivates Pyrapelin-13 and Apelin-17: Physiological Effects in the Cardiovascular System (англ.) // Hypertension : journal. — 2016. — May ( vol. 68 ). — P. 365—377 . — doi : . — .
- Kasmi Y., Khataby K., Souiri A. // Emerging and Reemerging Viral Pathogens / Ennaji M. M.. — Elsevier , 2019. — Т. Volume 1: Fundamental and Basic Virology Aspects of Human, Animal and Plant Pathogens. — С. 135. — ISBN 978-0-12-819400-3 .
- Lambert D. W., Yarski M., Warner F. J., Thornhill P., Parkin E. T., Smith AI et al. (англ.) // J Biol Chem : journal. — 2005. — Vol. 280 , no. 34 . — P. 30113—30119 . — doi : . — .
- Kabbani, Nadine; Olds, James L. Does COVID19 infect the brain? If so, smokers might be at a higher risk (англ.) // : journal. — 2020. — 1 April ( vol. 97 , no. 5 ). — P. 351—353 . — doi : . — .
- Baig A. M. (англ.) // CNS Neuroscience & Therapeutics. — 2020. — May ( vol. 26 , no. 5 ). — P. 499—501 . — doi : . — .
- Baig A. M. , Khaleeq A. , Ali U. , Syeda H. (англ.) // ACS Chemical Neuroscience. — 2020. — 1 April ( vol. 11 , no. 7 ). — P. 995—998 . — doi : . — .
- . Entnet.org. Дата обращения: 4 мая 2020. Архивировано из 24 марта 2020 года.
- ↑ Tipnis S. R., Hooper N. M., Hyde R., Karran E., Christie G., Turner A. J. (англ.) // J Biol Chem : journal. — 2000. — Vol. 275 , no. 43 . — P. 33238—33243 . — doi : . — .
- ↑ Vickers C., Hales P., Kaushik V., Dick L., Gavin J., Tang J et al. (англ.) // J Biol Chem : journal. — 2002. — Vol. 277 , no. 17 . — P. 14838—14843 . — doi : . — .
- Kowalczuk S., Bröer A., Tietze N., Vanslambrouck J. M., Rasko J. E., Bröer S. (англ.) // : journal. — , 2008. — Vol. 22 , no. 8 . — P. 2880—2887 . — doi : . — .
- Camargo S. M., Singer D., Makrides V., Huggel K., Pos K. M., Wagner CA et al. (англ.) // Gastroenterology : journal. — 2009. — Vol. 136 , no. 3 . — P. 872—882 . — doi : . — .
- Kuba K., Imai Y., Rao S., Gao H., Guo F., Guan B., Huan Y., Yang P., Zhang Y., Deng W., Bao L., Zhang B., Liu G., Wang Z., Chappell M., Liu Y., Zheng D., Leibbrandt A., Wada T., Slutsky A. S., Liu D., Qin C., Jiang C., Penninger J. M. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury (англ.) // Nature Medicine : journal. — 2005. — August ( vol. 11 , no. 8 ). — P. 875—879 . — doi : . — .
- Letko, Michael; Munster, Vincent. Functional assessment of cell entry and receptor usage for lineage B β-coronaviruses, including 2019-nCoV (англ.) // bioRxiv : journal. — 2020. — 22 January. — P. 2020.01.22.915660 . — doi : .
- Gralinski, Lisa E.; Menachery, Vineet D. // Viruses. — 2020. — Т. 12 , № 2 . — С. 135 . — doi : . 1 февраля 2020 года.
- Ou X., Liu Y., Lei X., Li P., Mi D., Ren L. et al. (англ.) // Nature Communications : journal. — Nature Publishing Group , 2020. — Vol. 11 , no. 1 . — P. 1620 . — doi : . — .
- van de Veerdonk, F.; Netea, M.G.; van Deuren, M.; van der Meer, J.W.; de Mast, Q.; Bruggemann, R.J.; van der Hoeven, H. Kinins and Cytokines in COVID-19: A Comprehensive Pathophysiological Approach. Preprints 2020, 2020040023 (doi: 10.20944/preprints202004.0023.v1). от 8 апреля 2020 на Wayback Machine (англ.)
- Hanff, T. C., Harhay, M. O., Brown, T. S., Cohen, J. B., & Mohareb, A. M. (2020). Is There an Association Between COVID-19 Mortality and the Renin-Angiotensin System—a Call for Epidemiologic Investigations. Clinical Infectious Diseases. PMID doi :
- Cheng, H., Wang, Y., & Wang, G. Q. (2020). Organ‐protective Effect of Angiotensin‐converting Enzyme 2 and its Effect on the Prognosis of COVID‐19. Journal of Medical Virology. PMID doi :
- ↑ Шахматова, О.О. . cardioweb.ru . НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ ИССЛЕДОВАТЕЛЬСКИЙ ЦЕНТР КАРДИОЛОГИИ Министерства здравоохранения РФ. Дата обращения: 23 ноября 2020. 30 ноября 2020 года.
- Huamin Henry Li. (англ.) // MedScape. — 2018-09-04. 19 ноября 2020 года.
- ↑ Полина Олеговна Шатунова, Анатолий Сергеевич Быков, Оксана Анатольевна Свитич, Виталий Васильевич Зверев. // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2020-09-02. — Т. 97 , вып. 4 . — С. 339–345 . — ISSN . — doi : . 22 декабря 2021 года.
- Руслан Давлетшин. . Вечерняя Москва (9 ноября 2021). Дата обращения: 22 декабря 2021. 22 декабря 2021 года.
- . Дата обращения: 4 апреля 2020. 7 апреля 2020 года.
Литература
- Turner A. J., Tipnis S. R., Guy J. L., Rice G., Hooper N. M. ACEH/ACE2 is a novel mammalian metallocarboxypeptidase and a homologue of angiotensin-converting enzyme insensitive to ACE inhibitors (англ.) // : journal. — 2002. — April ( vol. 80 , no. 4 ). — P. 346—353 . — doi : . — .
- Turner A. J., Hiscox J. A., Hooper N. M. ACE2: from vasopeptidase to SARS virus receptor (англ.) // : journal. — Cell Press , 2004. — June ( vol. 25 , no. 6 ). — P. 291—294 . — doi : . — .
- Katovich M. J., Grobe J. L., Huentelman M., Raizada M. K. Angiotensin-converting enzyme 2 as a novel target for gene therapy for hypertension (англ.) // : journal. — 2005. — May ( vol. 90 , no. 3 ). — P. 299—305 . — doi : . — .
- Ferrario C. M., Trask A. J., Jessup J. A. Advances in biochemical and functional roles of angiotensin-converting enzyme 2 and angiotensin-(1-7) in regulation of cardiovascular function (англ.) // : journal. — 2005. — December ( vol. 289 , no. 6 ). — P. H2281—90 . — doi : . — .
- Jia H. P., Look D. C., Hickey M., Shi L., Pewe L., Netland J., Farzan M., Wohlford-Lenane C., Perlman S., McCray P. B. (англ.) // : journal. — Springer Nature , 2006. — Vol. 581 . — P. . — ISBN 978-0-387-26202-4 . — doi : . — .
- Lazartigues E., Feng Y., Lavoie J. L. The two fACEs of the tissue renin–angiotensin systems: implication in cardiovascular diseases (англ.) // : journal. — 2007. — Vol. 13 , no. 12 . — P. 1231—1245 . — doi : . — .
- Raizada M. K., Ferreira A. J. ACE2: a new target for cardiovascular disease therapeutics (англ.) // Journal of Cardiovascular Pharmacology : journal. — 2007. — August ( vol. 50 , no. 2 ). — P. 112—119 . — doi : . — .
- Dean R. G., Burrell L. M. ACE2 and diabetic complications (англ.) // : journal. — 2007. — Vol. 13 , no. 26 . — P. 2730—2735 . — doi : . — .
- Tipnis S. R., Hooper N. M., Hyde R., Karran E., Christie G., Turner A. J. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase (англ.) // The Journal of Biological Chemistry : journal. — 2000. — October ( vol. 275 , no. 43 ). — P. 33238—33243 . — doi : . — .
- Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N., Donovan M., Woolf B., Robison K., Jeyaseelan R., Breitbart R. E., Acton S. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9 (англ.) // : journal. — 2000. — September ( vol. 87 , no. 5 ). — P. E1—9 . — doi : . — .
- Vickers C., Hales P., Kaushik V., Dick L., Gavin J., Tang J., Godbout K., Parsons T., Baronas E., Hsieh F., Acton S., Patane M., Nichols A., Tummino P. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase (англ.) // The Journal of Biological Chemistry : journal. — 2002. — April ( vol. 277 , no. 17 ). — P. 14838—14843 . — doi : . — .
- Crackower M. A., Sarao R., Oudit G. Y., Yagil C., Kozieradzki I., Scanga S. E., Oliveira-dos-Santos A. J., da Costa J., Zhang L., Pei Y., Scholey J., Ferrario C. M., Manoukian A. S., Chappell M. C., Backx P. H., Yagil Y., Penninger J. M. Angiotensin-converting enzyme 2 is an essential regulator of heart function (англ.) // Nature : journal. — 2002. — June ( vol. 417 , no. 6891 ). — P. 822—828 . — doi : . — .
- Harmer D., Gilbert M., Borman R., Clark K. L. Quantitative mRNA expression profiling of ACE 2, a novel homologue of angiotensin converting enzyme (англ.) // : journal. — 2002. — December ( vol. 532 , no. 1—2 ). — P. 107—110 . — doi : . — .
- Donoghue M., Wakimoto H., Maguire C. T., Acton S., Hales P., Stagliano N., Fairchild-Huntress V., Xu J., Lorenz J. N., Kadambi V., Berul C. I., Breitbart R. E. Heart block, , and sudden death in ACE2 transgenic mice with downregulated connexins (англ.) // : journal. — 2003. — September ( vol. 35 , no. 9 ). — P. 1043—1053 . — doi : . — .
- Clark H. F., Gurney A. L., Abaya E., Baker K., Baldwin D., Brush J., Chen J., Chow B., Chui C., Crowley C., Currell B., Deuel B., Dowd P., Eaton D., Foster J., Grimaldi C., Gu Q., Hass P. E., Heldens S., Huang A., Kim H. S., Klimowski L., Jin Y., Johnson S., Lee J., Lewis L., Liao D., Mark M., Robbie E., Sanchez C., Schoenfeld J., Seshagiri S., Simmons L., Singh J., Smith V., Stinson J., Vagts A., Vandlen R., Watanabe C., Wieand D., Woods K., Xie M. H., Yansura D., Yi S., Yu G., Yuan J., Zhang M., Zhang Z., Goddard A., Wood W. I., Godowski P., Gray A. The secreted protein discovery initiative (SPDI), a large-scale effort to identify novel human secreted and transmembrane proteins: a bioinformatics assessment (англ.) // : journal. — 2003. — October ( vol. 13 , no. 10 ). — P. 2265—2270 . — doi : . — . — PMC .
- Li W., Moore M. J., Vasilieva N., Sui J., Wong S. K., Berne M. A., Somasundaran M., Sullivan J. L., Luzuriaga K., Greenough T. C., Choe H., Farzan M. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus (англ.) // Nature : journal. — 2003. — November ( vol. 426 , no. 6965 ). — P. 450—454 . — doi : . — .
- Wong S. K., Li W., Moore M. J., Choe H., Farzan M. A 193-amino acid fragment of the SARS coronavirus S protein efficiently binds angiotensin-converting enzyme 2 (англ.) // The Journal of Biological Chemistry : journal. — 2004. — January ( vol. 279 , no. 5 ). — P. 3197—3201 . — doi : . — .
- Towler P., Staker B., Prasad S. G., Menon S., Tang J., Parsons T., Ryan D., Fisher M., Williams D., Dales N. A., Patane M. A., Pantoliano M. W. ACE2 X-ray structures reveal a large hinge-bending motion important for inhibitor binding and catalysis (англ.) // The Journal of Biological Chemistry : journal. — 2004. — April ( vol. 279 , no. 17 ). — P. 17996—18007 . — doi : . — .
- 2021-08-06
- 1