Interested Article - Динамика белков

- 2021-05-15
- 2

Считается, что белки имеют уникальные структуры, определяемые их аминокислотными последовательностями. Однако белки не являются строго статическими объектами, а скорее представляют ансамбли (иногда похожие) конформаций. Переходы между этими состояниями происходят в различных масштабах длины (от десятых Å до нм ) и временных масштабах (от нс до с) и связаны с функционально значимыми явлениями, такими как аллостерическая передача сигналов и ферментативный катализ .
Изучение динамики белков наиболее непосредственно связано с переходами между этими состояниями, но также может включать природу и равновесные популяции самих состояний. Эти две точки зрения — кинетика и термодинамика соответственно — могут быть концептуально синтезированы в парадигме «энергетического ландшафта» : распространённые состояния и кинетика переходов между ними может быть описана глубиной энергетических ям и высотой энергетических барьеров, соответственно.
Локальная гибкость: атомы и аминокислотные остатки
Части белковых структур часто отклоняются от состояния равновесия. Некоторые из таких отклонений являются гармоническими , например, стохастические колебания химических связей и валентных углов. Другие являются , например, боковые цепи, которые прыгают между отдельными дискретными минимумами энергии, или ротамеры .
Доказательства локальной гибкости часто получают с . Гибкие и потенциально неупорядоченные области белка можно обнаружить с помощью . Гибкость свернутых белков можно определить путем анализа отдельных атомов в белке. Гибкость также можно наблюдать на картах электронной плотности с очень высоким разрешением, созданных с помощью рентгеновской кристаллографии особенно когда дифракционные данные собираются при комнатной температуре вместо традиционной криогенной температуры (обычно около 100 К) . Информация о частотном распределении и динамике локальной гибкости белка может быть получена с помощью рамановской спектроскопии и оптической спектроскопии эффекта Керра в терагерцевой частотной области .
Региональная гибкость: внутридоменное соединение с несколькими остатками

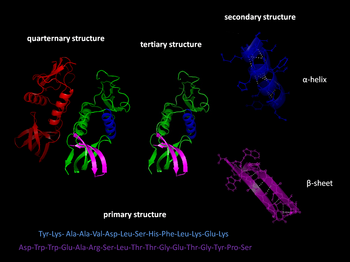
Многие остатки в белковых структурах находятся в непосредственной пространственной близости. Это верно для большинства остатков, которые являются смежными в первичной последовательности, но также и для многих остатков, которые являются дистальными по последовательности, но вступают в контакт в окончательной складчатой структуре. Из-за этой близости энергетические ландшафты этих остатков становятся связанными на основе различных биофизических явлений, таких как водородные связи , ионные связи и ван-дер-ваальсовы взаимодействия (см. рисунок). Таким образом, переходы между состояниями для таких наборов остатков становятся коррелированными .
Это, пожалуй, наиболее очевидно для открытых петель, которые часто коллективно смещаются, принимая различные конформации в различных кристаллических структурах (см. рисунок). Однако сопряженная конформационная гетерогенность также иногда очевидна во вторичной структуре . Например, последовательные остатки и остатки, смещенные на 4 в первичной последовательности, часто взаимодействуют в α-спиралях . Кроме того, остатки, смещенные на 2 в первичной последовательности, направляют свои боковые цепи к одной и той же стороне β-листов и достаточно близки для стерического взаимодействия, как и остатки на соседних нитях одного и того же β-листа . Некоторые из этих конформационных изменений индуцируются посттрансляционными модификациями структуры белка, такими как фосфорилирование и метилирование .

Когда эти связанные остатки образуют пути, связывающие функционально важные части белка, они могут участвовать в аллостерической передаче сигналов. Например, когда молекула кислорода связывается с одной субъединицей тетрамера гемоглобина , эта информация аллостерически распространяется на другие три субъединицы, тем самым повышая их сродство к кислороду. В этом случае сопряженная гибкость гемоглобина позволяет кооперативному связыванию кислорода, что является физиологически полезным, поскольку оно обеспечивает быструю кислородную нагрузку в ткани легких и быструю разгрузку кислородом в тканях, лишенных кислорода (например, в мышцах).
Глобальная гибкость: несколько доменов
Наличие нескольких доменов в белках дает большую гибкость и подвижность , что приводит к динамике белковых доменов . Движения доменов могут быть выведены путем сравнения различных структур белка (как в ), или их можно непосредственно наблюдать с помощью спектров измеренных с помощью спектроскопии Они также могут быть предложены путем отбора проб в обширных траекториях молекулярной динамики и анализа главных компонент . Движение домена важно для:
- Катализ
- Клеточная локомоции и моторные белки
- Образование белковых комплексов
- Ионные каналы
- Механорецепторы и
- Регулирующая деятельность
- Транспорт метаболитов через клеточные мембраны
Одно из самых крупных наблюдаемых перемещений домена — это «поворотный» механизм в . Фосфоинозитидный домен переключается между двумя состояниями, чтобы переместить фосфатную группу из активного центра нуклеотид-связывающего домена в фосфоенолпируватный/пируватный домен . Фосфатная группа перемещается на расстояние 45 Å с движением домена на около 100 градусов вокруг единственного остатка. В ферментах замыкание одного домена на другой захватывает субстрат за счет индуцированной подгонки, позволяя реакции протекать контролируемым образом. Подробный анализ Герштейна привел к классификации двух основных типов движения домена; шарнир и ножницы . Только относительно небольшая часть цепи, а именно междоменный линкер и боковые цепи претерпевают значительные конформационные изменения при перестройке домена .
Шарниры с помощью вторичных структур
Исследование Хейворда показало, что концы α-спиралей и β-листов во многих случаях образуют шарниры. Было обнаружено, что многие петли включают в себя два вторичных элемента конструкции, действующих как дверные петли, позволяя открывать и закрывать двери. Это может возникнуть, когда две соседние нити в β-листе, расположенные в одном домене, расходятся, когда они присоединяются к другому домену. Два результирующих конца затем образуют области изгиба между двумя доменами. Было обнаружено, что α-спирали, которые сохраняют свою сеть водородных связей при изгибе, ведут себя как механические шарниры, накапливая «упругую энергию», которая управляет закрытием доменов для быстрого захвата субстрата .
От спиральной до расширенной конформации
Взаимопревращение спиральных и протяженных конформаций на участке границы домена не является чем-то необычным. В кальмодулине торсионные углы изменяются для пяти остатков в середине домена, связывающего α-спираль. Спираль разделена на две почти перпендикулярные более мелкие спирали, разделенные четырьмя остатками удлиненной цепи .
Сдвиговые движения
Сдвиговые движения включают в себя небольшое скользящее движение границ раздела доменов, контролируемое боковыми цепями аминокислот внутри границы раздела. Белки, демонстрирующие сдвиговые движения, часто имеют многоуровневую архитектуру: складывание вторичных структур. Междоменный линкер выполняет лишь роль удержания доменов в непосредственной близости.
Движение домена и функциональная динамика в ферментах
Анализ внутренней динамики структурно различных, но функционально подобных ферментов выявил общую взаимосвязь между расположением активного сайта и двух основных субдоменов белка. Фактически, для некоторых членов суперсемейства гидролаз каталитический центр расположен близко к границе раздела двух основных квазижестких доменов . Такое позиционирование, по-видимому, является инструментом для поддержания точной геометрии активного сайта , в то же время обеспечивая заметную функционально ориентированную модуляцию фланкирующих областей в результате относительного движения двух субдоменов.
Последствия для макромолекулярной эволюции
Данные свидетельствуют о том, что динамика белков важна для функционирования, например, для ферментативного катализа при DHFR , но также предполагается, что они облегчают приобретение новых функций в результате молекулярной эволюции . Этот аргумент предполагает, что белки эволюционировали, чтобы иметь стабильные, в основном уникальные складчатые структуры, но неизбежная остаточная гибкость приводит к некоторой степени функциональной неразборчивости, которая может быть усилена/задействована/отклонена с помощью последующих мутаций.
Однако растет понимание того, что довольно распространены в геномах эукариот ставит под сомнение простейшую интерпретацию : «последовательность определяет структуру (единую)». Фактически, новая парадигма характеризуется добавлением двух оговорок: «последовательность и клеточная среда определяют структурный ансамбль».
Примечания
- ↑ Protein Structure and Diseases. — 2011. — P. 163–221. — ISBN 9780123812629 . — doi : .
- "Hidden alternative structures of proline isomerase essential for catalysis". Nature . 462 (7273): 669—673. Dec 2009. Bibcode : . doi : . PMID .
- "The energy landscapes and motions of proteins". Science . 254 (5038): 1598—1603. Dec 1991. Bibcode : . doi : . PMID .
- Dunbrack, Roland L (August 2002). "Rotamer Libraries in the 21st Century". Current Opinion in Structural Biology . 12 (4): 431—440. doi : . PMID .
- "The backrub motion: how protein backbone shrugs when a sidechain dances". Structure . 14 (2): 265—274. Feb 2006. doi : . PMID .
- "Accessing protein conformational ensembles using room-temperature X-ray crystallography". Proceedings of the National Academy of Sciences of the United States of America . 108 (39): 16247—16252. Sep 2011. Bibcode : . doi : . PMID .
- "Terahertz underdamped vibrational motion governs protein-ligand binding in solution". Nature Communications . 5 : 3999. June 2014. Bibcode : . doi : . PMID .
- "Dynamic regimes and correlated structural dynamics in native and denatured alpha-lactalbumin". Journal of Molecular Biology . 312 (4): 865—873. Sep 2001. doi : . PMID .
- ↑ "Computational study of conformational changes in human 3-hydroxy-3-methylglutaryl coenzyme reductase induced by substrate binding". Journal of Biomolecular Structure & Dynamics . 37 (16): 4374—4383. October 2019. doi : . PMID .
-
.
PLOS Computational Biology
.
2
(4): e32. April 2006.
Bibcode
:
.
doi
:
.
PMID
.
{{ cite journal }}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) ( ссылка ) - "Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy". Biophysical Journal . 99 (10): 3473—3482. Nov 2010. Bibcode : . doi : . PMID .
- (PDF) . Proceedings of the National Academy of Sciences of the United States of America . 102 (49): 17646—17651. Dec 2005. Bibcode : . doi : . PMID . (PDF) из оригинала 27 апреля 2021 . Дата обращения: 23 августа 2021 .
- ↑ "Coarse-grained description of protein internal dynamics: an optimal strategy for decomposing proteins in rigid subunits". Biophysical Journal . 96 (12): 4993—5002. Jun 2009. Bibcode : . doi : . PMID .
- "LSD1/CoREST is an allosteric nanoscale clamp regulated by H3-histone-tail molecular recognition". Proceedings of the National Academy of Sciences of the United States of America . 109 (31): 12509—14. Jul 2012. Bibcode : . doi : . PMID .
- ABC Transporters in Microorganisms. — ISBN 978-1-904455-49-3 .
- "At the dawn of the 21st century: Is dynamics the missing link for understanding enzyme catalysis?". Proteins . 78 (6): 1339—75. May 2010. doi : . PMID .
- Mechanics of motor proteins and the cytoskeleton. — 2001. — ISBN 9780878933334 .
- "Controllable Activation of Nanoscale Dynamics in a Disordered Protein Alters Binding Kinetics". Journal of Molecular Biology . 429 (7): 987—998. Apr 2017. doi : . PMID .
- ↑ "Structural mechanisms for domain movements in proteins". Biochemistry . 33 (22): 6739—49. Jun 1994. doi : . PMID .
- "Alpha-catenin structure and nanoscale dynamics in solution and in complex with F-actin". Biophysical Journal . 115 (4): 642—654. Aug 21, 2018. Bibcode : . doi : . PMID .
- Biochemistry. — 2011. — ISBN 9780470570951 .
- "Swiveling-domain mechanism for enzymatic phosphotransfer between remote reaction sites". Proceedings of the National Academy of Sciences of the United States of America . 93 (7): 2652—7. Apr 1996. Bibcode : . doi : . PMID .
- "Structural domains in proteins and their role in the dynamics of protein function". Progress in Biophysics and Molecular Biology . 42 (1): 21—78. 1983. doi : . PMID .
- ↑ "Structural principles governing domain motions in proteins". Proteins . 36 (4): 425—35. Sep 1999. doi : . PMID .
- "Target enzyme recognition by calmodulin: 2.4 A structure of a calmodulin-peptide complex". Science . 257 (5074): 1251—1255. Aug 1992. Bibcode : . doi : . PMID .
- "Solution structure of a calmodulin-target peptide complex by multidimensional NMR". Science . 256 (5057): 632—638. May 1992. Bibcode : . doi : . PMID .
- . Science . 324 (5924): 203—207. Apr 2009. Bibcode : . doi : . PMID .
- "Intrinsically unstructured proteins and their functions". Nature Reviews Molecular Cell Biology . 6 (3): 197—208. Mar 2005. doi : . PMID .
- 2021-05-15
- 2