Interested Article - Деацетилазы гистонов

- 2021-02-01
- 1

Деацетилазы гистонов ( англ. Histone deacetylases , HDACs ), ( КФ 3.5.1) — ферменты , катализирующие удаление ацетильной группы ε-N-ацетил-лизина гистонов , внесенные ферментами гистонацетилазами (histone acetylases, HATs) в остатки K3 и K14 гистона Н3 и K5, K8, K12 и K16 гистона Н4, а также остатки некоторых лизинов гистонов Н2А и Н2B. Модифицируя гистоны и изменяя конформацию хроматина , гистондеацетилазы играют важную роль в регуляции экспрессии генов . В то время как гиперацетилирование гистонов под действием гистонацетилаз обычно связано с повышением транскрипционной активности, гистондеацетилазы вызывают гипоацетилирование и вследствие, репрессию генов. Гипоацетилирование приводит к уменьшению промежутка между нуклеосомой и намотанной на неё ДНК. Более плотная упаковка ДНК уменьшает её доступность для транскрипционных факторов, что приводит к транскрипционной репрессии. Обычно гистондеацетилазы действуют в составе крупных комплексов, вместе с другими белками подавляющими активность хроматина. Субстратами гистондеацетилаз могут быть не только гистоны, но и некоторые другие белки (p53, E2F, a-тубулин и MyoD).
Классификация
Семейство состоит из 18 белков, принадлежащих к 4-м классам. 11 представителей, принадлежащие к I (reduced potassium dependency 3 (RPD3)-подобные; HDAC1, HDAC2, HDAC3, HDAC8) , II (класс дрожжевой гистон деацетилазы 1, Hda1; не путать с HDACI!; HDAC4, HDAC5, HDAC6, HDAC7, HDAC9, HDAC10) и IV классам (HDAC11), названы «классическими» гистон деацетилазами, в то время как представители класса III названы сиртуинами. Представители I и II классов ингибируются трихостатином А (ТСА, TSA), в то время как представители других классов нечувствительны к нему.
У растений семейство гистондеацетилаз тоже включает 18 представителей, принадлежащих к 3 классам: I (RPD3-подобные), HD-туины (встречающиеся только у растений) и сиртуины.
| Класс | Фермент | Количество каталитических участков | Клеточная локализация | Тканевое распределение | Субстрат(ы) | Взаимодействующие белки | Нокаутный фенотип |
|---|---|---|---|---|---|---|---|
| I | HDAC1 | 1 | Ядро | Универсальное | Андрогенный рецептор , , p53 , , E2F1 , STAT3 | – | эмбриональная летальность, повышенное ацетилирование гистонов, повышение уровня p21 и p27 |
| HDAC2 | 1 | Ядро | Универсальное | Глюкокортикоидный рецептор , , BCL6 , STAT3 | – | аномалии сердца | |
| HDAC3 | 1 | Ядро | Универсальное | , , GATA1 , RELA , STAT3 , | – | – | |
| HDAC8 | 1 | Ядро | Универсальное (?) | – | – | ||
| IIA | HDAC4 | 1 | Ядро / цитоплазма | сердце, скелетные мышцы, мозг | , GATA1 , | Нарушения дифференцировки хондроцитов | |
| HDAC5 | 1 | Ядро / цитоплазма | сердце, скелетные мышцы, мозг | , , | , | аномалии сердца | |
| HDAC7 | 1 | Ядро / цитоплазма | сердце, скелетные мышцы, поджелудочная железа, плацента | , | HIF1A , BCL6 , , , , Андрогенный рецептор , | Регулирование целостности сосудов, увеличение | |
| HDAC9 | 1 | Ядро / цитоплазма | скелетные мышцы, мозг | – | FOXP3 | аномалии сердца | |
| IIB | HDAC6 | 2 | В основном цитоплазма | сердце, печень, почки, плацента | α-Тубулин , , , | – | |
| HDAC10 | 1 | В основном цитоплазма | печень, селезёнка, почки | – | – | – | |
| III | млекопитающих ( , , , , , , ) | – | – | – | – | – | – |
| дрожжей S. cerevisiae | – | – | – | – | – | – | |
| IV | HDAC11 | 2 | Ядро / цитоплазма | мозг, сердце, скелетные мышцы, почки | – | – | – |
Все деацетилазы гистонов, кроме III класса, содержат цинк и, т. о., являются цинк-зависимыми.
Механизм катализа
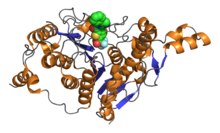
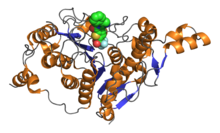
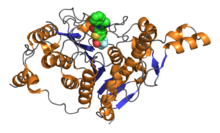
Последовательность из 390 остатков аминокислот образует каталитический домен классических HDAC, который включает также высококонсервативные аминокислоты. Активный сайт представляет собой слегка искривленный трубчатый карман с более широким дном. Ацетильная группа удаляется путём системы с переменой заряда, состоящей из двух соседних гистидинов, двух аспартатов (на расстоянии примерно 30 аминокислот от гистидинов, разделены приблизительно 6 аминокислотами), а также тирозина (123 аминокислот от аспартатов). Важный компонент системы перемены зарядов — Zn 2+ , связанный на дне кармана. Для катализа также важны другие кофакторы: большинство рекомбинантных гистондеацетилаз неактивно.
Сиртуины
Особенность сиртуинов (название взято от одного из представителей — silent information regulator 2 (Sir2)) — использование НАД + как субстрата. Они не чувствительны к ингибированию ТСА, но чувствительны к сиртинолу. У дрожжей главным образом деацетилирует Н4К16, Н3К56 и Н3К9; в меньшей степени — Н3К14. Дрожжевой Sir2 участвует, прежде всего в сайленсинге теломерных последовательностей, рРНК , молчащего локуса типа спаривания, а также в подавлении рекомбинации рДНК. Sir2 также участвует в регуляции продолжительности жизни: он вовлечен в предотвращение образования внехромосомных колец рДНК, связанных со клетки. Sir2 у дрожжей , а также его гомологи у млекопитающих играют ключевую роль в эпигенетическом сайленсинге генов, в репарации и рекомбинации ДНК, клеточном цикле , организации микротрубочек и регуляции старения.
Ингибиторы гистондеацетилаз (HDACi)
На настоящий момент существует ряд ингибиторов гистондеацетилаз, начиная со сложных соединений выделенных из бактерий и грибов (ТСА, тапоксин), и кончая относительно простыми соединениями (бутират). Большинство HDACi имеют трехкомпонентную структуру, состоящую из цинк-связывающего участка, линкера и последовательностью, взаимодействующей с аминокислотными остатками у входа в активный центр HDAC. Ингибиторы классических деацетилаз функционируют путём вытеснения иона цинка из активного центра и таким образом инактивируя систему смены зарядов. ТСА обладает оптимальной конформацией для попадания в активный центр, имея гидроксаматную группу и пятиуглеродный линкер перед фенильной группой. ТСА вызывает наисильнейший обратимый эффект из известных HDACi (его IC50% находится в наномолярной области). HDACi вызывают гиперацетилирование, активацию транскрипции, и по некоторым данным, активное деметилирование ДНК. Поскольку HDACi замедляют рост и приводят к дифференцировке и апоптозу раковых клеток, ведутся активные разработки по их применению для терапии рака ( вориностат , , белиностат ).
HDACi индуцируют апоптоз, арест клеточного цикла, старение, дифференцировку, иммуногенность клеток и ингибируют ангиогенез при некоторых видах рака (West et al., 2014). Наиболее успешными примерами использования HDACi являются вориностат и ромидепсин у пациентов с рефракторной кожной и периферической Т-клеточной лимфомой. (Whittaker et al., 2010). В соответствии с химической структурой можно выделить 4 класса HDACi – гидроксаматы, циклические пептиды, алифатические кислоты и бензамиды . Большая часть сведений об этих молекулах основана на онкологических исследованиях. К пан-HDACi (неспецифическим HDACi) в основном относятся гидроксаматы.
Гидроксаматы представлены трихостатином А (TSA), который ингибирует рост клеток при раке легкого и груди ( Yoshida et al., 1995 ) и является пан-клеточным ингибитором HDAC. TSA не вошел в клиническую практику по причине нежелательных явлений – апоптоз нормальных клеток и повреждение ДНК ( Rodriguez-Paredes et al., 2011 ). Суберанилогидроксаминовая кислота (SAHA) (вориностат) также является гидроксаматом, это первый HDACi, одобренный FDA для клинического применения ( Grozinger et al., 2002 ). Его действие приводит к активации антипролиферативных генов p21WAF1, p27 KIP1, DR5 и TNFα, и снижению активности положительных регуляторов роста: CDK2, CDK4, cyclin D1 и cyclin D2. В настоящее время исследуется множество молекул из класса гидроксаматов: e CBHA, LAQ-824, PXD-101, LBH-589, ITF2357, оксамфлатин, ABHA, SBHA, Scriptaid, пироксамид, SK-7041, SK-7068 и тубацин ( Falkenberg et al., 2014 ).
В последнее время ставится под сомнения активность пан-HDACi в отношении HDAC класса IIa, но в результате более подробных исследований открываются «истинные» пан-HDACi, например пандакостат ( Bradner et al., 2010 ). Дальнейшие перспективы пан-HDACi осложняются тем, что они малоэффективны в отношении солидных опухолей, но причины этого остаются неизвестными. В настоящее время значительное внимание уделяется разработке HDACi, селективных к определенным изоформам HDAC. Тем не менее, поиски новых пан-HDACi продолжаются. Свидетельством тому являются и действия фармкомпаний: так, в сентябре 2014 года компании Servier и Pharmacyclists заключили соглашение о совместной разработке абексиностата и других соединений. Появляются пан-HDACi «нового поколения», такие, как гивиностат ( Tashima et al., 2014, Zappasodi et al., 2014, Li X et al., 2015, Mahal K et al., 2015 ), продолжаются и клинические испытания «старых» HDACi, таких, как панабиностат в составе моно- и комбинированной терапии, в том числе и солидных опухолей ( Li X et al., 2015 ).
См. также
Примечания
Литература
1. de Ruijter AJ, van Gennip AH, Caron HN, Kemp S, van Kuilenburg AB (March 2003). «Histone deacetylases (HDACs): characterization of the classical HDAC family». Biochem. J. 370 (Pt 3): 737-49. doi:10.1042/BJ20021321. . 2. Hollender C and Zhongchi Liu Z (July 2008). «Histone Deacetylase Genes in Arabidopsis Development» Journal of Integrative Plant Biology Volume 50, Issue 7, Pages 875—885
- 2021-02-01
- 1