Interested Article - Реакция Принса

- 2021-12-08
- 1
Реакция Принса (реакция Кривица — Принса) — реакция электрофильного присоединения альдегидов (чаще всего - формальдегида ) или кетонов к алкенам с последующим присоединением нуклеофила к образовавшемуся карбокатиону .
Реакция впервые осуществлена Кривицем в 1899г. и детально изучена в 1917 г. Принсом на примере присоединения формальдегида к стиролам с образованием замещенных 1,3,-диоксанов и 1,3-диолов .
В зависимости от условий проведения реакции и соотношения компонентов реакция Принса может вести к образованию различных продуктов (в том числе алкенов , образующихся при дегидратации диолов) и их смесей:
Механизм реакции
Реакция проходит по механизму электрофильного присоединения карбокатиона 3b , образующегося при протонировании карбонильного компонента 2 к алкену 1 , при этом образуется промежуточный карбокатион 4 .
Сам Принс первоначально предполагал, что карбокатион циклизуется через ион 11 с образованием оксетана 12 , который далее вступает в реакции с формальдегидом или с водой, однако это предположение не подтвердилось.
Карбокатион 4 в условиях реакции может:
- Реагировать с избытком карбонильного соединения, образуя 1,3-диоксаны 10 (показагно зеленым);
- Отщеплять протон с образованием аллиловых спиртов 7 (показано черным);
- Присоединять воду с образованием 1,3-диолов 6 (показано синим).
Классическая реакция Принса
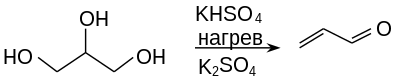
В классическом варианте реакции в качестве карбонильного компонента используется формальдегид 2 и основным продуктом реакции являются 1,3-диолы 3 , реакцйия проводится в ледяной уксускной кислоте при катализе серной кислотой , именно в этом варианте она описана наиболее широко.
Вместе с тем, в зависимости от условий проведения реакции образующиеся 1,3-диолы 3 могут подвергаться дальнейшим превращениям, наиболее частыми из них являются образование с избытком формальдегида циклических ацеталей - 1,3-диоксанов 5 и дегидратация с образованием аллиловых спиртов 4 :
Так, реакция стирола с избытком формальдегида в присутствии серной кислоты ведет к образованию 4-фенил-1,3,-диоксана с выходом ~80%, замещенные стиролы в этих условиях также образуют соответствующие 1,3,-диоксаны 5 с выходами 58-96% .
При проведении реакции в уксусной кислоте образующиеся гликоли или продукты их дегидратации - аллиловые спирты - могут ацилироваться с образованием соответствующих ацетильных производных .
В дальнейшем было показано, что в реакцию вступают, кроме формальдегида, и другие карбонильные соединения с повышенной электрофильностью углерода карбонильной группы - в частности, хлораль и перфторкетоны.
Применение
В промышленности реакция Принса используется для синтеза 1,3-диолов, одним из применений этой реакции является промышленный синтез изопрена , использующегося для синтеза каучуков из изобутилена и формальдегида:
Примечания
- ↑ Prins, H J (1919). (PDF) . Proceedings of Royal Netherlands Academy of Arts and Sciences . 22 (I): 51—56. (PDF) из оригинала 20 октября 2020 . Дата обращения: 19 октября 2020 .
- Shriner, R.L.; Ruby, Philip R. (1953). . Organic Syntheses . 33 : 72. doi : . eISSN . ISSN . из оригинала 19 октября 2020 . Дата обращения: 19 октября 2020 .
-
Price, Charles C.; Benton, F. Lee.; Schmidle, Claude J. (1949–08).
.
Journal of the American Chemical Society
.
71
(8): 2860—2862.
doi
:
.
eISSN
.
ISSN
.
из оригинала
20 октября 2020
. Дата обращения:
19 октября 2020
.
{{ cite journal }}: Википедия:Обслуживание CS1 (формат даты) ( ссылка )
- 2021-12-08
- 1