Interested Article - Щелочная фосфатаза

- 2021-03-01
- 2
| Щелочная фосфатаза | |
|---|---|
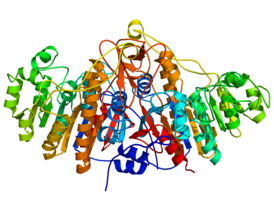
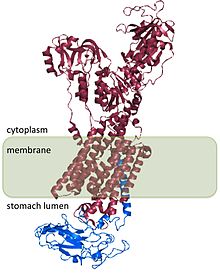
![Структура щелочной фосфатазы[1].](/images/008/286/8286956/3.jpg?rand=843030)
Структура щелочной фосфатазы . |
|
| Идентификаторы | |
| Символ | Alk_phosphatase |
| Pfam | |
| SMART | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
Щелочна́я фосфата́за ( англ. Alkaline phosphatase, ALP, ALKP ) — фермент гидролаза ( КФ ), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов , белков и алкалоидов . Представляет собой гомодимерный белковый фермент массой 86 килодальтон. Каждый мономер содержит пять остатков цистеина, два атома цинка и один атом магния, имеющих решающее значение для его каталитической функции . Фермент проявляет наибольшую активность в щелочной среде .
Фермент катализирует следующую реакцию:
- моноэфир фосфата + H 2 O = спирт + фосфат
Щелочные фосфатазы выполняют роль дефосфорилирующих соединений. Фермент встречается во множестве организмов, как прокариот , так и эукариот , с одной и той же общей функцией, но в различных структурных формах, подходящих для окружающей среды, в которой они функционируют. Щелочная фосфатаза обнаруживается в периплазматическом пространстве бактерий E. coli . Этот фермент термостабилен и обладает максимальной активностью при высоком рН. У человека он встречается во многих формах в зависимости от его происхождения в организме — он играет важную роль в обмене веществ в печени и развитии скелета. Из-за его широкого распространения в этих областях его концентрация в кровотоке используется диагностами в качестве биомаркера для определения таких диагнозов, как гепатит или остеомаляция .
Уровень щелочной фосфатазы в крови проверяется с помощью ЩФ-теста, который часто входит в состав рутинных анализов крови. Уровень этого фермента в крови зависит от таких факторов, как возраст, пол или группа крови . Уровень щелочной фосфатазы в крови также увеличивается в два-четыре раза во время беременности. Это происходит в результате дополнительной щелочной фосфатазы, вырабатываемой плацентой. Кроме того, аномальные уровни щелочной фосфатазы в крови могут указывать на проблемы, связанные с печенью, желчным пузырем или костями. Опухоли почек и инфекции, а также недоедание также показали аномальный уровень щелочной фосфатазы в крови .
Структура
Щелочная фосфатаза — это гомодимерный фермент, то есть она образуется из двух молекул. Три иона металлов, два Zn и один Mg, содержатся в каталитических центрах , и оба типа имеют решающее значение для ферментативной активности. Ферменты катализируют гидролиз моноэфиров в фосфорной кислоте , которая дополнительно может катализировать реакцию трансфосфорилирования с большими концентрациями фосфатных акцепторов.
Щелочная фосфатаза имеет гомологию в большом количестве других ферментов и составляет часть суперсемейства ферментов с несколькими перекрывающимися каталитическими аспектами и субстратными признаками. Исследования показали связь между представителями семейства щелочных фосфатаз и арилсульфатазами. Сходство в структуре указывает на то, что эти два семейства ферментов произошли от общего предка. Дальнейший анализ позволил связать щелочные фосфаты и арилсульфатазы с более крупным суперсемейством . Некоторые из общих генов, обнаруженных в этом суперсемействе, кодируют фосфодиэстеразы , а также аутотоксин .
Бактерии
У грамотрицательных бактерий, таких как Escherichia coli , щелочная фосфатаза расположена в периплазматическом пространстве, снаружи внутренней клеточной мембраны и внутри пептидогликановой части клеточной стенки. Поскольку периплазматический промежуток более подвержен изменениям окружающей среды, чем внутренняя клетка, щелочная фосфатаза соответственно устойчива к инактивации, денатурации или деградации. Эта характеристика фермента необычна для многих других белков .
Точная структура и функция изофермента в E. coli предназначены исключительно для обеспечения источника неорганического фосфата, когда в окружающей среде не хватает этого метаболита. Затем неорганические фосфаты связываются с белками-носителями, которые доставляют неорганические фосфаты в специфическую высокоаффинную транспортную систему, известную как фосфат-специфическая транспортная система (Pst system), которая транспортирует фосфат через цитоплазматическую мембрану .
Внутригенная комплементация
Когда множественные копии полипептида, кодируемого геном, образуют агрегат, эта белковая структура называется мультимером. Когда мультимер образуется из полипептидов, продуцируемых двумя разными мутантными аллелями определённого гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае это явление называется внутригенной комплементацией. Щелочная фосфатаза E. coli , димерный фермент, проявляет внутригенную комплементацию . При объединении определённых мутантных версий щелочной фосфатазы образующиеся в результате гетеродимерные ферменты проявляли более высокий уровень активности, чем можно было бы ожидать, исходя из относительной активности исходных ферментов. Эти результаты показали, что димерная структура щелочной фосфатазы E.coli обеспечивает кооперативные взаимодействия между составляющими мономерами, которые могут генерировать более функциональную форму холофермента.
Свойства
Фермент, выделенный из бактерий Escherichia coli , имеет оптимум рН 8.0 , в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5 .
Применение
Путем изменения аминокислот фермента щелочной фосфатазы дикого типа, продуцируемого Escherichia coli, создается мутантная щелочная фосфатаза, которая не только увеличивает активность фермента в 36 раз, но и сохраняет термостабильность . Типичное применение щелочных фосфатаз в лаборатории включает удаление моноэфиров фосфата для предотвращения самолигирования, что нежелательно при клонировании плазмидной ДНК .
Щелочные фосфатазы, используемые в исследованиях, включают:
- Щелочная фосфатаза креветок (SAP), из вида арктических креветок ( Pandalus borealis ). Эта фосфатаза легко инактивируется нагреванием, что является полезной особенностью в некоторых приложениях.
- (CIP)
- Плацентарная щелочная фосфатаза (PLAP) и её C-терминально укороченная версия, в которой отсутствуют последние 24 аминокислоты (составляющие домен, который нацелен на закрепление мембраны GPI) — секретируемая щелочная фосфатаза (SEAP). Обладает определёнными характеристиками, такими как термостабильность, субстратная специфичность и устойчивость к химической инактивации .
- Щелочная фосфатаза кишечника человека. В организме человека присутствует несколько типов щелочной фосфатазы, которые определяются минимум тремя генными локусами. Каждый из этих трех локусов контролирует различный тип изофермента щелочной фосфатазы. Однако выработка этого фермента может строго регулироваться другими факторами, такими как термостабильность, электрофорез, ингибирование или иммунология .
Щелочная фосфатаза кишечника человека демонстрирует около 80 % гомологии с кишечным ферментом крупного рогатого скота, что подтверждает их общее эволюционное происхождение. Тот же фермент крупного рогатого скота имеет более 70 % гомологии с человеческим плацентарным ферментом. Тем не менее, фермент кишечника человека и фермент плаценты имеют только 20 % гомологии, несмотря на их структурное сходство .
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5'-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе в качестве метки.
Недифференцированные плюрипотентные стволовые клетки имеют повышенный уровень щелочной фосфатазы на своей клеточной мембране, поэтому окрашивание щелочной фосфатазой используется для обнаружения этих клеток и проверки плюрипотентности (то есть эмбриональных стволовых клеток или клеток эмбриональной карциномы) .
Существует положительная корреляция между уровнями щелочной фосфатазы в сыворотке крови и образованием костей у людей, хотя её использование в качестве биомаркера в клинической практике не рекомендуется .
Текущие исследования
Современные исследователи изучают увеличение фактора некроза опухоли-α и его прямое влияние на экспрессию щелочной фосфатазы в гладкомышечных клетках сосудов, а также то, как щелочная фосфатаза (AP) влияет на воспалительные реакции и может играть непосредственную роль в предотвращении повреждения органов .
- Щелочная фосфатаза (AP) влияет на воспалительные реакции у пациентов с хроническим заболеванием почек и напрямую связана с анемией, устойчивой к стимуляторам эритропоэза .
- Кишечная щелочная фосфатаза (IAP) и механизм, который она использует для регулирования рН и гидролиза АТФ в двенадцатиперстной кишке крысы .
- Тестирование эффективности ингибитора и его влияния на IAP при остром воспалении кишечника, а также изучение молекулярных механизмов IAP в «улучшении проницаемости кишечника» .
Молочная промышленность
Щелочная фосфатаза обычно используется в молочной промышленности в качестве индикатора успешной пастеризации. Это связано с тем, что наиболее термостойкая бактерия, обнаруженная в молоке, Mycobacterium paratuberculosis , разрушается при температурах ниже, чем те, которые необходимы для денатурации фермента. Поэтому её присутствие идеально подходит для указания на неудачную пастеризацию .
Проверка пастеризации обычно выполняется путем измерения флуоресценции раствора, который становится флуоресцентным при воздействии активной щелочной фосфатазы. Производители молока в Великобритании требуют проведения флуориметрических анализов, чтобы доказать, что щелочная фосфатаза была денатурирована , поскольку тесты на п-нитрофенилфосфат не считаются достаточно точными, чтобы соответствовать санитарным стандартам.
В качестве альтернативы можно использовать изменение цвета п -нитрофенилфосфата в качестве субстрата в буферном растворе (тест Ашаффенбурга-Маллена) . Сырое молоко обычно приобретает жёлтую окраску в течение нескольких минут, в то время как правильно пастеризованное молоко не должно иметь никаких изменений. Из этого правила есть исключения, как в случае термостабильных щелочных фосфатаз, продуцируемых некоторыми бактериями, но эти бактерии не должны присутствовать в молоке.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином , и, аналогичным образом, все, кроме кишечных и плацентарных, блокируются левамизолом . Фосфат является другим ингибитором, который конкурентно ингибирует щелочную фосфатазу .
Другим известным примером ингибитора щелочной фосфатазы является [(4-Нитрофенил)метил]фосфоновая кислота .
В почве, загрязненной металлами, щелочная фосфатаза ингибируется Cd (кадмием). Кроме того, температура усиливает ингибирование Cd активности фермента, что проявляется в увеличении значений K m .
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Человек
Физиология
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте. В сыворотке крови преобладают два типа изозимов щелочной фосфатазы: скелетный и печеночный. В детском возрасте большинство щелочных фосфатаз имеют скелетное происхождение .
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная (молекулярная масса 150 КДА)
- ALPL — ткань-неспецифическая (выражены преимущественно в печени, костях и почках)
- ALPP — плацентарная (изофермент Регана)
- — зародышевых клеток
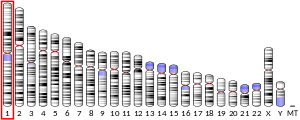
Четыре гена кодируют четыре изофермента. Ген ткань-неспецифической щелочной фосфатазы расположен на хромосоме 1, а гены трех других изоформ — на хромосоме 2 .
Кишечная щелочная фосфатаза (IAP)
Кишечная щелочная фосфатаза секретируется энтероцитами и, по-видимому, играет ключевую роль в гомеостазе и защите кишечника , а также в подавлении воспаления посредством подавления последующего Toll-подобного рецептора (TLR)-4-зависимого и MyD88-зависимого воспалительного каскада . Она дефосфорилирует токсичные / воспалительные микробные лиганды, такие как липополисахариды (LPS) , неметилированные цитозин-гуаниновые динуклеотиды, флагеллин и внеклеточные нуклеотиды, такие как уридиндифосфат или АТФ. Дефосфорилирование ЛПС с помощью IAP может уменьшить тяжесть инфекции Salmonella tryphimurium и Clostridioides difficile и восстанавливает нормальную микробиоту кишечника . Таким образом, изменённая экспрессия IAP была вовлечена в хронические воспалительные заболевания, такие как воспалительное заболевание кишечника (ВЗК) . По-видимому, она также регулирует всасывание липидов и секрецию бикарбоната в слизистой оболочке двенадцатиперстной кишки, что регулирует поверхностный рН.
Диагностика
Нормальный уровень щелочной фосфатазы от 44 до 147 МЕ/л . Концентрации у детей и беременных женщин значительно выше. Уровень щелочной фосфатазы повышается при закупорке желчного протока . Также повышение наблюдается при синдроме Мабри , редком заболевании. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы .
См. также
Примечания
- ↑ PDB : Kim E. E., Wyckoff H. W. Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis (англ.) // : journal. — 1991. — March ( vol. 218 , no. 2 ). — P. 449—464 . — doi : . — .
- ↑ José Luis Millán. (англ.) // Purinergic Signalling. — 2006-06. — Vol. 2 , iss. 2 . — P. 335–341 . — ISSN . — doi : .
- Tamás L., Huttová J., Mistrk I., Kogan G. (англ.) // Chem. Pap. : journal. — 2002. — Vol. 56 , no. 5 . — P. 326—329 . 25 июля 2011 года.
- (англ.) . Healthline (10 августа 2018). Дата обращения: 23 декабря 2020. 25 ноября 2020 года.
-
Dhruv, Lowe; Savio, John (22 October 2017).
. StatPearls.
из оригинала
22 октября 2021
. Дата обращения:
14 августа 2021
.
{{ cite journal }}: Cite journal требует|journal=( справка ) - (англ.) . Healthline (10 августа 2018). Дата обращения: 14 августа 2021. 25 ноября 2020 года.
- M. J. Schlesinger, K. Barrett. // The Journal of Biological Chemistry. — 1965-11. — Т. 240 , вып. 11 . — С. 4284–4292 . — ISSN . 21 сентября 2022 года.
- Alexander J. Ninfa. . — 2nd ed. — Hoboken, NJ: John Wiley, 2010. — xix, 458 pages с. — ISBN 978-0-470-08766-4 , 0-470-08766-8. 13 апреля 2020 года.
- M. J. Hehir, J. E. Murphy, E. R. Kantrowitz. // Journal of Molecular Biology. — 2000-12-08. — Т. 304 , вып. 4 . — С. 645–656 . — ISSN . — doi : . 22 сентября 2022 года.
- Garen A., Levinthal C. A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli . I. Purification and characterization of alkaline phosphatase (англ.) // : journal. — 1960. — March ( vol. 38 ). — P. 470—483 . — doi : . — .
- Harada M., Udagawa N., Fukasawa K., Hiraoka B. Y., Mogi M. (англ.) // : journal. — 1986. — February ( vol. 65 , no. 2 ). — P. 125—127 . — .
- W. Mandecki, M. A. Shallcross, J. Sowadski, S. Tomazic-Allen. // Protein Engineering. — 1991-10. — Т. 4 , вып. 7 . — С. 801–804 . — ISSN . — doi : . 22 сентября 2022 года.
- A. M. Maxam, W. Gilbert. // Methods in Enzymology. — 1980. — Т. 65 , вып. 1 . — С. 499–560 . — ISSN . — doi : . 22 сентября 2022 года.
- D. J. Birkett, J. Done, F. C. Neale, S. Posen. // British Medical Journal. — 1966-05-14. — Т. 1 , вып. 5497 . — С. 1210–1212 . — ISSN . — doi : . 22 сентября 2022 года.
- F. J. Benham, H. Harris. // Proceedings of the National Academy of Sciences of the United States of America. — 1979-08. — Т. 76 , вып. 8 . — С. 4016–4019 . — ISSN . — doi : . 22 сентября 2022 года.
- J. C. Hua, J. Berger, Y. C. Pan, J. D. Hulmes, S. Udenfriend. // Proceedings of the National Academy of Sciences of the United States of America. — 1986-04. — Т. 83 , вып. 8 . — С. 2368–2372 . — ISSN . — doi : . 22 сентября 2022 года.
- . Stem Cell Information . National Institutes of Health, U.S. Department of Health and Human Services. Дата обращения: 24 сентября 2013. Архивировано из 21 сентября 2015 года.
- P. Szulc, E. Seeman, P. D. Delmas. // Osteoporosis international: a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. — 2000. — Т. 11 , вып. 4 . — С. 281–294 . — ISSN . — doi : . 22 сентября 2022 года.
- . Renal and Urology News (16 апреля 2010). Дата обращения: 19 сентября 2022. 27 декабря 2018 года.
- Sunil V. Badve, Lei Zhang, Jeff S. Coombes, Elaine M. Pascoe, Alan Cass. // Canadian Journal of Kidney Health and Disease. — 2015. — Т. 2 . — С. 33 . — ISSN . — doi : . 22 сентября 2022 года.
- Misa Mizumori, Maggie Ham, Paul H. Guth, Eli Engel, Jonathan D. Kaunitz. // The Journal of Physiology. — 2009-07-15. — Т. 587 , вып. Pt 14 . — С. 3651–3663 . — ISSN . — doi : . 22 сентября 2022 года.
- Wei Wang, Shan-Wen Chen, Jing Zhu, Shuai Zuo, Yuan-Yuan Ma. // PloS One. — 2015. — Т. 10 , вып. 5 . — С. e0124835 . — ISSN . — doi : . 22 сентября 2022 года.
- H Kay. (англ.) // The Lancet. — 1935-06. — Vol. 225 , iss. 5835 . — P. 1516–1518 . — doi : . 8 марта 2021 года.
- W.A. Hoy, F.K. Neave. (англ.) // The Lancet. — 1937-09. — Vol. 230 , iss. 5949 . — P. 595–598 . — doi : . 8 марта 2021 года.
- . British Standards Institution (BSI). Дата обращения: 23 августа 2016. 23 апреля 2021 года.
- R. Aschaffenburg, J. E. C. Mullen. (англ.) // Journal of Dairy Research. — 1949-01. — Vol. 16 , iss. 1 . — P. 58–67 . — ISSN . — doi : .
- Ujjawal Sharma, Deeksha Pal, Rajendra Prasad. (англ.) // Indian Journal of Clinical Biochemistry. — 2014-07. — Vol. 29 , iss. 3 . — P. 269–278 . — ISSN . — doi : .
- Jamshed Iqbal. (англ.) // Analytical Biochemistry. — 2011-07. — Vol. 414 , iss. 2 . — P. 226–231 . — doi : . 9 августа 2022 года.
- Ganellin CR, Triggle DJ, eds. (1999). Dictionary of pharmacological agents (1st ed.). London: Chapman & Hall. ISBN 978-0-412-46630-4 .
- Xiangping Tan, Megan B. Machmuller, Ziquan Wang, Xudong Li, Wenxiang He. // Chemosphere. — 2018-04. — Т. 196 . — С. 214–222 . — ISSN . — doi : . 22 сентября 2022 года.
- I. Reiss, D. Inderrieden, K. Kruse. (нем.) // Monatsschrift Kinderheilkunde. — 1996-01. — Bd. 144 , H. 9 . — S. 885–890 . — ISSN . — doi : .
- Sayeda Nasrin Alam, Halim Yammine, Omeed Moaven, Rizwan Ahmed, Angela K. Moss. // Annals of Surgery. — 2014-04. — Т. 259 , вып. 4 . — С. 715–722 . — ISSN . — doi : . 21 сентября 2022 года.
- Jean-Paul Lallès. // Nutrition Reviews. — 2014-02. — Т. 72 , вып. 2 . — С. 82–94 . — ISSN . — doi : . 19 сентября 2022 года.
- Siddhartha S. Ghosh, Todd W. B. Gehr, Shobha Ghosh. // Molecules (Basel, Switzerland). — 2014-12-02. — Т. 19 , вып. 12 . — С. 20139–20156 . — ISSN . — doi : . 22 сентября 2022 года.
- Shipra Vaishnava, Lora V. Hooper. // Cell Host & Microbe. — 2007-12-13. — Т. 2 , вып. 6 . — С. 365–367 . — ISSN . — doi : . 22 сентября 2022 года.
- ↑ Jan Bilski, Agnieszka Mazur-Bialy, Dagmara Wojcik, Janina Zahradnik-Bilska, Bartosz Brzozowski. // Mediators of Inflammation. — 2017. — Т. 2017 . — С. 9074601 . — ISSN . — doi : . 22 сентября 2022 года.
- dx.doi.org . Дата обращения: 19 сентября 2022. 12 октября 2019 года.
- Sonoko Narisawa, Lei Huang, Arata Iwasaki, Hideaki Hasegawa, David H. Alpers. // Molecular and Cellular Biology. — 2003-11. — Т. 23 , вып. 21 . — С. 7525–7530 . — ISSN . — doi : . 22 сентября 2022 года.
- Yasutada Akiba, Misa Mizumori, Paul H. Guth, Eli Engel, Jonathan D. Kaunitz. // American Journal of Physiology. Gastrointestinal and Liver Physiology. — 2007-12. — Т. 293 , вып. 6 . — С. G1223–1233 . — ISSN . — doi : . 18 сентября 2022 года.
- . Архивировано из 16 июня 2010 года.
- . Дата обращения: 23 июня 2010. Архивировано из 3 июля 2011 года.
- Schiele F., Vincent-Viry M., Fournier B., Starck M., Siest G. Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables (англ.) // : journal. — 1998. — November ( vol. 36 , no. 11 ). — P. 871—878 . — doi : . — .
- Coleman J. E. (англ.) // Annu Rev Biophys Biomol Struct : journal. — 1992. — Vol. 21 . — P. 441—483 . — doi : . — .
- 2021-03-01
- 2