Вирусы
- 1 year ago
- 0
- 0

Ви́рус гепати́та де́льта , или ви́рус гепати́та D ( лат. Deltavirus italiense), — инфекционный агент, вызывающий гепатит D у человека. Строго говоря, этот небольшой РНК -содержащий инфекционный агент является вирусом-сателлитом , поскольку для его размножения в клетках и развития инфекции необходимо, чтобы клетки были заражены вирусом гепатита В (HBV). HDV использует оболочечные белки вируса гепатита В ( ) для упаковки своего генома .
Вирус гепатита дельта изначально был описан у пациентов с более тяжёлой формой инфекции, вызываемой вирусом гепатита B. Заражение гепатитом D может как происходить вместе с заражением гепатитом B ( коинфекция ), так и накладываться на хронический гепатит B ( суперинфекция ). В обоих случаях у пациентов проявляются более тяжёлые симптомы по сравнению с одним только гепатитом В. Среди них намного выше вероятность развития терминальной стадии печёночной недостаточности в результате острой инфекции, быстрого развития цирроза печени , а в случае хронических инфекций — увеличенная вероятность гепатоцеллюлярной карциномы .
Вирус гепатита дельта уникален среди патогенов человека и животных тем, что он имеет ряд общих свойств как с вироидами растений , так и с вироид-подобными сателлитными РНК растений. Этот патоген, передающийся с кровью, размножается в печени и может вызывать острый гепатит как у приматов , так и млекопитающих из числа не-приматов (хотя естественным хозяином вируса является только человек). По всему миру вирусом гепатита дельта заражено более 15 миллионов человек, что делает его важной проблемой современного здравоохранения .
Первые сообщения о вирусе гепатита дельта появились в середине 1977 года. Его открыл с коллегами, которые изучали группу пациентов, инфицированных вирусом гепатита B и страдавших от особо острой формы гепатита. Он был описан как новый ядерный антиген вируса гепатита B и назван антигеном дельта (δ, HDAg) . Последующие эксперименты на шимпанзе показали, что дельта-антиген на самом деле является структурным элементом патогена, для репликации которого был необходим вирус гепатита B. До 1980 года вирус гепатита дельта не считали инфекционным агентом. Однако вскоре после признания вируса гепатита дельта патогеном были разработаны эффективные тесты на него. Помимо этого, был открыт сбор эпидемиологической информации по гепатиту D (он начался с южной Италии ) . Геном вируса гепатита дельта был клонирован и секвенирован в 1986 году . В 1993 году вирус был зарегистрирован Международным комитетом по таксономии вирусов и помещён в монотипный род Deltavirus .

Естественным хозяином HDV является только человек. Данные филогенетических исследований говорят об африканском происхождении вируса гепатита дельта . HDV характеризуется высокой степенью генетической гетерогенности. Считается, что эволюцию HDV обеспечивают 3 основных механизма: мутации , редактирование и рекомбинация . Скорость мутирования составляет, по разным оценкам, от 3⋅10 -2 до 3⋅10 -3 замен на геном в год. Она зависит от фазы инфекции (наиболее высока в острой фазе), участка генома (высока в неконсервативных участках и низка в консервативных, например, в области рибозима ) и возрастает от терапевтического давления. Скорость мутирования HDV выше, чем у большинства РНК-содержащих вирусов . В связи с такой скоростью мутирования предполагается, что HDV циркулирует в пределах одного заражённого организма-хозяина как ряд квазивидов . Установлено, что до 70 % замен может быть обусловлено редактированием. Впервые рекомбинация у HDV была описана в 1999; тогда был сделан вывод, что она происходит в случае заражения вирусами различных генотипов. Рекомбинация происходит по пути гомологичной рекомбинации . Предполагается, что в рекомбинации у HDV принимает участие РНК-полимераза клетки-хозяина .
Первоначально было описано 3 генотипа этого вируса (I—III). Генотип I был выделен в Европе , Северной Америке , Африке и некоторых регионах Азии . Генотип II встречается в Японии , на Тайване , а также в Якутии . Генотип III известен исключительно в Южной Америке ( Перу , Колумбия и Венесуэла ). Сейчас известно, что существует по меньшей мере 8 генотипов вируса гепатита дельта (HDV-1 — HDV-8). Все они, за исключением HDV-1, приурочены к строго определённым географическим регионам. HDV-2 (ранее известный как HDV-IIa) найден в Японии, на Тайване и в Якутии; HDV-4 (HDV-IIb) — в Японии и на Тайване; HDV-3 — в районе Амазонки; HDV-5, HDV-6, HDV-7 и HDV-8 — в Африке .
В настоящее время распространены две основные теории относительно происхождения вируса гепатита дельта. Согласно им, HDV произошёл от вироидов растений и/или в результате сплайсинга клетки-хозяина . РНК HDV по особенностям структуры и репликации имеет общие черты с каждым из двух семейств вироидов , известных на данный момент ( Pospiviroidae и Avsunviroidae ). С Pospiviroidae этот вирус объединяет палочковидная структура РНК и репликация в ядре , а с Avsunviroidae — наличие рибозима и симметричная репликация по типу катящегося кольца . Более того, РНК HDV и вироидов растений взаимодействуют с гомологичными клеточными белками , а экспериментальные данные 2012 года (правда, не до конца подтверждённые) показывают, что HDV может реплицироваться и размножаться после внедрения в листья проростков томата , что служит ещё одним подтверждением близости HDV и вироидов. Однако эта гипотеза не даёт ответа на вопрос о происхождении дельта-антигена и связи HDV с HBV .
Вторая теория, которая может дополнять первую, заключается в том, что HDV мог возникнуть из транскриптома клетки-хозяина. Эта точка зрения подтверждается исследованиями, показавшими, что в клетках человека имеется рибозим (в интроне гена CPEB3), по вторичной структуре и биохимическим свойствам схожий с . Впрочем, рибозимы, имеющие структурный элемент псевдоузел , были позднее найдены во всех царствах живых организмов , за исключением архей , а также в вирусах насекомых . Для дельта-антигена также предполагается возникновение из клетки-хозяина. Первоначально возможным белком-предком дельта-антигена считали белок DIPA ( англ. delta interacting protein A). Хотя впоследствии оказалось, что эти белки не гомологичны, DIPA может взаимодействовать с HDAg .
Интегрированная модель предполагает, что HDV мог возникнуть после рекомбинации между вироид-подобным элементом и клеточной пре-мРНК/мРНК .
Вирус гепатита дельта представляет собой частицу диаметром 35—37 нм , покрытую поверхностными антигенами вируса гепатита В (HBsAg), имеющую плотность 1,25 г/см³ в градиенте хлорида цезия и характеризующуюся значением коэффициента седиментации , средним между пустыми частицами вируса гепатита B (HBV), состоящими только из HBsAg, и вирионом HBV. Вирион HDV состоит из трёх ключевых компонентов: геномной РНК, связанной с молекулами дельта-антигена (нуклеокапсид), и наружным капсидом , состоящим из . Оболочка HDV содержит липиды и состоит из гликопротеинов HBV трёх видов: малых, или S-HBsAg, средних, или M-HBsAg, и крупных, или L-HBsAg (около 100 копий). У обоих вирусов эти белки служат для проникновения в гепатоциты и выхода из них . Кроме полноценных вирусных частиц, заражённые HDV клетки образуют в большом избытке пустые субвирусные частицы (SVP), которые представлены сферами диаметром 25 нм и филаментами диаметром 22 нм .
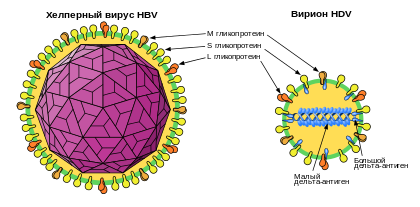
Все три формы HBsAg имеют общий C-конец . Около 50 % HBsAg каждого вида подвергаются сайт-специфическому . Кроме S- домена , M-HBsAg содержит N-концевой гидрофильный домен PreS2, а L-HBsAg, кроме PreS2, имеет ещё и домен PreS1. L-HBsAg необходим, хотя и недостаточен, для сборки частиц и HBV, а S-HBsAg необходим для высвобождения частиц из клетки. M-антиген не является необходимым ни для сборки, ни для инфективности . В отличие от HBV, сборка HDV нуждается только лишь в S-HBsAg, однако без L-HBsAg частицы лишены инфективности. Эти различия в необходимых белках объясняются различными доменами связывания с нуклеокапсидом HBV и рибонуклеопротеином HDV на цитозольных петлях белков оболочки. Согласно последним данным, сборка (и инфективность) HDV генотипа HDV-1 не приурочена только к одному генотипу HBV. Она может происходить также в присутствии белков оболочки гепаднавирусов сурка , летучей мыши и шерстистых обезьян .
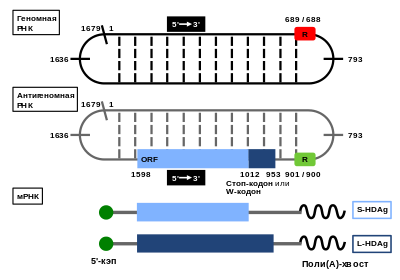
Вирион HDV содержит кольцевой геном , представленный РНК , причём вторичная структура этой РНК содержит двуцепочечные участки . При размножении вируса в инфицированной клетке можно обнаружить две другие главные вирусные РНК: молекулу, комплементарную геномной (антигеномная РНК, или антигено́м), и мРНК HDV. Размер генома HDV составляет всего лишь 1672—1697 нуклеотидов , что делает его мельчайшим из всех известных вирусов млекопитающих и сближает с вироидами растений. Он имеет высокий GC-состав (60 %), а процент внутримолекулярного спаривания оснований достигает 74 %, что позволяет ему сворачиваться в палочковидную структуру. Такие структуры в условиях in vitro устойчивы к разрезанию ферментом Dicer . Заражённая клетка может содержать около 300 000 молекул генома HDV, которые распределены между ядром и цитоплазмой , что свидетельствует о высоких темпах репликации. Антигеномная РНК HDV представляет собой промежуточное соединение в цикле репликации, комплементарна геномной РНК (и, следовательно, имеет положительную полярность) и содержит последовательность, кодирующую HDAg. Её количество в 5—22 раза меньше, чем геномной РНК, она встречается исключительно в ядре и потому не упаковывается в вирионы. Белки HDV транслируются со специфической мРНК длиной 800 нуклеотидов, которая транскрибируется ДНК -зависимой РНК-полимеразой II клетки-хозяина и проходит те же этапы созревания (в том числе кэпирование и полиаденилирование ), что и клеточные мРНК .
В геномной и антигеномной РНК HDV были найдены небольшие саморазрезающиеся последовательности длиной около 85 нуклеотидов. Эти рибозимы , последовательности которых демонстрируют высокую консервативность среди генотипов HDV, отвечают за разрезание мультимерных молекул РНК, образующихся при репликации. Рибозим HDV имеет уникальные структурные и функциональные характеристики, отличающие его от рибозимов вироидов. Было получено несколько кристаллических структур этих рибозимов, и благодаря им удалось описать механизм разрезания, основанный на псевдоузлах. В условиях in vitro в присутствии ионов двухвалетных металлов рибозим HDV разрезается по специфическому сайту в результате реакции переэтерификации с образованием 5'-OH и 2'-, 3'-циклического монофосфата . Как отмечалось выше, в геномах клеток-хозяев имеются рибозимы, близко напоминающие рибозим HDV .

Часть антигеномных РНК вируса гепатита дельта редактируется в ходе репликации — специфический остаток аденозина (в положении 1014) дезаминируется в инозин . Этот процесс осуществляется клеточным ферментом (ADAR1), действующей на РНК. В ходе последующей репликации модифицированный остаток формирует уотсон-криковскую пару с цитозином , а не с уридином , из-за чего исходный аденозин в положении 1014 заменяется на гуанозин . Специфичность редактирования, вероятнее всего, определяется первичной и вторичной структурами РНК вируса гепатита дельта .
ADAR1 имеет две изоформы — малую (ADAR1-S) и большую (ADAR1-L), которые имеют одинаковый C-конец. Более широко представлена ADAR1-S, она экспрессируется постоянно и локализована в ядре, в то время как ADAR1-L встречается в основном в цитоплазме и её экспрессия стимулируется интерфероном . Было установлено, что ADAR1-L очень эффективна в редактировании транскриптов в цитоплазме, однако позднее было показано, что редактирование РНК HDV происходит в ядре, а не в цитоплазме, и опосредуется ADAR1-S, которая там локализуется. Впрочем, исследования 2004 и 2006 годов показали, что усиленное редактирование РНК HDV после обработки интерфероном может быть связано с ADAR1-L, а не ADAR1-S .
В результате редактирования стоп-кодон UAG, который в норме завершает открытую рамку считывания, останавливая синтез белка на 195-м аминокислотном остатке, заменяется на кодон UGG, который кодирует триптофан . Редактированные антигеномные РНК в ходе репликации дают начало геномным РНК; эти геномные РНК транскрибируются РНК-полимеразой II в модифицированные мРНК. До 30 % мРНК вируса гепатита дельта несут изменённый стоп-кодон. С этих мРНК синтезируется более длинный пептид длиной 214 аминокислотных остатков. Таким образом, вирус гепатита дельта имеет две формы антигена: малую, длиной 195 аминокислотных остатков и массой 24 кДа , и большую, состоящую из 214 аминокислот и имеющую массу 27 кДа . N-концы двух форм одинаковы, различия заключаются в 19 аминокислотных остатках на С-конце . У обеих форм на N-конце имеется мотив , необходимый для димеризации . Димеры дельта-антигены имеют обогащённый аргинином мотив, который позволяет ему связываться с вирусными РНК. Однако на удлинённом C-конце L-HDAg имеется четыре уникальных остатка цистеина , которые являются мишенью для фарнезилирования . После этой посттрансляционной модификации L-HDAg может взаимодействовать с поверхностными белками HBV и тем самым способствовать сборке новых вирусных частиц .
И малая, и большая формы дельта-антигена содержат сигнал ядерной локализации и участки связывания РНК. Некоторые взаимодействия дельта-антигена обеспечиваются мотивом биспираль на N-конце . Несмотря на 90-процентное сходство в последовательностях аминокислот, эти две формы играют разные роли в развитии вирусной инфекции. Малый дельта-антиген необходим для репликации вирусной РНК и функционирует на ранних этапах инфекции, а большой дельта-антиген необходим для упаковки вирусного генома, кроме того, он функционирует как ингибитор репликации вирусной РНК. Поскольку две формы дельта-антигена экспрессируются на разных этапах вирусной инфекции, редактирование РНК нуждается в жёсткой регуляции. Механизмы осуществления этой регуляции в настоящий момент изучены слабо .
Геномная РНК HDV связывается с HDAg и образует рибонуклеопротеин, который присутствует как в вирусных частицах, так и в заражённых клетках. Этот рибонуклеопротеин необходим не только для сборки вириона, но также для перемещения РНК HDV между ядром и цитоплазмой. Структура и стехиометрия этого рибонуклеопротеина являются предметом споров. Пионерские исследования показали, что в вирионе геномная молекула связана с 70 молекулами HDAg, в то время как в ядре заражённых клеток и геномная, и антигеномная РНК образуют рибонуклеопротеины с 30 молекулами HDAg. Дальнейшие исследования показали, что и в вирионах, и в заражённых клетках на одну молекулу генома приходится 200 молекул HDAg. Однако эти значения были поставлены под вопрос последними исследованиями, в ходе которых было установлено, что молекулы дельта-антигена олигомеризуются при связывании с РНК; это особенно важно учитывать при малом количестве молекул антигена на РНК. Кроме того, специфичность связывания HDAg к геному, по-видимому, определяется его вторичной структурой, а не первичной .
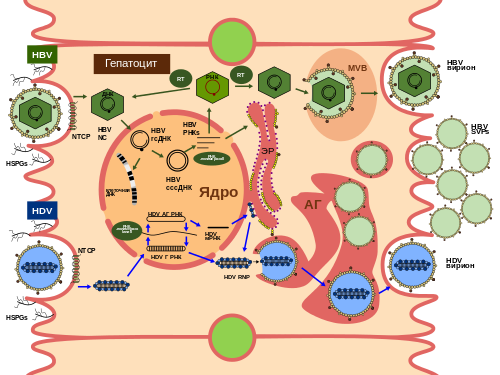
Гематотропизм HDV и его способность к размножению внутри гепатоцитов связаны с коинфекцией последних HBV. В то время как для сборки вирионов HDV необходима экспрессия поверхностных гликопротеинов HBV в той же клетке, другие аспекты репликации обоих вирусов совершенно не зависят друг от друга. В отличие от HBV, который нуждается в специфичных для печени факторах транскрипции , репликация HDV может происходить в клетках млекопитающих самых разных типов, если геном вируса будет предварительно доставлен в эти клетки. Поскольку структура оболочки HBV и HDV очень похожа, то можно предположить, что и механизмы прикрепления к клетке-мишени и проникновения в неё будут общими у этих вирусов. В самом деле, большая часть имеющейся на данный момент информации о механизмах проникновения HBV в клетку получена из моделей инфекции HDV .
Для инфективности обоих вирусов необходим L-HBsAg. Специфические мутации в 75 N-концевых аминокислотных остатках домена Pre-S1 или ингибирование могут лишить вирус инфективности. В инфективность также вносит вклад антигеновый петлевой домен S-HBsAg и его паттерн гликозилирования , поскольку мутации в этом домене могут подавить развитие инфекции независимо от домена PreS1 .
Для проникновения в клетку HBV и HDV должны вначале прикрепиться к её поверхности; это осуществляется за счёт клеточных протеогликанов . Прикрепление частиц HDV к клетке увеличивалось более чем в 15 раз после обработки 4—5 % полиэтиленгликолем . Конкретные гепарансульфаты, участвующие в прикреплении HDV и HBV, ещё не идентифицированы, хотя в 2015 году было показано, что наиболее важен для этого процесса . Этап прикрепления к клетке необходим, но не достаточен для развития инфекции; попадание в клетку вирусов, связанных с гепарансульфатами, ещё может быть подавлено. Более того, после прикрепления к клетке дальнейшее проникновение вируса в клетку идёт гораздо менее быстро. Например, после 3-часового взаимодействия первичных человеческих гепатоцитов с HDV более половины вирусных частиц оставалось на поверхности клетки, а потому были чувствительны к действию ингибиторов , блокирующих проникновение в клетку (например, пептида, соответствующего части домена PreS1 на N-конце L-HBsAg) . Было показано, что прикрепление HDV и HBV к клетке блокировалось сурамином , поэтому, возможно, в процесс прикрепления вовлечены .
В 2012 году было установлено, что функциональным рецептором для HBV и HDV является контранспортирующий пептид таурохлората натрия (hNTCP, кодируется геном SLC10A1 ). NTCP располагается в базолатеральной мембране гепатоцитов и участвует во внутрипечёночном перемещении солей жёлчных кислот . Судя по всему, вирусная инфекция поддерживается аминокислотами, участвующими в связывании жёлчных кислот (а не тех, которые участвуют в связывании натрия). Взаимодействие между NTCP и HBV/HDV, по-видимому, опосредовано 75 N-концевыми аминокислотными остатками в PreS1-домене вирусных поверхностных белков и участком связывания на NTCP, расположенном на спирали 5 на внешнем слое клеточной мембраны . Поскольку HDV может реплицироваться в клетках многих типов (не только в человеческих гепатоцитах), если его геном правильно доставлен в клетку, то hNTCP- , как было недавно показано, были способны к заражению HDV .
HBV проникает в клетку путём клатрин -зависимого эндоцитоза и проходит через ранние и поздние эндосомы , причём закисление и протеазная активность на него не действуют. Для HDV доказательств этому нет, хотя было показано, что L-HDAg может выступать при взаимодействии с клатрином. Этапы ядерного транспорта рибонуклеопротеина HDV после проникновения в клетку и лишения генома оболочки изучены не до конца. Перемещение рибонуклеопротеина HDV между цитоплазмой и ядром может происходить при участии HDAg и его взаимодействии с импортинами . Нуклекапсид переносится в ядро благодаря сигналу ядерной локализации , имеющемуся у дельта-антигена .
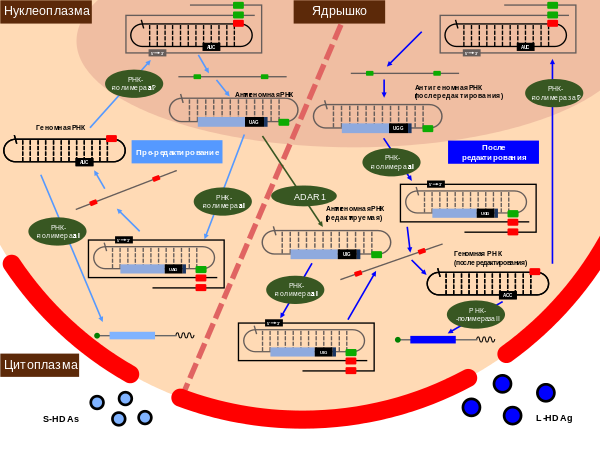
В ходе репликации антигеномная РНК находится исключительно в ядре и синтезируется в ядрышке , в то время как молекулы геномной РНК, синтезирующиеся в нуклеоплазме , могут вступить в другой цикл репликации в ядре или экспортироваться в цитоплазму для сборки новых вирусных частиц .
HDV удваивается путём РНК-зависимой РНК-репликации по механизму двойного катящегося кольца, в котором задействованы клеточные ДНК-зависимые РНК-полимеразы , которые, по-видимому, сменяют свою специфичность (с ДНК на РНК). Механизм двойной репликации по типу катящегося кольца сходен с симметричной репликацией по типу катящегося кольца у вироидов, однако включает стадию синтеза мРНК. Он основан на двух кольцевых РНК-матрицах различной полярности (геном и антигеном) и включает образование мультимерных линейных транскриптов как промежуточных соединений .
Для репликации РНК HDV необходимы три ферментативные активности:
В отличие от некоторых РНК-содержащих вирусов с более крупными геномами, у HDV нет собственной РНК-зависимой РНК-полимеразы. Более того, в отличие от других вирусов-сателлитов, HDV не использует полимеразу хелперного вируса (то есть вируса, только в присутствии которого возможно образование вирионов HDV), а потому целиком полагается на ферменты клетки-хозяина. Имеется ряд доказательств того, что в репликации HDV участвует РНК-полимераза II . Во-первых, мРНК HDV имеют кэп на 5'-конце и поли(А)-хвост на 3'-конце, как и клеточные мРНК; во-вторых, транскрипция РНК HDV подавляется небольшими дозами α-аманитина — ингибитора РНК-полимеразы II; наконец, РНК-полимераза II может связываться как с геномной, так и с антигеномной РНК HDV. Имеются данные, что синтез антигеномной РНК демонстрирует некоторую устойчивость к α-аманитину, поэтому, возможно, в транскрипции участвует и . Показано, что и РНК-полимераза I, и РНК-полимераза III могут взаимодействовать с РНК HDV, а синтез генома и антигенома может происходить в различных зонах ядра .
Одно из различий между транскрипцией и репликацией геномной РНК этого вируса заключается в используемых ферментах. Более того, доказано, что транскрипция и репликация начинаются с разных сайтов, и, следовательно, используют различные РНК-полимеразы. Кроме того, механизм, отвечающий за репликацию генома, не распознаёт сигнал разрезания/полиаденилирования, который необходим для созревания 3'-конца мРНК. Известно, что РНК-полимераза I, которая в клетке транскрибирует гены рРНК , не взаимодействует с клеточными факторами, участвующими в разрезании и полиаденилировании транскриптов РНК-полимеразы II. Это может служить объяснением того факта, что мультимерные антигеномные РНК, получающиеся в результате репликации по типу катящегося кольца с использованием геномной РНК в качестве матрицы, не разрезаются по сигналу полиаденилирования .
Согласно альтернативной интерпретации экспериментальных данных, и для репликации, и для транскрипции используется РНК-полимераза II. Эта модель предполагает, что сигнал полиаденилирования распознаётся клеточными факторами разрезания не во всех случаях, что даёт возможность синтезировать как мультимерные антигеномные матрицы, так и мРНК длиной 800 нуклеотидов, при помощи одной и той же клеточной РНК-полимеразы. Однако эта модель не объясняет нечувствительности синтеза антигеномных матриц к α-аманитину .
Хотя конкретную роль отдельных полимераз в репликации HDV ещё предстоит установить, понятно, что HDV способен заставить работать ДНК-зависимую РНК-полимеразу с РНК. Механизмы такого переключения в значительной мере неясны. Вероятно, в переключении специфичности РНК-полимеразы II участвует S-HDAg. Он может связываться с РНК-полимеразой II и усилять транскрипцию или непосредственно стимулируя элонгацию, или нивелируя ингибиторные воздействия. Более того, он биохимически взаимодействует с 9 из 12 субъединиц РНК-полимеразы II. Возможно, это взаимодействие не ограничено одной лишь РНК-полимеразой II, поскольку S-HDAg взаимодействует и/или колокализуется с белками ядрышка (в том числе нуклеофозмином и нуклеолином ), что может служить дополнительным подтверждением участия РНК-полимеразы I в репликации HDV . Возможно также, что ДНК-зависимый фермент работает с геномной РНК благодаря её частично двуцепочечной палочковидной структуре .
мРНК HDV имеет единственную открытую рамку считывания , кодирующую дельта-антиген . Наличие сайтов инициации транскрипции или промоторов на РНК HDV является предметом споров. Показано, что 5'-концевой участок мРНК HDAg совпадает с одним из концов палочковидной геномной РНК, имеет сложную вторичную структуру и может играть важную роль в репликации HDV .
Геномные и антигеномные молекулы образуются путём разрезания линейных поли- или олигомерных предшественников. Это разрезание осуществляет рибозим, имеющийся как в геноме, так и в антигеноме. Для замыкания мономеров в кольцо (геном или антигеном) необходима лигазная активность. В то время как некоторые исследования продемонстрировали участие в этом лигазы клетки хозяина, так как лигирование РНК HDV происходит только в клетках млекопитающих, в другой работе была показана способность последовательностей рибозима HDV к самолигированию .
Для образования вириона HDV рибонуклеопротеин HDV должен быть покрыт по крайней мере S- и L-HBsAg, поэтому сборка частиц HDV возможна только в клетках, коинфицированных HBV. Относительно сборки частиц HDV и их выхода из клетки существует много вопросов, не имеющих ответа. В отличие от HBV, для высвобождения частиц которого необходим цитоплазматический домен HBsAg, включающий соединительный участок между PreS1 и PreS2, HDV в этом не нуждается. На основании этого было высказано предположение, что HDV использует преимущественно путь высвобождения субвирусных частиц через аппарат Гольджи , а не через мультивезикулярное тельце , как HBV. Возможно, в экспорте вирионов HDV участвует клатрин. Для формирования оболочки вокруг рибонуклеопротеина HDV необходимо фарнезилирование C-концевого участка L-HDAg, поскольку оно управляет взаимодействием с S-участком HBsAg. Фарнезилирование включает прикрепление цепочки из 15 атомов углерода к мотиву C 211 XXQ-бокс, присутствующему на C-конце L-HDAg и консервативному среди всех генотипов HDV .
РНК HDV взаимодействует с различными белковыми факторами клетки-хозяина, чтобы максимально усилить свою инфективность. Взаимодействие может быть прямым или опосредованным через взаимодействие с ними HDAg. HDAg может подвергаться различным посттрансляционным модификациям , среди которых фосфорилирование , , метилирование , и фарнезилирование, что позволяет ему взаимодействовать с различными белками клетки и регулировать инфективность вируса. Интересным примером может служить взаимодействие HDAg с транскрипционным фактором , которое индуцирует сборку комплекса CBP / (двух бромодомен -содержащих белков) и тем самым усиливает репликацию HDV .
На различные этапы жизненного цикла HDV может также влиять непосредственное взаимодействие РНК с белками. (GADPH) — фермент, который в норме участвует в метаболизме глюкозы . Однако его взаимодействие с геномной или антигеномной РНК HDV заставляет этот белок переместиться в ядро и усиливать рибозимную активность вируса. Похоже, что при инфекции HDV GADPH действует как молекулярный шаперон , расплетая вирусную РНК и приводя её в конформацию , содержащую двойной псевдоузел, а потому усиливая саморазрезание .
Другим примером непосредственного взаимодействия РНК HDV с белками клетки может служить взаимодействие все трёх РНК HDV с — киназой , активирующей различные клеточные факторы, в том числе — важный фактор преинициаторного комплекса трансляции, играет важную роль во врождённом иммунитете . Взаимодействие с РНК HDV активирует PKR, хотя этот белок обычно взаимодействует с двуцепочечными, но не одноцепочечными РНК. Возможно, двуцепочечных участков, содержащихся в РНК HDV, достаточно для этого взаимодействия. В таблице ниже перечислены другие клеточные белки (кроме вышеупомянутых РНК-полимераз), с которыми взаимодействует HDV .
| Белок | Функция в здоровой клетке | Предполагаемая функция у HDV |
|---|---|---|
| GADPH | Метаболизм глюкозы | Усиливает активность рибозима HDV |
| PKR | Трансляция | Посттрансляционные модификации |
| PSF | Процессинг пре-МРНК | Привлечение РНК HDV к РНК-полимеразе II |
| p54 nrb | Процессинг пре-МРНК | ? |
| Процессинг пре-МРНК | ? | |
| ASF | Сплайсинг пре-МРНК | ? |
| Трансляция | ? | |
| Стабилизация веретена деления | ? | |
| ANKS6 | ? | ? |
| FBXL-17 | Убиквитиновый комплекс | ? |
У человека HDV вызывает тяжёлое заболевание печени — гепатит D. Симптомы гепатита D такие же, как при гепатите B, однако степень их выраженности гораздо выше. Кроме того, при гепатите D гораздо более высок риск развития цирроза печени . Течение болезни может зависеть от генотипа вируса гепатита дельта: инфекция, вызванная вирусом генотипа 1, характеризуется более тяжёлым течением, чем вызванные вирусами генотипов 2 и 4. Кроме того, белки вируса гепатита дельта могут вызывать изменения протеома клеток печени, которые способствуют их злокачественному перерождению; таким образом, гепатит D может лежать в основе гепатоцеллюлярной карциномы . Кроме того, лечение гепатита D интерфероном часто приводит к расстройствам щитовидной железы .
Показана возможность участия вируса гепатита дельта в развитии аутоиммунных заболеваний печени, таких как синдром Шегрена .
После открытия вируса гепатита дельта для его дальнейшего изучения использовались как модели in vitro , так и in vivo .
Как указано выше, HDV в отличие от HBV может реплицироваться в клетках млекопитающих самых разных типов, если в них доставлен вирусный геном, а не только в гепатоцитах. Большинство исследований репликации вируса проводилось на моделях in vitro трансфекции клеток линии гепатоцеллюлярной карциномы (в том числе Huh7 , HepG2 ). Однако для сборки вирусных частиц необходимы белки HBV, поэтому часто проводят ко-трансфекцию плазмидами , кодирующими поверхностные белки HBV .
До недавнего времени заразить HDV удавалось только лишь дифференцированные первичные человеческие гепатоциты (РНН), гепатоциты шимпанзе или тупайи , а также нетрансформированные клетки линии HepaRG. Однако работа с этими клетками была очень сложна, кроме того, были проблемы с воспроизводимостью экспериментов. Идентификация hNTCP как рецептора HDV изменила ситуацию, так как позволила заражать HDV более удобные для работы клетки .
Хотя естественным хозяином вируса гепатита дельта является человек, некоторые млекопитающие тоже чувствительны к этому вирусу. HDV интенсивно изучался на шимпанзе с использованием HBV в качестве хелперного вируса, а также на сурках (в качестве хелперного вируса использовался гепаднавирус сурков). Кроме того, для изучения HDV использовали малайскую тупайю , чувствительную к HBV, шерстистых обезьян и в более недавнее время летучих мышей. К настоящему моменту разработаны разнообразные мышиные модели для изучения HDV .
Рибозим вируса гепатита дельта используется для создания искусственных регуляторных элементов, модулирующих экспрессию генов. Например, для регуляции экспрессии гена была создана конструкция из аллостерически регулируемого рибозима HDV со встроенным теофиллиновым аптамером , которая вместе с первичной микроРНК может осуществлять сайленсинг гена MAP4K4 в клетках печени на уровне РНК посредством РНК-интерференции .