Interested Article - Тринитрофенол

- 2020-01-22
- 1
2,4,6-Тринитрофенол ( пикриновая кислота ) — химическое соединение с химической формулой C 6 H 2 (NO 2 ) 3 OH, нитропроизводное фенола . Молекулярная масса 229,11 а. е. м. При нормальных условиях — жёлтое кристаллическое ядовитое вещество . Пикриновую кислоту и её соли ( пикраты ) используют как взрывчатые вещества , а также в аналитической химии для определения калия , натрия .
Другие названия:
- мелинит (Melinite) во Франции
- мелинит (Melinit) в Российской империи
- лиддит (Lyddite) в Великобритании
- пертит (Pertit) в Италии
- пикриновая кислота (Picric acid, PA) в США
- пикринит, пикринита (Picrinit, Picrinita) в Испании
- Экразит (Ekrasit) в Австрии [ уточнить ]
- TNF в Польше , США и др.
- шимозе, шимоза ( яп. 下瀬火薬 симосэ каяку ) в Японии
История
Предположительно, соли пикриновой кислоты (пикраты свинца и калия) обнаружил в 1642 году Глаубер , воздействуя азотной кислотой (методы изготовления которой он разработал) на шерсть и рог .
В 1771 году ( ) получил тринитрофенол действием азотной кислоты на природный краситель индиго . Кислотные свойства соединения обнаружены в 1783 году . При дальнейших исследованиях тринитрофенол получили при действии азотной кислотой на различные органические вещества: шёлк , природные смолы и прочие.
В 1841 (Marchand) предложил формулу C 12 H 6 N 6 O 14 (удвоенная формула тринитрофенола), а правильную формулу в 1842 году установил Лоран (Laurent), определив, что пикриновая кислота представляет собой тринитрофенол и может быть получена нитрованием фенола. Им же был выделен динитрофенол как продукт промежуточной стадии нитрования.
В 1869 году метод нитрования был усовершенствован Шмидтом и (Schmidt, Glutz), предложившими сульфирование с последующим нитрованием. Взрывчатые свойства пикратов были обнаружены ещё в 1799 году (Welter), однако до 1830-х годов это свойство не находило применения. Во второй половине XIX века пикраты (в основном калия и аммония) стали широко использоваться в военном деле. Длительное время сам тринитрофенол использовался как жёлтый краситель для шерсти и шёлка и не считался взрывоопасным веществом, в 1871 году такой авторитетный специалист, как Абель , утверждал, что только пикраты обладают взрывчатыми свойствами, а тринитрофенол нет. Однако уже в 1873 году Шпренгель (Sprengel) показал способность тринитрофенола к детонации , а в 1886 году французский инженер Тюрпен (Turpin) обнаружил, что в сплавленном или сильно спрессованном состояниях тринитрофенол детонирует, и предложил его для снаряжения боеприпасов. Это дало начало широкому применению тринитрофенола в качестве мощного бризантного взрывчатого вещества.
Первое производство бризантных артиллерийских снарядов с плавленным тринитрофенолом было налажено во Франции, а затем во многих других странах. В Российской империи производство тринитрофенола началось в 1894 году. В Российской империи в военном деле было принято французское название этого вещества «мелинит». Артиллерийский офицер С. В. Панпушко разработал боеприпасы для тяжёлых и полевых орудий. Во время испытательных стрельб произошло два разрыва лёгких 87-мм полевых пушек с человеческими жертвами. 28 ноября 1891 года при взрыве опытной бомбы, снаряженной мелинитом, погиб и сам С. Панпушко и два его помощника, вместе с ним заряжавших роковой заряд, что затормозило разработки новых вооружений в России.
Во время русско-японской войны 1904—1905 годов японская армия применяла в широких масштабах снаряды «шимозе» к 75-мм полевым и горным пушкам, в которых заряд примерно 0,8 кг тринитрофенола был особым образом из расплава отлит в виде мелкозернистой массы. В этой же войне Японией были впервые применены крупнокалиберные (до 12 дюймов) снаряды корабельной артиллерии с массой заряда тринитрофенола до 41 кг, которые не могли пробить броневую защиту, но наносили значительные разрушения на палубах , вызывали обширные пожары и показали хорошую эффективность. Русско-японская война стала апофеозом применения тринитрофенола.
Высокая активность ВВ, большое количество несчастных случаев (большое количество разрывов снарядов в стволах, да и взрыв броненосца « Микаса » многие приписывают капризу «шимозе») заставили химиков многих стран искать альтернативу. Таковым стал тринитротолуол .
Военное значение тринитрофенола сохранялось вплоть до Второй мировой войны , однако использовался он всё меньше и меньше. Уже в Первую мировой войну его использование было ограничено. В настоящее время привлекательность его из-за повышенной коррозионной активности и чувствительности по сравнению с тротилом невысока. В то же время относительная простота кустарного изготовления и высокая взрывная эффективность тринитрофенола привлекали и продолжают привлекать внимание террористов .
С осени 1944 года промышленность Германии в виду тяжёлого положения на фронтах отказывается от промышленного производства тринитротолуола в пользу тринитрофенола (А. Б. Широкорад, Бог войны Третьего рейха). По этой причине складированные и неразорвавшиеся германские боеприпасы представляют для поисковиков повышенную опасность.
Физические свойства
Чистый тринитрофенол — твёрдое вещество в виде пластинчатых или призматических кристаллов , цвет от бесцветного до жёлтого, плотность 1813 кг/м³, температура плавления 122,5 °C.
Кристаллическая система орторомбическая бипирамидальная.
Давление паров при 195 °C — 2 мм рт. ст., при 255 °C — 50 мм рт. ст. Плотность расплава при 124 °C 1589 кг/м³, при 170 °C — 1513 кг/м³. Гравиметрическая (насыпная) плотность порошка 900—1000 кг/м³.
Порошок хорошо прессуется, особенно при подогревании. При давлении прессования 4500 кг/см² плотность 1740 кг/м³, однако практически из соображений безопасности порошок прессуют при давлениях до 2000 кг/см², при этом получается плотность не выше 1630 кг/м³. При медленном охлаждении расплава можно получить твёрдое вещество с плотностью 1580—1610 кг/м³. Чем меньше примесей, тем выше плотность плавлёного тринитрофенола.
Химические свойства
Растворимость
В холодной воде растворяется слабо, около 1,1 % при +15 °C. В горячей воде растворимость значительно увеличивается до 6,5 % при 100 °C. По другим данным, при +20 °C растворяется 1,14 %, при +60 °C — 2,94 % и при 100 °C — 9,14 %. Водный раствор тринитрофенола окрашен в интенсивный желтый цвет благодаря присутствию аниона . Неионизированная молекула в безводных растворах цвета не имеет (например, в петролейном эфире ). В присутствии сильных кислот раствор также не имеет окраски, это свойство позволяет использовать тринитрофенол в качестве кислотно-основного индикатора .
В
этиловом спирте
и
диэтиловом эфире
растворимость относительно высока. В 100 г спирта при +20 °C растворяется 6,23 г пикриновой кислоты, а при температуре кипения — 66,2 г. При +13 °C в 1 л безводного эфира растворяется 10,8 г пикриновой кислоты; при содержании в эфире 0,8 % воды растворяется 36,8 г, а присодержании 1 % воды — 40 г.
Растворяется в
метиловом спирте
,
глицерине
,
хлороформе
,
сероуглероде
,
ацетоне
и особенно хорошо в
бензоле
. В 100 г бензола растворяется 3,7 г при +5 °C, 7,29 г — при +15 °C, 9,55 г — при +20 °C и 96,77 г — при +75 °C.
В смесях серной кислоты и воды растворимость заметно возрастает при концентрации кислоты выше 70 % и при увеличении температуры. При температуре +18 °C растворимость в безводной серной кислоте 10,1 г/100 мл кислоты, а при +80 °C — 25,8 г/100 мл кислоты. При разбавлении раствора в серной кислоте тринитрофенол выпадает в осадок .
Эвтектические смеси
Тринитрофенол образует со многими веществами эвтектические смеси, что широко использовалось при снаряжении боеприпасов, поскольку температура плавления чистого тринитрофенола 122,5 °C создаёт значительные технологические сложности. Наиболее привлекательными с практической точки зрения являются смеси с другими нитросоединениями:
- смесь с нитронафталином 1:1, температура плавления +49 °C
- смесь с тринитротолуолом 1:1, +47 °C
- смесь с 1:1, +70 °C
Взаимодействие с металлами
Тринитрофенол достаточно сильная кислота, способная к обменным реакциям с образованием солей металлов ( пикратов ). Наиболее часто встречаются:
- пикрат натрия C 6 H 2 (NO 2 ) 3 ONa
- пикрат кальция (C 6 H 2 (NO 2 ) 3 O) 2 Ca
- пикрат железа (C 6 H 2 (NO 2 ) 3 O) 3 Fe 2
- пикрат свинца (C 6 H 2 (NO 2 ) 3 O) 2 Pb
Все пикраты — твёрдые кристаллические вещества, обладающие значительно более высокой чувствительностью , чем тринитрофенол. Это требует особого внимания к применению металлов и металлическим загрязнениям при его производстве. Прямое образование пикратов в среде серной кислоты не происходит, основную опасность представляют примеси в промывочной воде и материалы, с которыми контактирует очищенный тринитрофенол. Из-за повышенной чувствительности пикратов, при изготовлении боеприпасов требуются специальные меры по изоляции заряда от металлической оболочки.
Другие свойства
- Характерная качественная реакция — с цианидом калия , в которой образуется ярко-красная .
- Тринитрофенол со многими ароматическими химическими веществами образует нестойкие соединения, в которых не образуются полноценные ковалентные или ионные химические связи.
- Окисляется сильными окислителями . В кипящей азотной кислоте окисляется до щавелевой кислоты . В кипящем растворе персульфата аммония полностью окисляется:
- Восстанавливается сульфидом или гидросульфитом натрия , сульфатом железа до пикрамовой (picramic) кислоты, применяемой как сырьё в производстве красок и . Дальнейшее восстановление приводит к образованию .
- Кипячение в концентрированном растворе гидроксида натрия приводит к разложению:
- Взаимодействие с гипохлоритами приводит к разложению с образованием хлорпикрина , это один из промышленных способов его получения:
- Взаимодействие с хлором , царской водкой , хлоратом калия в присутствии HCl приводит к образованию хлоранила (chloranil) и хлорпикрина.
Взрывчатые свойства
Основные характеристики
- Реакция разложения
- в замкнутой бомбе: 71,05 % CO, 3,42 % CO 2 , 0,34 % O 2 , 1,02 % CH 4 , 13,8 % H 2 , 21,1 % N 2
- Кислородный баланс при окислении до CO 2 : −45 %
- Расчётные характеристики для разных плотностей:
| Показатель | При плотности 1,76 г/см³ | При плотности 1,00 г/см³ |
|---|---|---|
| Состав продуктов взрыва | ||
| CO 2 | 2,661 | 1,310 |
| CO | 0,179 | 2,970 |
| H 2 O (г) | 1,499 | 1,409 |
| N 2 | 1,500 | 1,496 |
| C (тв) | 3,160 | 1,713 |
| H 2 | - | 0,065 |
| NH 3 | - | 0,008 |
| CH 4 | - | 0,006 |
| Скорость детонации , м/с | 7680 | 5545 |
| Давление детонации , кбар | 265 | 88 |
| Теплота взрыва , ккал/г | 1,27 | 1,02 |
| Объём продуктов взрыва, см³/г | 0,423 | 0,714 |
- Скорость детонации зависит от плотности:
| Плотность, г/см³ | Скорость детонации, м/с |
|---|---|
| 0,97 | 4965 |
| 1,32 | 6190 |
| 1,41 | 6510 |
| 1,62 | 7200 |
| 1,70 | 7480 |
Зависимость скорости детонации D от плотности ρ довольно точно описывается уравнением Кука (Cook):
D[м/с] = 5255 + 3045 (ρ[г/см³] — 1).
- Критический диаметр зависит от размера зёрен порошка и плотности заряда:
| Размер зёрен, мм | Плотность, г/см³ | Критический диаметр, мм |
|---|---|---|
| 0,1—0,75 | 0,95 | 9,0 |
| менее 0,1 | 0,95 | 5,5 |
| 0,01—0,05 | 0,8 | 2,1—2,3 |
| 0,05—0,07 | 0,7 | 3,6—3,7 |
- Фугасность в свинцовом блоке 310 мл (тротил 285 мл, гексоген 470)
- Бризантность по обжатию свинцового столбика 17 мм (тротил 16 мм, гексоген — 24)
- Чувствительность в сплавленном состоянии ниже, чем в порошке. В присутствии пикратов чувствительность значительно возрастает.
- Чувствительность к удару по сравнению с тротилом по одним данным ниже, а по другим — выше, в зависимости от условий испытаний. При испытании грузом 10 кг и высотой падения 25 см частость взрывов 24—32 % (тротил 4—8 %, гексоген 79—80 %, тэн 100 %)
- При трении между твёрдыми материалами (сталь, чугун) порошок детонирует, между цветными металлами детонация не возникает.
- При простреле свободно насыпанного порошка винтовочной пулей воспламеняется.
- При простреле замкнутых оболочек с плавленным тринитрофенолом может быть выгорание, частичная или полная детонация в зависимости от характера оболочки и заряда. Чем прочнее оболочка, тем вероятнее детонация.
- Чувствительность к нагреву:
| Температура, °C | Задержка до взрыва, сек. |
|---|---|
| 350 | 1,5 |
| 315 | 5,5 |
| 277 | 26,3 |
| 267 | 50,3 |
| 260 | не детонирует |
Инициирование взрыва
Детонирует от капсюля-детонатора . Восприимчивость снижается с возрастанием плотности прессованного и ещё ниже у плавленного тринитрофенола:
- при плотности 1580 кг/м³ (давление прессования 1500 кг/см²) детонирует от капсюля с 0,4 г гремучей ртути
- при плотности 1680 кг/м³ (давление прессования 2900 кг/см²) необходим капсюль с 0,65 г гремучей ртути
- для плавленного необходим капсюль с 3 г гремучей ртути, но на практике такими не пользуются и применяется промежуточный детонатор.
- для различных условий масса азида свинца для инициирования 0,03-0,24 г
Свойства при нагревании
При нагревании в различных условиях:
- при 122,5 °C плавится без разложения, в жидком состоянии жёлто-бурого цвета;
- при медленном нагревании слабо возгоняется ;
- в свободном состоянии при 183 °C большой индукционный период до начала разложения, при уменьшении объёма для паров индукционный период уменьшается;
- при 230 °C индукционный период до начала разложения отсутствует;
- температура воспламенения 300—310 °C, в свободном состоянии сгорает без вспышки. Горит спокойно, сильно коптящим пламенем, с плавлением. Даже большие массы (порядка 100 кг) могут спокойно гореть, если при этом расплав свободно растекается;
- при быстром нагревании в замкнутой оболочке до 300 °C взрывается.
Опасность в производстве и применении
- Взрыв пикриновой кислоты в 1887 году на фабрике в Манчестере был вызван образованием пикратов во время пожара. Расплавленная от пламени пикриновая кислота попала на литопон, в результате чего образовался пикрат свинца. Он послужил детонатором, от которого взорвалась пикриновая кислота.
- Пожар и взрыв в 1900 году на фабрике в Хаддерсфилде (Hudders-field) был вызван образованием пикрата железа на паровых трубах. При ремонте от удара пикрат железа загорелся, и пламя распространилось на сушилку пикриновой кислоты.
- 6 декабря 1917 года в гавани канадского города Галифакс произошёл мощнейший взрыв корабля "Монблан" , который среди всего прочего перевозил 2300 тонн сухой и жидкой пикриновой кислоты. В результате взрыва Галифакс был практически полностью разрушен. 1963 человека погибли, 9 тысяч получили ранения, 2 тысячи человек пропали без вести, а общий ущерб от взрыва оценивается в 35 миллионов канадских долларов.
- На одной из фабрик во Франции вдоль железнодорожных путей образовались полосы пыли пикриновой кислоты. Значительное содержание кальция во влажной почве повлекло образование пикрата кальция. В жаркую сухую погоду он высох и вызвал пожар вдоль всех путей, по которым перемещали пикриновую кислоту.
Получение
Прямое нитрование фенола
Тринитрофенол может быть получен прямым нитрованием фенола в концентрированной азотной кислоте:
При этом идёт сильный разогрев, который приводит к разрушению и осмолению фенола, образованию различных побочных продуктов. Выход тринитрофенола низкий, в процессе происходит значительное разбавление кислоты. Тем не менее, этот способ был основным в период до и во время Первой мировой войны. Процесс осуществлялся в керамических горшках и обычно без перемешивания, поскольку растворы кислот корродировали металлы и загрязняли готовый продукт пикратами. Регулирование температуры также было затруднительно. Для преодоления недостатков этого способа были разработаны и нашли применение в производстве другие способы.
Синтез из фенола через фенолсульфокислоты
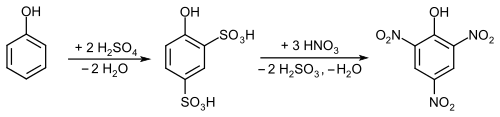
Из анисовой кислоты, содержащейся в анисовом , фенхелевом и ряде других эфирных масел, перегонкой выделяется анизол (масла Gaultheria procumbens, т. е. салицилово-метилового эфира ). Далее,
Фенол сильно окисляется (нитрирующей смесью), поэтому вначале его сульфируют, а потом нитруют азотной кислотой при нагревании. Следом за этим осуществляется электрофильное ипсо-замещение сульфогруппы на нитрогруппу.
Этим способом тринитрофенол получается из фенола последовательной обработкой серной и азотной кислотами. На первой стадии происходит сульфирование фенола до моно- и дисульфокислот, на второй стадии идёт нитрование сфенолсульфокислот с отщеплением сульфогрупп и образованием тринитрофенола:
Процесс также проводился в керамических горшках, стадии проводились последовательно. По сравнению с прямым нитрованием этот способ имеет как преимущества (меньшая опасность, отсутствие продуктов разложения фенола, более высокий выход), так и недостатки (значительно больший расход кислот). У этого способа много технологических разновидностей, которые можно объединить в две группы:
- нитрование в относительно слабых растворах кислот с применением избытка серной кислоты на первой стадии, последующего разбавления и обработкой 65%-ной азотной кислотой (обычный способ) или натриевой селитрой («французский способ»).
- нитрование в относительно крепких растворах кислот (метод Каста и его вариации). Крепкие кислоты позволяли использовать металлические аппараты с регулированием температуры и перемешиванием. По методу Каста сульфирование фенола проводилось в 20%-ном олеуме при соотношении 1:4 при температуре 90—100 °C в течение 5 часов, при этом образовывался дисульфофенол. Реакционная масса разбавлялась серной кислотой с плотностью 1,84 г/см³ (95,6 %), а затем проводилась нитрация азотной кислотой с плотностью 1,46 г/см³ (80 %) либо серно-азотной смесью.
Получение из бензола через хлорбензол
Процесс проводится в несколько стадий, некоторые оказались достаточно сложны в производстве и метод долго отрабатывался и получил распространение в период и после Первой мировой войны.
1. Хлорирование бензола до монохлорбензола :
- .
2. Нитрования монохлорбензола до динитрохлорбензола смесью серной и азотной кислот:
- .
3. Обработка динитрохлорбензола каустической содой (гидроокисью натрия) с получением :
- .
4. Омыление динитрофенолята натрия серной кислотой с получением динитрофенола:
- .
5. Получение тринитрофенола обработкой динитрофенола смесью серной и азотной кислот:
- .
Практический выход тринитрофенола 1,6 тонны на 1 тонну бензола (54 % от теоретического). Недостаток способа — большие отходы растворов соляной кислоты.
Применение
- Промежуточный продукт в производстве красителей . Им красили кожу, поскольку способен реагировать с белками в коже, давая темно-коричневый цвет.
- Катализатор реакций полимеризации (например, ).
- компонент окрашивающего раствора Ван Гизона ( Van Gieson ) в гистологии .
- Травитель в металловедении (ГОСТ 2567-54). Например, для выявления субструктуры феррита применяется травитель (4 г пикриновой кислоты; 96 мл этилового спирта) . В металлургии, 4% пикриновая кислота в этаноле называется «picral» и широко использовалась в оптической металлографии, чтобы выявить границы зерен в ферритных сталях. Из-за опасности была заменена другими химическими травителями. Тем не менее, она все еще используется для травления магниевых сплавов, таких как AZ31.
- Антисептическое средство .
- общеалкалоидный осадительный реактив.
- Пигмент для пометки лабораторных животных .
Хранение
Рекомендуется хранить в воде, поскольку тринитрофенол чувствителен к ударам и трению. Пикриновая кислота является особенно опасной, поскольку она является летучей и медленно сублимируется даже при комнатной температуре. Со временем накопление пикратов на открытых металлических поверхностях может представлять опасность взрыва.
Физиологическое воздействие
Тринитрофенол имеет очень горький вкус . Пыль раздражает дыхательные пути. Продолжительное вдыхание и контакт со слизистыми и кожей ведут к поражению почек , кожным болезням. Слизистые оболочки глаз приобретают характерный жёлтый цвет.
Дополнительно
Примечания
- ↑
- — С. 11.
- Peter Woulfe (1771) от 22 декабря 2016 на Wayback Machine . Philosophical Transactions of the Royal Society of London 61 : 114—130. See pages 127—130: «A method of dying wool and silk, of a yellow colour, with indigo; and also with several other blue and red colouring substances.» and «Receipt for making the yellow dye.» — where Woulfe treats indigo with nitric acid («acid of nitre»).
- . Дата обращения: 4 января 2018. 5 января 2018 года.
- D`Ans, Ellen Lax. Taschenbuch für Chemiker und Physiker, Band II, Springer-Verlag 1964.
- A. Bernthsen: Kurzes Lehrbuch der organischen Chemie. Friedr. Vieweg & Sohn, Braunschweig 1914.
- Брокгауз и Ефрон. Брокгауз и Евфрон. Энциклопедический словарь, 2012..
- М.Беккерт, Х.Клемм. Справочник по металлографическому травлению..
Литература
- // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб. , 1890—1907.
- Справочник по производству взрывчатых веществ./ Под ред. И. В. Лебедева. — ОНТИ , Госхимтехиздат . — М., Л. — 1934. — с. 146—170.
- Fedoroff, Basil T. et al Enciclopedia of Explosives and Related Items, vol.1—7. — Dover, New Jersey: Picatinny Arsenal. — 1960—1975. — P285-P295.
- Волков И. Подрывные средства при устройстве заграждений. — М.: Государственное военное издательство , 1933.
- 2020-01-22
- 1