Interested Article - Лактатдегидрогеназа

- 2021-04-04
- 1
|
Лактатдегидрогеназа A
(субъединица M) |
|
|---|---|

Лактатдегидрогеназа M 4 ( изофермент обнаруженный в скелетных мышцах ). PDB . |
|
| Обозначения | |
| Символы | ; LDHM |
| CAS | |
| HGNC | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Другие данные | |
| Шифр КФ | |
| Локус | 11-я хр. , |
| ? | |
|
Лактатдегидрогеназа B
(субъединица H) |
|
|---|---|

|
|
| Обозначения | |
| Символы | ; LDHL |
| CAS | |
| HGNC | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Другие данные | |
| Шифр КФ | |
| Локус | 12-я хр. , |
| ? | |
|
Лактатдегидрогеназа С
субъединица |
|
|---|---|

|
|
| Обозначения | |
| Символы | |
| CAS | |
| HGNC | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Другие данные | |
| Шифр КФ | |
| Локус | 11-я хр. , |
| ? | |
Лактатдегидрогеназа , ЛДГ , англ. LDH (L-лактат: NAD-оксидоредуктаза (LDH) 1.1.1.27) — фермент , принимающий участие в реакциях гликолиза . Лактатдегидрогеназа катализирует превращение лактата в пируват , при этом образуется NADH.
Коферментом лактатдегидрогеназы является никотинамидадениндинуклеотид (НАД, NAD ). NAD — кофермент динуклеотидного типа, в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью.
Лактатдегидрогеназа открыта в 1909 году , её биологическая роль описана в 1933 году.
Анализ на ЛДГ входит в биохимический анализ крови .
История открытия
Впервые лактатдегидрогеназа получена из отмытой мышцы О. Мейергофом в 1909 году . [ источник не указан 180 дней ]
ЛДГ была идентифицирована Б. Андерсоном ( Bength Andersson ) в 1933 году ( Andersson B. Über Co-Zymaseaktievirung einiger Dehydrogenase : [нем.] . — Zeitschrift für Physiologische Chemie. — Band 217. — S. 186–190.) , в своей статье он представил доказательства необходимости этого фермента для синтеза пирувата .
Вывод Андерсона подтвердили спектрофотометическим методом У. фон Эйлер с коллегами в 1937 году .
В 1940 году Б. Ф. Штрауб ( нем. Ferenc Straub ) выделил лактатдегидрогеназу из воловьего сердца и получил её в кристаллическом виде .
Химические свойства
Лактатдегидрогеназа устойчива к химическим воздействиям, например к действию реактивов, окисляющих или блокирующих , например и . Активность лактатдегидрогеназы снижается при повышении концентрации пирувата выше 10 −4 М. Значительное инактивирование, обратимое при добавлении цистеина , происходит при инкубировании с .
Биологическая роль
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Нормы (референсные значения) содержания ЛДГ в крови человека:
- новорожденные — до 2000 Ед/л
- дети до 2 лет — 430 Ед/л
- дети от 2 до 12 — 295 Ед/л
- дети старше 12 лет и взрослые — 250 Ед/л
Реакция
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
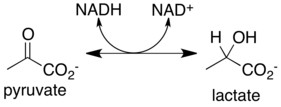
Лактатдегидрогеназа катализирует взаимопревращение пирувата и лактата с сопутствующим взаимопревращением NADH и NAD + . Он превращает пируват, конечный продукт гликолиза, в лактат, когда кислород отсутствует или его не хватает, и он выполняет обратную реакцию во время цикла Кори в печени. При высоких концентрациях лактата фермент проявляет ингибирование с обратной связью , и скорость превращения пирувата в лактат снижается. Она также катализирует дегидрирование , но это гораздо более бедный субстрат, чем лактат.
Активный центр
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
ЛДГ у людей использует His(193) в качестве акцептора протонов и работает в унисон с коферментом (Arg 99 и Asn 138) и остатками, связывающими субстрат (Arg106; Arg169;Thr 248) . Активный сайт( ошибка бота?) His (193) обнаружен не только в человеческой форме ЛДГ, но и у многих разных животных, что свидетельствует о конвергентной эволюции ЛДГ. Две разные субъединицы ЛДГ (ЛДГ-A, также известная как М-субъединица ЛДГ, и ЛДГ-B, также известная как Н-субъединица ЛДГ) сохраняют один и тот же активный сайт и одни и те же аминокислоты , участвующие в реакции. Заметным различием между двумя субъединицами, составляющими третичную структуру ЛДГ, является замена аланина (в М-цепи) на глютамин (в Н-цепи). Считается, что это крошечное, но заметное изменение является причиной того, что Н-субъединица может быстрее связывать NAD, а каталитическая активность М-субъединицы не снижается в присутствии , тогда как активность Н-субъединицы снижается в пять раз .
Изоферменты
Изоферменты лактатдегидрогеназы имеют разный состав субъединиц М (muscle) и Н (heart) . Нумерация идет в зависимости от подвижности в геле при электрофорезе :
- ЛДГ 1 — (НННН) — обладающий наибольшей подвижностью, содержится преимущественно в миокарде ;
- ЛДГ 2 — (НННМ) — преимущественно локализован в эритроцитах и почках .
- ЛДГ 3 — (ННММ) — преимущественно содержится в легких ;
- ЛДГ 4 — (НМММ) — преимущественно локализован в скелетных мышцах и отчасти в гепатоцитах . Это причина того, что при болезни Боткина , в сыворотке крови больного одновременно повышается активность и содержание и ЛДГ-5, и ЛДГ-4;
- ЛДГ 5 — (ММММ) — обладающий наименьшей подвижностью, преимущественно локализован в гепатоцитах .
Изоферменты используются при диагностике инфарктов, ишемий, повреждения почек и т. д. Уровень лактатдегидрогеназы коррелирует со степенью тяжести заболевания, спровоцировавшего выброс фермента в кровь .
См. также
Примечания
- Комов, В. П. Биохимия : учебн. для вузов / В. П. Комов, В. Н. Шведова. — 3-е изд., стереотип. — М. : Дрофа, 2008. — 638 с. : ил. — (Высшее образование: Современный учебник). — ISBN 978-5-358-04872-0 .
- States, D. M. A Chronology of the Identification of the Enzymes of Glycolysis. — In: : [ англ. ] // The Nobel Prizes.
- Ferretti, G. // : [ англ. ] . — Springer, 2015. — С. 11. — 180 с. — ISBN 978-3-31-905636-4 . — ISBN 3319056360 .
- ↑ Barnett, J. A. // : [ англ. ] / Ed.: Marcel Florkin. — Gulf Professional Publishing, 1972. — Vol. 44. — С. 66–67. — ISBN 978-0-44-451866-8 . — ISBN 0444518665 .
- Roger S. Holmes, Erwin Goldberg. (англ.) // Computational Biology and Chemistry. — 2009-10. — Vol. 33 , iss. 5 . — P. 379–385 . — doi : . 26 октября 2022 года.
- Helen M. Wilks, Keith W. Hart, Raymond Feeney, Cameron R. Dunn, Hilary Muirhead. (англ.) // Science. — 1988-12-16. — Vol. 242 , iss. 4885 . — P. 1541–1544 . — ISSN . — doi : . 14 февраля 2023 года.
- W Eventoff, M G Rossmann, S S Taylor, H J Torff, H Meyer. (англ.) // Proceedings of the National Academy of Sciences. — 1977-07. — Vol. 74 , iss. 7 . — P. 2677–2681 . — ISSN . — doi : .
- Т.И. ПУШКАРЕВА, Е.Б. РОМАНЦОВА, В.В. ЯКОВУК. ПОКАЗАТЕЛИ КРОВИ У ДЕТЕЙ (ВОЗРАСТНЫЕ ОСОБЕННОСТИ). — Благовещенск, 2010.
- . Диалаб . Дата обращения: 23 января 2021. 29 января 2021 года.
Литература
- Glancy, B. Mitochondrial lactate metabolism: history and implications for exercise and disease : [ англ. ] / B. Glancy, D. A. Kane, A. N. Kavazis … [ et al. ] // The Journal of Physiology. — 2020. — Vol. 599, no. 3. — P. 863–888. — doi : . — PMID . — PMC .
|
|
Это
заготовка статьи
по
биохимии
. Помогите Википедии, дополнив её.
|
|
|
В другом языковом разделе
есть более полная статья
(англ.)
.
|
- 2021-04-04
- 1