Interested Article - Гем C

- 2021-04-29
- 1
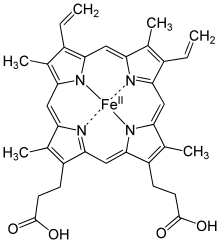
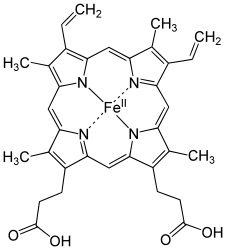
Гем С — вид гема , отличается от гема B наличием тиольных групп.
История
Точная структура гема С была опубликована в середине XX века шведским биохимиком К. Г. Паулем. Эта работа подтвердила верность формулы, предположенной ранее великим шведским биохимиком Хуго Теореллем . В 1975 году структура гема С была подтверждена экспериментально методами ядерного магнитного резонанса и инфракрасного излучения на восстановленной, Fe (II), форме гема. Впервые структура гема С, включая абсолютную стереохимическую конфигурацию тиоэфирных связей, была показана для белка позвоночного , а ныне и для многих других гем-С-содержащих белков.
Свойства
Гем С отличается от гема В тем, что два боковых винильных радикала заменены двумя ковалентными тиоэфирными связями с ферментом. Эти связи не позволяют ему так легко отсоединится от холопротеина или цитохрома с по сравнению с гемом В, который может отсоединится от гемопротеиновых комплексов даже при мягких условиях. Это делает возможным существование неизмеримо большого числа различных структур цитохромов , выполняющих различные функции, и работающих в основном как переносчики электронов.
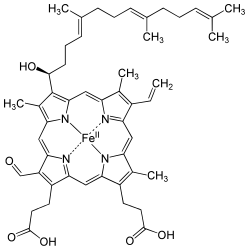
Количество молекул гема С, присоединённых к одной молекуле белка достаточно широко варьирует. Для клеток позвоночных животных действует правило: один белок — один гем, но у бактерий обычно бывает 2, 4, 5, 6 или даже 16 гемов С на один холопротеин. Считается, что определённое количество и взаиморасположение гемов, не только связано с функциями белка, но и абсолютно необходимы. Например, белки содержащие несколько гемов С участвуют во множественном переносе электронов, особенно важной является реакция 6-ти электронного восстановления, необходимая для восстановления атмосферного азота до двух молекул аммиака. Для бактериальных гемопротеинов характерно высокое соотношение гемов С к аминокислотам, поэтому внутренняя часть некоторых цитохромов с часто оказываются полностью упакованной большим количеством групп гемов, по сравнению с обычными гемопротеинами . Некоторые из них, обычно из одноклеточных организмов , могут содержать до пяти гемов С. Ещё одним важным ферментом, содержащим гем С, является Коэнзим Q - цитохром c редуктаза .
Тиоэфирные связи, по-видимому, многократно увеличивают функциональность холопротеинов. Обычно цитохромы с можно «точно настроить» на большое количество окислительно-восстановительных потенциалов , чем цитохромы b. Возможно именно по этой причине цитохром с практически вездесущ на всех уровнях жизни. Гем С также играет важную роль в апоптозе клеток, когда всего несколько цитоплазматических молекул цитохрома с, содержащих гем С, приводят к программируемой смерти клеток.
Вдобавок к ковалентным связям, железо в геме С дополнительно координируется двумя аминокислотными цепями по 5-й и 6-й координационным связям, , что делает его шестикоординированным. Именно это позволяет железу в цитохроме менять свою валентность, в отличие от железа в гемоглобине, которое вне зависимости от присоединения или отдачи кислорода остаётся двухвалентным. Например, цитохром с млекопитающих и тунца содержит единственный гем С одновременно скоординированный цепями из гистидина и метионина . Возможно именно из-за двух ковалентных связей , удерживающих гем, железо в геме С иногда лигируется аминогруппой лизина или даже водой.
Источники
- Paul, K.G.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof. The splitting with silver salts of the cysteine-porphyrin bonds in cytochrome c (англ.) // : journal. — 1950. — Vol. 4 . — P. 239—244 . — doi : .
- Caughey, W.S. et al. Heme A of Cytochrome c Oxidase (англ.) // Journal of Biological Chemistry : journal. — 1975. — Vol. 250 . — P. 7602—7622 .
- Takano T., Trus B.L., Mandel N., Mandel G., Kallai O.B., Swanson R., Dickerson R.E. Tuna cytochrome c at 2.0 A resolution. II. Ferrocytochrome structure analysis. (англ.) // Journal of Biological Chemistry : journal. — 1977. — Vol. 252 . — P. 776—785 . — .
- . Дата обращения: 28 октября 2012. 30 мая 2020 года.
- Bowman, S.E.J., Bren, K.L. The chemistry and biochemistry of heme C: functional bases for covalent attachment (англ.) // : journal. — 2008. — Vol. 25 , no. 6 . — P. 1118—1130 . — doi : . — . — PMC .
- Yeh, S.R., Han, S., and Rousseau, D.L. Cytochrome c folding and unfolding (англ.) // : journal. — 1998. — Vol. 31 , no. 11 . — P. 727—735 . — doi : .
См. также
- 2021-04-29
- 1