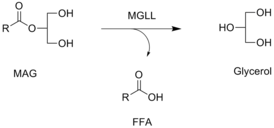Interested Article - Моноацилглицероллипаза

- 2020-06-28
- 2
| Моноацилглицероллипаза | |
|---|---|

|
|
| Обозначения | |
| Символы | |
| HGNC | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Другие данные | |
| Шифр КФ | |
| Локус | 3-я хр. , -q13.33 |
| ? | |
Моноацилглицероллипаза, также известная как МАГ липаза, ацилглицероллипаза, МАГЛ, МГЛ или МГЛЛ является ферментом , который, в организме человека, кодируются геном Mgll . МГЛ является 33-кДа мембраносвязанным членом суперсемейства сериновых гидролаз и содержит классическую консенсусную последовательность GXSXG, общую для большинства сериновых гидролаз. Каталитическая триада фермента идентифицирована как Ser122, His269 и Asp239 .

Функция
Моноацилглицероллипаза катализирует химическую реакцию , в которой молекулы воды разрушают моноэфиры глицерина и длинноцепочечной жирной кислоты . Она функционирует вместе с гормон-чувствительной липазой , гидролизуя внутриклеточные запасы триглицеридов в адипоцитах и других клетках до жирных кислот и глицерина. МГЛ может также дополнять липопротеинлипазу (ЛПЛ) в завершении гидролиза моноглицеридов, возникающего в результате разложения триглицеридов липопротеинов .
Моноацилглицероллипаза является ключевым ферментом в гидролизе эндоканнабиноида 2-арахидоноилглицерина (2-AG) . Он превращает в свободные жирные кислоты и глицерин . Вклад МГЛ в общую активность гидролиза 2-АГ мозга оценивается в ~ 85 % ( и отвечают за ~ 4 % и ~ 9 %, соответственно, оставшейся части) , и это оценка in vitro была подтверждена in vivo селективным ингибитором МГЛ JZL184 . Хроническая инактивация МГЛ приводит к массивному (>10-кратному) повышению уровня 2-АГ в мозге у мышей, наряду с выраженной компенсаторной понижающей регуляцией рецепторов CB 1 в селективных областях мозга .
Ингибиторы
Ингибиторы фермента MAGL ( , , ) вызывают у мышей каннабиноидные поведенческие эффекты .
Дополнительные примеры включают:
См. также
Примечания
- "A novel poxvirus gene and its human homolog are similar to an E. coli lysophospholipase". Virus Research . 52 (2): 157—67. December 1997. doi : . PMID .
- ↑ "cDNA cloning, tissue distribution, and identification of the catalytic triad of monoglyceride lipase. Evolutionary relationship to esterases, lysophospholipases, and haloperoxidases". The Journal of Biological Chemistry . 272 (43): 27218—23. October 1997. doi : . PMID .
- .
- "Purification and some properties of a monoacylglycerol-hydrolyzing enzyme of rat adipose tissue". The Journal of Biological Chemistry . 251 (3): 813—9. February 1976. doi : . PMID .
- "Exon-intron organization and chromosomal localization of the mouse monoglyceride lipase gene". Gene . 272 (1—2): 11—8. July 2001. doi : . PMID .
- "Brain monoglyceride lipase participating in endocannabinoid inactivation". Proceedings of the National Academy of Sciences of the United States of America . 99 (16): 10819—24. August 2002. doi : . PMID .
- . Nature Neuroscience . 8 (9): 1139—41. September 2005. doi : . PMID . из оригинала 23 августа 2021 . Дата обращения: 23 августа 2021 .
- PhD, Q Ashton Acton. . — Atlanta, GA: Scholarly Media LLC, 2012. — 1 online resource (96 p.) с. — ISBN 978-1-4816-0672-1 , 1-4816-0672-7.
- "A comprehensive profile of brain enzymes that hydrolyze the endocannabinoid 2-arachidonoylglycerol". Chemistry & Biology . 14 (12): 1347—56. December 2007. doi : . PMID .
- ↑ "Selective blockade of 2-arachidonoylglycerol hydrolysis produces cannabinoid behavioral effects". Nature Chemical Biology . 5 (1): 37—44. January 2009. doi : . PMID .
- Savinainen JR, Saario SM, Laitinen JT (February 2012). . Acta Physiologica . 204 (2): 267—76. doi : . PMC . PMID .
Дальнейшее чтение
- "Simultaneous purification and comparative characterization of six serine hydrolases from rat liver microsomes". Arch. Biochem. Biophys . 200 (2): 547—59. 1980. doi : . PMID .
- "A study of a monoglyceride-hydrolyzing enzyme of intestinal mucosa". J. Biol. Chem . 241 (10): 2306—10. 1966. doi : . PMID .
Ссылки
Эта статья содержит текст из Национальной библиотеки медицины США , который находится в общественном достоянии .
- 2020-06-28
- 2