Interested Article - RecBCD

- 2020-12-31
- 1
RecBCD ( экзонуклеаза V, RecBC-дезоксирибонуклеаза ) — фермент бактерии Escherichia coli , инициирующий процесс гомологичной рекомбинации при репарации двух- и молекулы ДНК , возникающих в результате ионизирующего излучения , ошибок в процессе репликации , ошибок в работе эндонуклеаз или в результате окислительного стресса . RecBCD — это одновременно и хеликаза , раскручивающая двойную спираль ДНК, и нуклеаза , которая её разрезает .
RecBCD используется в методе , который используется для изучения взаимодействия белков с ДНК .
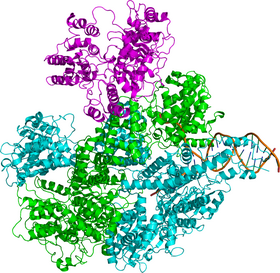
Структура
RecBCD представляет собой белковый комплекс , состоящий из трёх разных субъединиц : RecB, RecC и RecD. До обнаружения гена RecD комплекс был известен как RecBC. Каждая субъединица кодируется отдельным геном:
| Ген | Цепь | Белок | Функция |
|---|---|---|---|
| RecB | β | . | 3'→5' хеликаза, нуклеаза |
| RecC | γ | . | распознает (точку рекомбинации ) |
| RecD | α | . | 5'→3' хеликаза |
Функции

RecD и RecC — хеликазы, то есть работающие за счёт энергии АТФ молекулярные комплексы, расплетающие ДНК, или, в некоторых случаях, РНК , при этом RecB выполняет ещё и функцию нуклеазы . RecC, третья субъединица RecBCD-комплекса, распознает определённую последовательность в ДНК, а именно 5' -GCTGGTGG-3', известную как Chi-сайт, по которой происходит разрезание ДНК на этапе завершения рекомбинации. RecBCD необычен тем, что обе его хеликазы движутся вдоль цепи с разной скоростью , а также тем, что распознаёт конкретную последовательность ДНК (Chi-сайт) . RecBCD связывается с концом двухцепочечной ДНК и начинает расплетать её, при этом RecD движется от 5'-конца к 3'-концу, а RecB наоборот. В ходе движения за RecBCD остаются две расплетённые цепи ДНК, которые образуют петлю, а так как RecB движется медленнее, чем RecD, петля последнего растет быстрее; образовавшуюся структуру в виде RecBCD-комплекса, движущегося вдоль цепи с двумя петлями позади себя иногда, по причине внешнего сходства, называют «кроличьи уши» .
К косвенным функциям RecBCD можно отнести его роль при активации эффектора , защищающего бактериальную культуру от вирусного заражения .
Механизм действия

Во время раскручивания ДНК нуклеазная субъединица RecB может действовать по-разному, в зависимости от условий реакции, в частности, в зависимости от концентрации ионов Mg 2+ и АТФ. Если АТФ в избытке, фермент просто делает надрез на цепи, содержащей Chi-сайт . Раскручивание цепи продолжается и образуется 3'-хвост с Chi-сайтом, на который может садиться белок , способствующий внедрению этого хвоста в хромосому , которая будет матрицей для восстановления повреждённой цепи, и обмена с ней цепями . Опознающая Chi-сайт субъединица комплекса RecBCD не взаимодействует с другими последовательностями, и фермент вскоре распадается на субъединицы, оставаясь неактивным в течение часа или более . Если в избытке находятся ионы Mg 2+ , RecBCD, как эндонуклеаза , расщепляет обе нити ДНК, хотя 5'-конец расщепляется реже . Когда RecBCD встречает Chi-сайт, раскручивание останавливается и разрушение 3'-цепи замедляется . Продолжая расплетать ДНК, RecBCD сразу же разрезает противоположную цепь (то есть 5'-конец) и загружает белок RecA на 3’-конец. После завершения этого процесса на одной молекуле ДНК фермент повторяет его снова, быстро переходя на новую молекулу .
Хотя реакции не были проверены с помощью анализа ДНК в самих клетках ввиду их скоротечности, генетические данные показывают, что первая реакция более всего подобна тому, что происходит в клетке . Например, мутантный RecBCD, лишённый определяемой экспериментально экзонуклеазной активности, сохраняет высокую способность к разрезанию Chi-сайта во внеклеточных условиях . Chi-сайт на одной молекуле ДНК в клетках подавляет активность Chi-сайта на другой, что, возможно, отражает Chi-зависимую разборку RecBCD, которая наблюдается in vitro в условиях избытка АТФ и при наличии разрыва в ДНК в области Chi-сайта .
При обоих условиях реакции 3'-конец остается интактным после Chi-сайта, рядом с которым идет активная загрузка белка RecA на цепь ДНК. В какой-то неопределённый момент RecBCD распадается, хотя может расплести по крайней мере 60 тысяч пар оснований ДНК, оставаясь целым. RecA инициирует обмен нитями ДНК с идентичной или почти идентичной молекулой-матрицей; этот обмен создает структуру, известную как . Образовавшаяся структура из двух ДНК-дуплексов с перекрещенными нитями может быть разрешена двумя способами: либо внедренная в матричную молекулу 3'-нить с Chi-сайтом послужит праймером для начала синтеза ДНК, либо произойдет расщепление D-петли с образованием структуры Холлидея . В свою очередь, структура Холлидея разрешается комплексом или посредством белка RecG. Каждое из этих событий ведет к появлению целой ДНК, которая отличается от родительских новыми комбинациями генов. Этот процесс, известный как гомологичная рекомбинация , завершает репарацию двухцепочечного разрыва .
Примечания
- ↑ Smith G. R. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2012. — Vol. 76, no. 2 . — P. 217—228. — doi : . — .
- Spies M., Kowalczykowski S. C. Homologous recombination by RecBCD and RecF pathways // Bacterial Chromosomes (неопр.) / Higgins P.. — Washington, D.C: , 2003. — С. 389—403. — ISBN 1-55581-232-5 .
- Singleton M. R. , Dillingham M. S. , Gaudier M. , Kowalczykowski S. C. , Wigley D. B. (англ.) // Nature. — 2004. — Vol. 432, no. 7014 . — P. 187—193. — doi : . — .
- Bianco P. R. , Brewer L. R. , Corzett M. , Balhorn R. , Yeh Y. , Kowalczykowski S. C. , Baskin R. J. (англ.) // Nature. — 2001. — 18 January ( vol. 409 , no. 6818 ). — P. 374—378 . — doi : . — .
- Amundsen S. K. , Taylor A. F. , Chaudhury A. M. , Smith G. R. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1986. — August ( vol. 83 , no. 15 ). — P. 5558—5562 . — doi : . — .
- Yu M. , Souaya J. , Julin D. A. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1998. — 3 February ( vol. 95 , no. 3 ). — P. 981—986 . — doi : . — .
- Taylor A. F. , Smith G. R. (англ.) // Nature. — 2003. — Vol. 423, no. 6942 . — P. 889—893. — doi : . — .
- Taylor A. F. , Smith G. R. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1992. — 15 June ( vol. 89 , no. 12 ). — P. 5226—5230 . — doi : . — .
- Amundsen S. K. , Taylor A. F. , Reddy M. , Smith G. R. (англ.) // Genes & development. — 2007. — Vol. 21, no. 24 . — P. 3296—3307. — doi : . — .
- Taylor A. , Smith G. R. (англ.) // Cell. — 1980. — November ( vol. 22 , no. 2 Pt 2 ). — P. 447—457 . — .
- . Дата обращения: 23 ноября 2020. 23 ноября 2020 года.
- Taylor A. F. , Schultz D. W. , Ponticelli A. S. , Smith G. R. (англ.) // Cell. — 1985. — May ( vol. 41 , no. 1 ). — P. 153—163 . — .
- ↑ Anderson D. G. , Kowalczykowski S. C. (англ.) // Cell. — 1997. — 11 July ( vol. 90 , no. 1 ). — P. 77—86 . — .
- Taylor A. F. , Smith G. R. (англ.) // Genes & Development. — 1999. — 1 April ( vol. 13 , no. 7 ). — P. 890—900 . — .
- Dixon D. A. , Kowalczykowski S. C. (англ.) // Cell. — 1993. — 9 April ( vol. 73 , no. 1 ). — P. 87—96 . — .
- Spies M. , Amitani I. , Baskin R. J. , Kowalczykowski S. C. (англ.) // Cell. — 2007. — Vol. 131, no. 4 . — P. 694—705. — doi : . — .
- Taylor A. F. , Smith G. R. (англ.) // The Journal Of Biological Chemistry. — 1995. — 13 October ( vol. 270 , no. 41 ). — P. 24459—24467 . — .
- Anderson D. G. , Kowalczykowski S. C. (англ.) // Genes & Development. — 1997. — 1 March ( vol. 11 , no. 5 ). — P. 571—581 . — .
- Amundsen S. K. , Smith G. R. (англ.) // Genetics. — 2007. — January ( vol. 175 , no. 1 ). — P. 41—54 . — doi : . — .
- Köppen A. , Krobitsch S. , Thoms B. , Wackernagel W. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1995. — 3 July ( vol. 92 , no. 14 ). — P. 6249—6253 . — doi : . — .
- Myers R. S. , Kuzminov A. , Stahl F. W. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1995. — 3 July ( vol. 92 , no. 14 ). — P. 6244—6248 . — doi : . — .
- 2020-12-31
- 1