Interested Article - Фибрилляция предсердий

- 2021-07-29
- 1
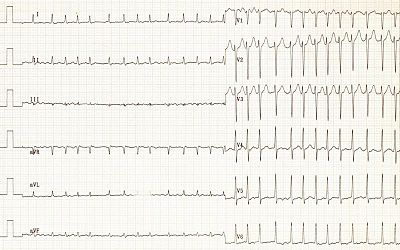
Фибрилля́ция предсе́рдий (ФП, синоним: мерцательная аритмия ) — разновидность наджелудочковой тахиаритмии с хаотической электрической активностью предсердий с частотой импульсов 350—700 в минуту, что исключает возможность их координированного сокращения . Это одна из наиболее распространённых аритмий . Часто ФП может быть обнаружена при определении пульса и обнаружении, что сердцебиения происходят с нерегулярным интервалом. Однако окончательный диагноз выставляется по ЭКГ -признакам: отсутствие зубцов P, которые присутствуют при нормальном ритме сердца и характеризуют электрическую активность при сокращении предсердий. Вместо них появляется множество волн f , которые характеризуют фибрилляцию (то есть мерцание, дрожание) предсердий.
Частота сокращений желудочков при мерцательной аритмии зависит от электрофизиологических свойств предсердно-желудочкового узла, уровня активности симпатической и парасимпатической нервной системы , а также действия лекарственных препаратов. Риск возникновения ФП увеличивается с возрастом. Данная аритмия нередко связана с органическими заболеваниями сердца. Нарушение гемодинамики и тромбоэмболические осложнения, связанные с фибрилляцией предсердий, приводят к значительному повышению заболеваемости , смертности и стоимости медицинского обслуживания. Хроническое течение ФП приводит к увеличению риска смерти примерно в 1,5—2 раза .
По данным на 2010 г. у 33 500 000 людей в мире была диагностирована эта аритмия. В 2015 году вышло Фремингемское исследование, где говорится, что за последние 50 лет распространенность ФП у мужчин увеличилась в 4,7 раз, у женщин в 3,6 раза. При этом фибрилляция предсердий является причиной развития около 25% ишемических инсультов, и её наличие у человека увеличивает в 5 раз частоту развития кардиоэмболического инсульта и системных тромбоэмболий .
Эпидемиология
Фибрилляция предсердий — одна из самых распространённых аритмий. Этим заболеванием страдают 1—2 % общей популяции, и этот показатель растёт в последние годы и вероятно будет увеличиваться в ближайшие 50 лет в связи со старением населения . Число больных ФП в США оценивают более чем в 2,2 миллиона человек, в странах Европейского союза — 4,5 миллиона . По данным фрамингемского исследования, риск развития ФП у мужчин и женщин старше 40 лет составляет 26 и 23 % соответственно . ФП выявляется примерно у 6—24 % пациентов с инсультом . Распространённость ФП также увеличивается с возрастом, составляя около 8 % у пациентов старше 80 лет .
Классификация
| Формы ФП | Характеристика |
|---|---|
| Впервые выявленная | впервые возникший эпизод ФП |
| Пароксизмальная | приступ длится не более 7 дней (обычно менее 48 ч) и спонтанно восстанавливается в синусовый ритм |
| Персистирующая | приступ длится более 7 дней |
| Длительная персистирующая | приступ длится более 1 года, но принято решение о восстановлении синусового ритма |
| Постоянная | длительно сохраняющаяся ФП (например, более 1 года), при которой кардиоверсия была неэффективна или не проводилась |
| Класс EHRA | Проявления |
|---|---|
| I | Нет симптомов |
| II | Лёгкие симптомы; обычная жизнедеятельность не нарушена |
| III | Выраженные симптомы; изменена повседневная активность |
| IV | Инвалидизирующие симптомы; нормальная повседневная активность невозможна |
В рекомендациях , Американской кардиологической ассоциации , (2010 года), а также Всероссийского научного общества кардиологов (2011 года) различают 5 типов ФП .
В зависимости от частоты сердечных сокращений различают тахи- (ЧСС > 90 в минуту), нормо- и брадисистолические (ЧСС < 60 в минуту) формы ФП .
Кроме того, Европейским обществом кардиологов в 2010 году предложена клиническая классификация EHRA ( European Heart Rhythm Association ) в зависимости от выраженности симптомов заболевания .
Факторы риска
Фибрилляция предсердий связана с различными сердечно-сосудистыми заболеваниями, которые способствуют развитию и поддержанию аритмии. К ним относятся :
- Артериальная гипертензия ;
- Сердечная недостаточность II—IV функционального класса по NYHA;
- Приобретённые пороки (чаще митральные) клапанов сердца;
- Врождённые пороки сердца ( дефект межпредсердной перегородки , единственный желудочек, операция Мастарда при транспозиции крупных артерий, операция Фонтейна);
- Кардиомиопатии (особенно дилатационная);
- Ишемическая болезнь сердца — встречается у 20 % больных с ФП;
- Воспаление ( перикардит , миокардит );
- Опухоль сердца ( , ангиосаркома ).
Около 30—45 % случаев пароксизмальной ФП и 20—25 % случаев персистирующей ФП возникают у молодых лиц без патологии сердца (изолированная форма ФП) .
Также существуют факторы риска, не связанные с патологией сердца. К ним относят гипертиреоидизм, ожирение , сахарный диабет , ХОБЛ , апноэ во сне , хроническая болезнь почек . Наличие ФП у близких родственников пациента в анамнезе может увеличить риск развития ФП . Исследование более чем 2200 пациентов с ФП показало, что 30 % из них имеют родителей с ФП . Различные генетические мутации могут быть ответственны за развитие ФП .
Минимальные количества алкоголя (порядка 10 грамм в день) ассоциированы с повышенным на 5% риском развития фибрилляции предсердий .
ФП также может развиваться при чрезмерном употреблении алкоголя ( синдром праздничного сердца ), хирургической операции на сердце, ударе электрического тока . При таких состояниях лечение основного заболевания часто приводит к нормализации ритма . Фактором риска ФП является ВИЧ-инфекция.
Патогенез
| Схема проведения импульсов | ||
Синусовый ритм

|
Фибрилляция предсердий

|
|
Органические заболевания сердца могут вызывать структурное ремоделирование предсердий и желудочков. В предсердиях этот процесс обусловлен пролиферацией и дифференцировкой фибробластов в миофибробласты , повышенным отложением соединительной ткани и фиброзом . Всё это приводит к электрической диссоциации мышечных пучков и неоднородности проведения, тем самым способствуя развитию и сохранению ФП .
Существует множество гипотез механизмов развития ФП, но наиболее распространены теория очаговых механизмов и гипотеза множественных мелких волн . Причём эти механизмы могут сочетаться друг с другом. Очаговые механизмы включают в себя триггерную активность и циркуляцию возбуждения по типу микрореентри (microreentry). Согласно данной теории, ФП возникает в результате поступления множества импульсов из автономных очагов, которые чаще всего расположены в устьях лёгочных вен или по задней стенке левого предсердия около соединения с лёгочной веной. Ткани в этих зонах обладают более коротким рефрактерным периодом , что приближает их по свойствам к клеткам синусового узла . По мере прогрессирования пароксизмальной формы в постоянную очаги повышенной активности распределяются по всем предсердиям. Согласно гипотезе множественных мелких волн, ФП сохраняется в результате хаотичного проведения множества независимых мелких волн .
Изменения в предсердиях происходят и после развития ФП. При этом укорачивается рефрактерный период предсердий за счёт подавления тока ионов кальция через каналы L-типа и усиления поступления ионов калия в клетки. Также снижается сократительная функция предсердий вследствие замедления поступления ионов кальция в клетки, нарушения выделения ионов кальция из внутриклеточных депо и нарушения обмена энергии в миофибриллах . Замедляется кровоток в предсердиях из-за нарушения их сокращения, что приводит к образованию тромбов преимущественно в ушке левого предсердия .
Клиническая картина
В зависимости от выраженности гемодинамических нарушений клиническая картина варьирует от бессимптомного течения до тяжёлых проявлений сердечной недостаточности. При пароксизмальной форме эпизоды фибрилляции предсердий иногда протекают бессимптомно . Но обычно больные ощущают учащённое сердцебиение, дискомфорт или боли в грудной клетке. Также возникает сердечная недостаточность, которая проявляется слабостью, головокружением , одышкой или даже предобморочными состояниями и обмороками . Приступ ФП может сопровождаться учащённым мочеиспусканием, что обусловлено повышенной выработкой предсердного натрийуретического пептида .
Пульс аритмичный, может возникать дефицит пульса (ЧСС на верхушке сердца больше, чем на запястье) вследствие того, что при частом желудочковом ритме ударный объём левого желудочка недостаточен для создания периферической венозной волны. У пациентов с бессимптомной ФП или с минимальными проявлениями ФП тромбоэмболия (чаще в виде инсульта ) может стать первым проявлением заболевания .
Диагностика

При наличии характерных жалоб собирают анамнез заболевания с целью определения его клинической формы (например, выясняют начало первого приступа или дату обнаружения), причины и факторов риска, эффективности антиаритмических препаратов для данного больного при предыдущих приступах .
Для диагностики ФП применяют стандартную ЭКГ в 12 отведениях. При этом обнаруживают следующие ЭКГ-признаки: отсутствие зубцов P, волны фибрилляции f с разной амплитудой и формой, абсолютно неодинаковые интервалы RR (комплексы QRS обычно не изменены) . Также по ЭКГ определяют ассоциированную патологию сердца (инфаркта миокарда в прошлом, других аритмий и др.) . При подозрении пароксизмальной формы и отсутствии ЭКГ во время приступа проводят холтеровское мониторирование .
Кроме того, выполняют эхокардиографию для выявления органической патологии сердца (например, патологии клапанов), размеров предсердий. Также этим методом определяют тромбы в ушках предсердий, однако для этого чреспищеводная Эхо-КГ информативнее трансторакальной . При впервые выявленной ФП, трудности контроля ритма желудочков или неожиданном рецидиве после оценивают функцию щитовидной железы (уровень тиреотропного гормона в сыворотке крови ) .
Осложнения
В норме сокращения предсердий способствуют наполнению желудочков кровью, что нарушается при ФП. Это не отражается на сердце без другой патологии, но у больных с уже сниженным объёмом наполнения желудочков сердечный выброс недостаточен. Поэтому заболевание может осложняться острой сердечной недостаточностью .
При фибрилляции предсердий в левом предсердии образуются тромбы , которые могут с током крови попадать в сосуды головного мозга, вызывая ишемический инсульт . Частота развития данного осложнения у пациентов с фибрилляцией предсердий неревматической этиологии в среднем составляет 6 % в год .
Лечение
В лечении ФП существует 2 типа стратегий:
- Стратегия контроля ритма — с помощью кардиоверсии восстанавливают нормальный синусовый ритм и затем проводят профилактику рецидивов;
- Стратегия контроля ЧСС — сохранение ФП с лекарственным урежением частоты сокращений желудочков.
Также для профилактики тромбоэмболий проводят антикоагулянтную терапию .
Антикоагулянтная терапия
| Фактор риска | Баллы | |
|---|---|---|
| C | C ongestive heart failure ( Хроническая сердечная недостаточность ) |
|
| H | H ypertension ( Артериальная гипертензия ) |
|
| A | A ge (Возраст) ≥ 75 лет |
|
| D | D iabetes mellitus Сахарный диабет |
|
| S 2 | S troke or TIA ( Инсульт или транзиторная ишемическая атака в анамнезе ) |
|
| Фактор риска | Баллы | |
|---|---|---|
| C | C ongestive heart failure or Left ventricular systolic dysfunction (Хроническая сердечная недостаточность или дисфункция левого желудочка) |
|
| H | H ypertension (Артериальная гипертензия) |
|
| A 2 | A ge (Возраст) ≥ 75 лет |
|
| D | D iabetes mellitus (Сахарный диабет) |
|
| S 2 | S troke or TIA or thromboembolism (Инсульт, или транзиторная ишемическая атака, или тромбоэмболия в анамнезе) |
|
| V | V ascular disease (Сосудистые заболевания, то есть заболевания периферических артерий, инфаркт миокарда , атеросклероз аорты) |
|
| A | A ge (Возраст) 65—74 года |
|
| Sc | S ex category (Женский пол) |
|
Антикоагулянтная терапия необходима для профилактики самого грозного осложнения ФП — тромбоэмболии. С этой целью применяют пероральные антикоагулянты ( варфарин , ривароксабан (Ксарелто) , апиксабан , дабигатран ) или ацетилсалициловую кислоту (или клопидогрел ). Показания для антикоагуляции и выбор препарата определяются риском тромбоэмболии, который рассчитывают по шкалам CHADS 2 или CHA 2 DS 2 -VASc . Если сумма баллов по шкале CHADS 2 ≥ 2, то при отсутствии противопоказаний показана длительная терапия пероральными антикоагулянтами (например, варфарином с поддержанием МНО 2-3 или новыми оральными антикоагулянтами). Если сумма баллов по шкале CHADS 2 0—1, рекомендуют более точно оценить риск тромбоэмболии по шкале CHA 2 DS 2 -VASc . При этом, если ≥ 2 баллов, — назначают пероральные непрямые антикоагулянты, 1 балл — пероральные непрямые антикоагулянты (предпочтительно) или ацетилсалициловую кислоту 75—325 мг в сутки, 0 баллов — антикоагулянтная терапия не требуется (предпочтительно) либо ацетилсалициловая кислота в той же дозе.
Однако антикоагулянтная терапия опасна кровотечениями. Для оценки риска данного осложнения разработана шкала HAS-BLED . Сумма баллов ≥ 3 указывает на высокий риск кровотечения, и применение любого антитромботического препарата требует особой осторожности .
| Клиническая характеристика | Баллы | |
|---|---|---|
| H | H ypertension ( Артериальная гипертензия ) |
|
| A | A bnormal renal/liver function (Нарушение функции печени или почек — по 1 баллу) |
|
| S | S troke (Инсульт в анамнезе) |
|
| B | B leeding history or predisposition (Кровотечение в анамнезе или склонность к нему) |
|
| L | L abile INR (Лабильное МНО) |
|
| E | E lderly (Возраст >65 лет) |
|
| D | D rugs/alcohol concomitantly (Прием некоторых лекарств/алкоголя — по 1 баллу) |
|
Стратегия контроля ритма
Восстановление синусового ритма осуществляют с помощью электрического разряда (электрическая кардиоверсия) или антиаритмических препаратов (фармакологическая кардиоверсия) . Предварительно при тахисистолической форме урежают ЧСС до примерно 80—100 в минуту пероральным приёмом β-адреноблокаторов ( метопролол ) или недигидропиридоновых антагонистов кальция ( верапамил ). Известно, что кардиоверсия повышает риск тромбоэмболии. Поэтому перед плановой кардиоверсией, если ФП длится более 48 часов или продолжительность неизвестна, обязательно проводят антикоагулянтную терапию варфарином в течение трёх недель и в течение четырёх недель после процедуры . Неотложную кардиоверсию проводят, если ФП длится менее 48 часов или сопровождается тяжёлыми гемодинамическими нарушениями ( гипотония , декомпенсация сердечной недостаточности ), лишь под прикрытием нефракционированного или низкомолекулярного гепарина .
Электрическая кардиоверсия
Электрическая кардиоверсия эффективнее фармакологической, однако болезненна и поэтому требует введения седативных препаратов (например, пропофол , мидазолам ) или поверхностной общей анестезии . В современных кардиовертерах-дефибрилляторах разряд автоматически синхронизируется с зубцом R, чтобы не допустить электрической стимуляции в фазе желудочковой реполяризации, что может спровоцировать фибрилляцию желудочков . При двухфазном разряде начинают со 100 Дж , при необходимости силу каждого следующего разряда повышают на 50 Дж. Однофазный разряд требует в 2 раза больше энергии, то есть начинают с 200 Дж, с последующим увеличением на 100 Дж, пока не будет достигнут максимальный уровень 400 Дж. Таким образом, двухфазный импульс имеет преимущества, так как эффект достигается при меньшей энергии .
Фармакологическая кардиоверсия
Для фармакологической кардиоверсии применяют антиаритмические препараты IA, IC и III классов. К ним относят прокаинамид , амиодарон , пропафенон , нитрофенилдиэтиламинопентилбензамид (нибентан) .
Прокаинамид выпускают в ампулах по 5 мл, содержащих 500 мг препарата (10 % раствор). Его вводят струйно или капельно в дозе 500—1000 мг однократно внутривенно медленно (в течение 8—10 мин или 20—30 мг/мин). В Европейских рекомендациях 2010 года исключён из списка препаратов для кардиоверсии. Однако в Российской Федерации благодаря невысокой стоимости он весьма распространён. К побочным эффектам прокаинамида относят артериальную гипотензию , слабость, головную боль , головокружение , диспепсию , депрессию , бессонницу , галлюцинации , агранулоцитоз , эозинофилию , волчаночноподобный синдром .
Пропафенон выпускают в ампулах по 10 мл, содержащих 35 мг препарата, и в таблетках по 150 и 300 мг. Вводят в дозе 2 мг/кг внутривенно в течение 10 мин (ожидаемый эффект от 30 мин до 2 ч) или перорально в дозе 450—600 мг (ожидаемый эффект через 2—6 ч). Препарат малоэффективен при персистирующей форме ФП и трепетании предсердий. Не следует использовать у пациентов со сниженной сократительной способностью левого желудочка и ишемией миокарда. Вследствие наличия слабого β-блокирующего действия противопоказан пациентам с выраженной ХОБЛ .
Амиодарон выпускают в ампулах по 3 мл, содержащих 150 мг препарата (5 % раствор). Его вводят внутривенно струйно в дозе 5 мг/кг в течение 15 мин, затем продолжают капельно в дозе 50 мг/ч в течение 24 ч. Восстанавливает синусовый ритм медленно, его максимальный эффект — через 2—6 часов. Амиодарон рекомендуют использовать у пациентов с органическими заболеваниями сердца .
Нибентан выпускают в ампулах по 2 мл, содержащих 20 мг препарата (1 % раствор). Вводят внутривенно в дозе 0,065—0,125 мг/кг в течение 3—5 минут. При отсутствии эффекта — повторные инфузии в той же дозе с интервалом 15 мин (до максимальной дозы 0,25 мг/кг). Его применение допускается только в палатах интенсивной терапии с мониторированием ЭКГ в течение 24 часов после введения, так как возможно развитие проаритмических эффектов в виде полиморфной желудочковой тахикардии типа «пируэт», а также удлинение интервала QT с появлением зубца U .
Длительный контроль ритма
С целью предупреждения рецидивов ФП в некоторых случаях назначают антиаритмические препараты на длительный срок. Однако их эффективность для контроля синусового ритма невысока, а побочные эффекты весьма опасные, поэтому выбор конкретного препарата определяется его безопасностью . Для этого применяют амиодарон, соталол , диэтиламинопропионилэтоксикарбониламинофенотиазин (этацизин), дронедарон, лаппаконитина гидробромид (аллапинин), (этмозин), пропафенон .
Стратегия контроля частоты сердечных сокращений
При выборе стратегии контроля частоты сердечных сокращений попытки восстановить нормальный ритм сердца не предпринимают. Вместо этого используют различные группы препаратов, способные уменьшать ЧСС: бета-блокаторы (метопролол, карведилол и др.), недигидропиридиновые блокаторы кальциевых каналов ( верапамил и дилтиазем ), дигоксин . При их неэффективности возможно назначение амиодарона или . Контроль ЧСС позволяет уменьшить выраженность симптомов аритмии, однако не останавливает процесс прогрессирования заболевания .
Целью данной стратегии является удержание ЧСС в покое <110 в мин. В случае выраженных симптомов заболевания возможен более жёсткий контроль — ЧСС в покое <80 в мин и <110 при умеренной физической нагрузке .
Катетерная абляция
При неэффективности вышеописанных методов лечения иногда применяют катетерную абляцию . С целью восстановления и поддержания синусового ритма проводят радиочастотную абляцию .
Катетерную РЧА обычно проводят больным с пароксизмальной фибрилляцией предсердий, которая резистентна по крайней мере к одному антиаритмическому препарату. Подобная практика обосновывается результатами многочисленных исследований, в которых абляция приводила к улучшению контроля ритма сердца по сравнению с антиаритмическими средствами .
При этом выполняют электрическую изоляцию триггерных участков из устьев лёгочных вен от окружающей ткани левого предсердия. Для выполнения данной процедуры в устья легочных вен вводят циркулярный диагностический катетер, а с помощью так называемого «орошаемого» абляционного электрода производится циркулярная абляция в области «антрума» легочных вен.
При манипуляции катетером врачу требуется визуализация его положения в левом предсердии по отношению к другим структурам. Ранее хирургам был доступен только рентгеноскопический метод визуализации катетеров .
Определение пространственного расположения зон сердца, из которых ведется регистрация электрограмм, с помощью рентгена страдает большой погрешностью и связана с большой дозой рентгеновского облучения, как пациента, так и медперсонала (рентгеновское излучение является ионизирующим ) .
Современные технологии электроанатомического картирования, которые объединяют анатомическую и электрофизиологическую информацию, позволяют хирургам создать трехмерную карту интересующей камеры сердца. Возможность управления катетером без помощи рентгена значительно уменьшает время рентгеновского облучения и общее время процедуры .
Также существует метод абляции атриовентрикулярного узла: радиочастотным током разрушают АВ-узел или пучок Гиса, вызывая полную поперечную блокаду. Затем имплантируют искусственный водитель ритма, который «навязывает» сердечный ритм, близкий по характеристикам к нормальному. Это паллиативное вмешательство, которое улучшает качество жизни больного, но на смертность не влияет .
Фибрилляция предсердий после операций на сердце
Фибрилляция предсердий — одно из самых частых осложнений после кардиохирургических операций , встречается у 10-60% (в зависимости от возраста) больных . Патогенез послеоперационной ФП несколько отличается от ФП, которая возникает у неоперированных больных. Помимо обычных факторов риска развития ФП, после операций на сердце (особенно с использованием искусственного кровообращения) важна роль ионных нарушений (особенно низкий уровень калия), объемный дисбаланс, хирургическая травма и отек стенки предсердий, активация системы комплемента, высвобождение провоспалительных цитокинов, симпатическая стимуляция и окислительный стресс, а также перикардиальный выпот, который может выступать в качестве триггера ФП. Лечение послеоперационной ФП начинают с коррекции соответствующих нарушений. Для медикаментозной профилактики послеоперационной ФП в предоперационном периоде применяют бета-блокаторы, амиодарон, нестероидные противовоспалительные средства и даже преднизолон. В качестве хирургической профилактики ФП в своё время была предложена методика задней перикардиотомии, которую выполняют во время основной операции с целью уменьшить перикардиальный выпот в послеоперационном периоде и таким образом устранить фактор риска ФП .
Прогноз
Прогноз определяется в первую очередь тяжестью патологии сердца, лежащей в основе ФП. Риск развития ишемического инсульта, связанный с ФП, составляет 1,5 % у лиц 50—59 лет и 23,5 % у лиц 80—89 лет или в среднем 5 % в год . Таким образом, фибрилляция предсердий увеличивает риск развития инсульта примерно в 5 раз и в 2 раза риск смерти . Каждый шестой инсульт происходит у больного ФП. При развитии ФП у лиц с ревматическими пороками сердца риск инсульта возрастает в 5 раз по сравнению с больными с неклапанной ФП и в 17 раз по сравнению с лицами без ФП .
Научные мероприятия
- Всероссийский Съезд аритмологов (проводится один раз в 2 года с 2005 г.).
- Международный славянский Конгресс по электростимуляции и клинической электрофизиологии сердца «Кардиостим» (проводится один раз в 2 года с 1993 г.).
- Научно-практическая конференция с международным участием "Актуальные вопросы диагностики и лечения фибрилляции предсердий" (проводится ежегодно с 2012 г.).
Примечания
- (англ.) — 2016.
- Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018.
- / Богословский В. А. // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский . — 3-е изд. — М. : Советская энциклопедия , 1981. — Т. 15 : Меланома — Мудров. — 576 с. : ил.
- ↑ А. В. Струтынский. . — М. : МЕДпресс-информ, 2009. — С. 120—123. — 224 с. — 10 000 экз. — ISBN 5-98322-542-1 . 6 марта 2016 года.
- Wyndham CRC. (неопр.) // Texas Heart Institute Journal. — 2000. — Т. 27 , № 3 . — С. 257—267 . — . — PMC . 19 апреля 2022 года.
- Benjamin E.J., Wolf P.A., D'Agostino R.B., Silbershatz H., Kannel W.B., Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study (англ.) // : journal. — , 1998. — Vol. 98 , no. 10 . — P. 946—952 . — .
- Wattigney W.A., Mensah G.A., Croft J.B. Increased atrial fibrillation mortality: United States, 1980-1998 (англ.) // : journal. — 2002. — Vol. 155 , no. 9 . — P. 819—826 . — doi : . — .
- Е. И. Баранова. . Российский кардиологический журнал (24 ноября 2018). Дата обращения: 16 сентября 2020. 10 февраля 2020 года.
- Friberg J., Buch P., Scharling H., Gadsbphioll N., Jensen G.B. (англ.) // Epidemiology : journal. — 2003. — November ( vol. 14 , no. 6 ). — P. 666—672 . — doi : . — . 1 августа 2017 года.
- Go A.S., Hylek E.M., Phillips K.A., et al. (англ.) // JAMA : journal. — 2001. — May ( vol. 285 , no. 18 ). — P. 2370—2375 . — . (недоступная ссылка)
- Go AS; Hylek EM; Phillips KA; Chang, Y; Henault, LE; Selby, JV; Singer, D.E. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study (англ.) // JAMA : journal. — 2001. — Vol. 285 , no. 18 . — P. 2370—2375 . — doi : . — .
- ↑ MD, Peter Rubin; Robert I. Simon MD; Douglas L. Mann MD FACC; Douglas S. Fenton M. D. Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine, 2-Volume Set: Expert Consult Premium Edition - Enhanced Online Features and Print (англ.) . — Philadelphia: Saunders, 2011. — ISBN 1-4377-2708-5 .
- ↑ Lloyd-Jones D.M., Wang T.J., Leip E.P., et al. (англ.) // : journal. — , 2004. — August ( vol. 110 , no. 9 ). — P. 1042—1046 . — doi : . — .
- Narumiya T., Sakamaki T., Sato Y., Kanmatsuse K. Relationship between left atrial appendage function and left atrial thrombus in patients with nonvalvular chronic atrial fibrillation and atrial flutter (англ.) // Circulation Journal : journal. — 2003. — January ( vol. 67 , no. 1 ). — P. 68—72 . — doi : . — .
- Furberg C.D., Psaty B.M., Manolio T.A., Gardin J.M., Smith V.E., Rautaharju P.M. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study) (англ.) // : journal. — 1994. — August ( vol. 74 , no. 3 ). — P. 236—241 . — .
- ↑ Camm A.J., Kirchhof P., Lip G.Y., et al. (англ.) // : journal. — 2010. — October ( vol. 31 , no. 19 ). — P. 2369—2429 . — doi : . — .
- ↑ Беленков Ю.Н., Оганов Р.Г. Кардиология. Национальное руководство. — Москва: ГЭОТАР-Медиа, 2010. — 1286 с. — (Национальные руководства). — 2000 экз. — ISBN 978-5-9704-1734-8 .
- Kirchhof P., Auricchio A., Bax J., et al. (англ.) // : journal. — 2007. — November ( vol. 9 , no. 11 ). — P. 1006—1023 . — doi : . — .
- Lévy S., Maarek M., Coumel P., Guize L., Lekieffre J., Medvedowsky J.L., Sebaoun A. Characterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiologists (англ.) // : journal. — , 1999. — P. 3028—3035 . — .
- Frost L., Hune L.J., Vestergaard P. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study (англ.) // : journal. — 2005. — Vol. 118 , no. 5 . — P. 489—495 . — .
- Gami A.S., Hodge D.O., Herges R.M., et al. (англ.) // : journal. — 2007. — February ( vol. 49 , no. 5 ). — P. 565—571 . — doi : . — . 30 августа 2017 года.
- Fox C.S., Parise H., D'Agostino R.B., et al. (англ.) // JAMA : journal. — 2004. — June ( vol. 291 , no. 23 ). — P. 2851—2855 . — doi : . — . (недоступная ссылка)
- Fox C.S., Parise H., D'Agostino R.B., et al. Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring (англ.) // JAMA : journal. — 2004. — Vol. 291 , no. 23 . — P. 2851—2855 . — doi : . — .
- Saffitz J.E. Connexins, conduction, and atrial fibrillation (англ.) // The New England Journal of Medicine . — 2006. — Vol. 354 , no. 25 . — P. 2712—2714 . — doi : . — .
- . The National Center for Biotechnology Information. Дата обращения: 24 августа 2010. 16 июня 2013 года.
- от 16 сентября 2016 на Wayback Machine от 15 сентября 2016 на Wayback Machine от 19 сентября 2016 на Wayback Machine
- ↑ Марк Х. Бирс. = The Merck Manual. — Москва: Литтерра, 2011. — С. 909—913. — 3698 с. — ISBN 978-5-904090-37-1 . 8 июня 2011 года.
- Hsu J.C. Atrial Fibrillation and Atrial Flutter in HIV-Infected Persons: Incidence, Risk Factors, and Association with Markers of HIV Disease Severity (англ.) // : journal. — 2013. — doi : . — .
- Nakao K., Seto S., Ueyama C., et al. Extended distribution of prolonged and fractionated right atrial electrograms predicts development of chronic atrial fibrillation in patients with idiopathic paroxysmal atrial fibrillation (англ.) // : journal. — 2002. — October ( vol. 13 , no. 10 ). — P. 996—1002 . — .
- ↑ Сулимов В. А. и др. . — Москва, 2011. 14 ноября 2014 года.
- Page R.L., Wilkinson W.E., Clair W.K., McCarthy E.A., Pritchett E.L. (англ.) // : journal. — , 1994. — January ( vol. 89 , no. 1 ). — P. 224—227 . — .
- ↑ Л. А. Бокерия, А. Ш. Ревишвили и др. Рекомендации по лечению больных с нарушениями ритма сердца. — 2005. — С. 181—237. — 237 с.
- ↑ Пол Л. Марино. = The ICU Book. — Москва: ГЭОТАР-Медиа, 2010. — С. 261—266. — 770 с. — 2000 экз. — ISBN 978-5-9704-1399-9 . 4 марта 2016 года.
- Olesen J.B., Lip G.Y., Hansen M.L., et al. (англ.) // The BMJ : journal. — 2011. — Vol. 342 . — P. d124 . — . — PMC .
- Pisters R., Lane D.A., Nieuwlaat R., de Vos C.B., Crijns H.J., Lip G.Y. (англ.) // Chest : journal. — 2010. — November ( vol. 138 , no. 5 ). — P. 1093—1100 . — doi : . — . (недоступная ссылка)
- Lip G.Y. (англ.) // : journal. — 2011. — February ( vol. 124 , no. 2 ). — P. 111—114 . — doi : . — . 30 августа 2017 года.
- Singer D. E. , Albers G. W. , Dalen J. E. , Fang M. C. , Go A. S. , Halperin J. L. , Lip GYH , Manning W. J. (англ.) // Chest. — 2008. — June ( vol. 133 , no. 6 Suppl ). — P. 546—592 . — doi : . — .
- ↑ Шилов А.М., Мельник М.В., Осия А.О., Свиридова А.Ю., Мельник Н.В. . — РМЖ. 4 марта 2012 года.
- Lafuente-Lafuente C., Mouly S., Longas-Tejero M.A., Bergmann J.F. (англ.) // Cochrane Database of Systematic Reviews : journal. — 2007. — No. 4 . — P. CD005049 . — doi : . — .
- Сергей Багненко, А. Верткина, А. Мирошниченко, М. Хубутин. Руководство по скорой медицинской помощи. Глава 3. — ГЭОТАР-Медиа, 2010. — 816 с. — 5000 экз. — ISBN 978-5-9704-1733-1 .
- Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА). // новая редакция для обсуждения. — 2017. — С. 339—344 . 2 сентября 2021 года.
- . Дата обращения: 15 мая 2018. 15 мая 2018 года.
- . Дата обращения: 8 ноября 2017. 8 ноября 2017 года.
- . Дата обращения: 15 мая 2018. Архивировано из 24 августа 2018 года.
- . Дата обращения: 15 мая 2018. 15 мая 2018 года.
- Maesen B. , Nijs J. , Maessen J. , Allessie M. , Schotten U. (англ.) // Europace : European Pacing, Arrhythmias, And Cardiac Electrophysiology : Journal Of The Working Groups On Cardiac Pacing, Arrhythmias, And Cardiac Cellular Electrophysiology Of The European Society Of Cardiology. — 2012. — February ( vol. 14 , no. 2 ). — P. 159—174 . — doi : . — .
- Creswell L. L. , Schuessler R. B. , Rosenbloom M. , Cox J. L. (англ.) // The Annals Of Thoracic Surgery. — 1993. — September ( vol. 56 , no. 3 ). — P. 539—549 . — doi : . — .
- . Дата обращения: 1 мая 2013. Архивировано из 4 марта 2016 года.
- Lloyd-Jones D., Adams R., Carnethon M., et al. (англ.) // : journal. — , 2009. — January ( vol. 119 , no. 3 ). — P. 480—486 . — doi : . — .
- . Дата обращения: 18 января 2015. Архивировано из 13 июля 2015 года.
- . Дата обращения: 18 января 2015. 13 июля 2015 года.
- . Дата обращения: 18 января 2015. 14 июля 2015 года.
Ссылки
- (рус) информация для врачей
- 2021-07-29
- 1