Бромид свинца(II)
— бинарное неорганическое соединение, соль металла
свинца
и
бромистоводородной кислоты
с формулой PbBr
2
, прозрачные кристаллы, слабо растворимые в воде, образует
кристаллогидрат
.
Получение
-
Действие брома на металлический свинец:
-
-

-
-

-

-

-
-

Физические свойства
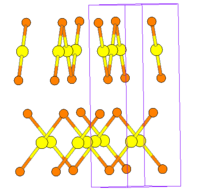
Бромид свинца(II) образует прозрачные кристаллы
ромбической сингонии
,
пространственная группа
P nam
, параметры ячейки
a
= 0,8051 нм,
b
= 0,9537 нм,
c
= 0,4726 нм, Z = 4.
При охлаждении водных растворов выделяется кристаллогидрат PbBr
2
•3H
2
O.
Диамагнитен
, плохо растворяется в воде и
этаноле
на холоду.
Химические свойства
-
В горячих водных растворах подвергается
гидролизу
до основной соли:
-
-

-
При нагревании на воздухе образует оксибромиды:
-
-

-
-
![{\displaystyle {\mathsf {PbBr_{2}+2KBr\ {\xrightarrow {}}\ K_{2}[PbBr_{4}]}}}](/images/000/427/427743/11.jpg?rand=188535)
-
-

-
![{\displaystyle {\mathsf {PbBr_{2}+4NaOH\ {\xrightarrow {}}\ Na_{2}[Pb(OH)_{4}]+2NaBr}}}](/images/000/427/427743/13.jpg?rand=126815)
-
Восстанавливается водородом:
-
-

-
Вступает в обменные реакции:
-
-

-

-
-

Литература
-
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. —
М.
: Советская энциклопедия, 1995. — Т. 4. — 639 с. —
ISBN 5-82270-092-4
.
-
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. —
М.
—
Л.
: Химия, 1966. — Т. 1. — 1072 с.
-
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. —
Л.
: Химия, 1971. — Т. 2. — 1168 с.
-
Рипан Р., Четяну И.
Неорганическая химия. Химия металлов. —
М.
: Мир, 1971. — Т. 1. — 561 с.








![{\displaystyle {\mathsf {PbBr_{2}+2KBr\ {\xrightarrow {}}\ K_{2}[PbBr_{4}]}}}](/images/000/427/427743/11.jpg?rand=188535)

![{\displaystyle {\mathsf {PbBr_{2}+4NaOH\ {\xrightarrow {}}\ Na_{2}[Pb(OH)_{4}]+2NaBr}}}](/images/000/427/427743/13.jpg?rand=126815)