Ионный двигатель
- 1 year ago
- 0
- 0

Ионный транспортёр — трансмембранный белок , который перемещает ионы (или небольшие молекулы) через биологическую мембрану для выполнения множества различных биологических функций, включая клеточную связь, поддержание гомеостаза, производство энергии и т. д. Существуют разные типы транспортёров, включая насосы, унипортёры, антипортёры и симпортёры. Активные транспортёры или ионные насосы — это переносчики, которые преобразуют энергию из различных источников, включая аденозинтрифосфат (АТФ), солнечный свет и другие окислительно-восстановительные реакции , в потенциальную энергию , двигая ион вверх по градиенту его концентрации . Эта потенциальная энергия может затем использоваться вторичными транспортёрами, включая транспортёры ионов и ионные каналы , для управления жизненно важными клеточными процессами, такими как синтез АТФ .
Эта статья посвящена в основном ионным транспортёрам, действующим как насосы, но транспортёры также могут перемещать молекулы посредством облегчённой диффузии. не требует АТФ и позволяет молекулам, которые не могут быстро диффундировать через мембрану ( пассивная диффузия ), диффундировать вниз по градиенту их концентрации через эти переносчики белка. Ионные транспортёры необходимы для правильного функционирования клетки, поэтому они изучаются исследователями с использованием различных методов. Ниже приведены некоторые примеры клеточной регуляции и методов исследования .
Суперсемейство ионных транспортёров включает в себя 12 семейств . Это разделение по семействам являются частью системы транспортной классификации (ТК), которая используется ; белки сгруппированы по таким характеристикам, как транспортируемые субстраты, механизм переноса, используемый источник энергии и также путем сравнения последовательностей аминокислот, составляющих каждый белок. Наиболее важным объединяющим фактором является заряженная природа субстрата, которая указывает на перенос иона, а не нейтральных частиц . Переносчики ионов существенно отличаются от ионных каналов: каналы — это поры, которые проходят через мембрану, тогда как транспортёры — это белки, которые должны менять форму, чтобы открыться, из-за этого транспортёры перемещают молекулы намного медленнее, чем это делают каналы.
Электрохимический градиент, или градиент концентрации — это разница в концентрации химической молекулы или иона в двух отдельных областях. В состоянии равновесия концентрации ионов в обеих областях будут равны, поэтому, если есть разница в концентрации, ионы будут стремиться течь «вниз» по градиенту концентрации — то есть от высокой концентрации к низкой. Ионные каналы позволяют определённым ионам, которые войдут в канал, течь вниз по градиенту их концентрации, выравнивая концентрации по обе стороны от клеточной мембраны. Ионные каналы и переносчики ионов достигают этого за счет облегчённой диффузии, которая является одним из видов пассивного транспорта. Однако только ионные транспортёры могут также осуществлять активный транспорт , который включает перемещение ионов против градиента их концентрации, используя такие источники энергии, как АТФ. Затем эти ионы могут использоваться вторичными транспортёрами или другими белками в качестве источника энергии .
Первичные транспортёры используют энергию для переноса ионов, таких как Na + , K + и Ca 2+ , через клеточную мембрану, и могут создавать градиенты концентрации. Этот транспорт может использовать АТФ в качестве источника энергии, или его можно использовать для генерации АТФ с помощью таких методов, как цепь переноса электронов в растениях .
Транспортёры, использующие АТФ, преобразуют энергию АТФ в потенциальную энергию в виде градиента концентрации. Они используют АТФ для переноса иона из области низкой концентрации в область более высокой. Примерами белков, использующих АТФ, являются: АТФазы P-типа, которые переносят ионы Na + , K + и Ca 2+ путем фосфорилирования ; АТФазы A-типа, переносящие анионы; ABC-транспортёры (переносчики кассет, связывающих АТФ), которые транспортируют широкий набор молекул. Примеры АТФазы P-типа включают Na + /K + -АТФазу , которая регулируется , Ca 2+ , АТФазу, а также Ca 2+ -АТФазу, которая проявляет чувствительность к концентрациям АДФ и АТФ. P-гликопротеин является примером ABC-транспорта, связывающего белки в организме человека.
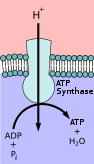
Транспортёры, продуцирующие АТФ, работают в противоположном направлении по отношению к транспортёрам, использующим АТФ. Эти белки переносят ионы от высокой к низкой концентрации, но в процессе образуется АТФ. Таким образом, потенциальная энергия в виде градиента концентрации используется для выработки АТФ. У животных этот синтез АТФ происходит в митохондриях с использованием АТФазы F-типа , иначе известной как АТФ-синтаза . Этот процесс использует цепь переноса электронов в процессе, называемом окислительным фосфорилированием . АТФаза V-типа выполняет функцию, противоположную АТФазе F-типа, и используется в растениях для гидролиза АТФ для создания протонного градиента. Примерами этого являются лизосомы, которые используют АТФазу V-типа для подкисления пузырьков или вакуолей растений во время процесса фотосинтеза в хлоропластах. Этот процесс можно регулировать с помощью различных методов, например, pH .

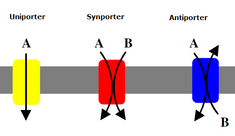
Вторичные транспортёры также переносят ионы (или небольшие молекулы) против градиента концентрации — от низкой концентрации к высокой, но, в отличие от первичных транспортёров, которые используют АТФ для создания градиента концентрации, они используют потенциальную энергию из градиента концентрации, создаваемого первичными транспортёрами, для транспортировки ионов. Например, натрийзависимый переносчик глюкозы, обнаруженный в тонком кишечнике и почках, использует градиент натрия, создаваемый в клетке натрий-калиевым насосом (как упоминалось выше), чтобы переносить глюкозу в клетку. Это происходит, когда натрий течет вниз по градиенту концентрации, обеспечивающему достаточно энергии, чтобы подтолкнуть глюкозу вверх по градиенту концентрации обратно в клетку. Это важно для тонкого кишечника и почек, чтобы предотвратить потерю глюкозы. Симпортёры , такие как натрий-глюкозный симпортёр, переносят ион с градиентом его концентрации, и они связывают транспорт второй молекулы в том же направлении. Антипортёры также используют градиент концентрации одной молекулы для перемещения другой вверх по градиенту концентрации, но связанная молекула транспортируется в противоположном направлении .
Активность ионных транспортёров может регулироваться различными способами, такими как фосфорилирование, аллостерическое ингибирование или активация. Использование протеинкиназ для добавления фосфатной группы или фосфатаз для дефосфорилирования белка может изменить активность транспортёра . Будет ли белок активирован или ингибирован добавлением фосфатной группы, зависит от конкретного белка. При аллостерическом ингибировании регуляторный лиганд может связываться с регуляторным сайтом и либо ингибировать, либо активировать транспортёр. Ионные транспортёры также могут регулироваться изменением концентрации ионов (не обязательно тех, которые он переносит) в растворе. Например, цепь переноса электронов регулируется наличием ионов H + (pH) в растворе .
Метод локальной фиксации потенциала — это электрофизиологический метод, используемый для изучения каналов и переносчиков в клетках путем отслеживания протекающего через них тока. Этот метод был разработан Ходжкином и Хаксли до того, как стало известно о существовании каналов и транспортёров .
Рентгеноструктурный анализ — удобный инструмент, который позволяет визуализировать структуру белков, однако это всего лишь снимок конформации одного белка. Структура транспортных белков позволяет исследователям лучше понять, как и что транспортёр делает для перемещения молекул через мембрану .
Этот метод используется для отслеживания диффузии липидов или белков в мембране. Полезен для лучшего понимания подвижности транспортёров в клетке и её взаимодействия с липидными доменами и липидными рафтами в клеточной мембране.
Метод, в котором флуоресценция используется для отслеживания расстояния между двумя белками. Используется для изучения взаимодействия транспортёров с другими клеточными белками .
| Ионные транспортёры |
|---|
| ГАМК-транспортёры |
| Равновесные нуклеозидные транспортёры |
| Натрий-кальциевый обменник |