Interested Article - Хлорид титана(II)

- 2020-09-20
- 1
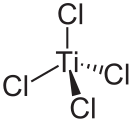
Хлорид титана(II) — неорганическое соединение, соль металла титана и соляной кислоты с формулой TiCl 2 , чёрные кристаллы, реагирует с водой, окисляется на воздухе.
Получение
- Разложение нагреванием хлорида титана(III) :
- Восстановление титаном хлорида титана(III) :
- Восстановление титаном хлорида титана(IV) :
Физические свойства
Хлорид титана(II) образует чёрные кристаллы тригональной сингонии , пространственная группа P 3 m , параметры ячейки a = 0,3568 нм, c = 0,5887 нм, Z = 1.
При комнатной температуре реагирует с водой, метанолом , этанолом . Окисляется кислородом воздуха, поэтому дихлорид титана следует хранить в атмосфере водорода или диоксида углерода .
Растворяется при 0°С в воде, этаноле . Плохо растворяется в сероуглероде , хлороформе , диэтиловом эфире .
С жидким аммиаком образует серый порошок состава [Ti(NH 3 ) 4 ]Cl 2 .
Химические свойства
- Разлагается ( диспропорционирует ) при нагревании в вакууме :
- Реагирует с водой:
- Реагирует с кислотами :
- Реагирует с щелочами на холоде в инертной атмосфере:
- При комнатной температуре на воздухе реакция идёт иначе:
- Окисляется кислородом воздуха:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4 .
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М. — Л. : Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1972. — Т. 2. — 871 с.
- 2020-09-20
- 1




![{\displaystyle {\mathsf {2TiCl_{2}+12H_{2}O\ {\xrightarrow {\tau }}\ 2[Ti(H_{2}O)_{5}(OH)]Cl_{2}+H_{2}\uparrow }}}](/images/000/551/551766/6.jpg?rand=963566)