Кремниевые кислоты
- 1 year ago
- 0
- 0

Кисло́ты — химические соединения , способные отдавать катион водорода (кислоты Брёнстеда ), либо соединения, способные принимать электронную пару с образованием ковалентной связи ( кислоты Льюиса ) .
В быту и технике под кислотами обычно подразумеваются кислоты Брёнстеда, образующие в водных растворах избыток ионов гидроксония H 3 O + . Присутствие этих ионов обуславливает кислый вкус растворов кислот, способность менять окраску индикаторов и, в высоких концентрациях, вызывать раздражающее действие. Подвижные атомы водорода кислот способны замещаться на атомы металлов с образованием солей , содержащих катионы металлов и анионы кислотного остатка .

Кислоты как класс химических соединений, обладающих рядом близких свойств, известны с древнейших времён.
В 1778 году французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в их составе кислорода . Эта гипотеза оказалась несостоятельной, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу . В 1833 году немецкий химик Юстус Либих определил кислоту как водородсодержащее соединение, в котором водород может быть замещён на металл .
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус . В его теории, сформулированной в 1887 году, кислота определялась как соединение, диссоциирующее в водном растворе с образованием ионов водорода H + . Теория Аррениуса быстро показала свою ограниченность. Во-первых, было выяснено, что невозможно представить существование несольватированного катиона Н + в растворе; во-вторых, теория Аррениуса не учитывала влияние растворителя на кислотно-основные равновесия; наконец, теория оказалась неприменима к неводным системам .
Согласно сольвентной теории Франклина, созданной в 1924 году, кислотой называлось вещество, при растворении увеличивавшее число тех же катионов , которые образуются при диссоциации растворителя. Данная теория сыграла важную роль в исследовании неводных растворов кислот. Химическая теория кислот и оснований формировалась в работах А. Ганча (1917—1927). По Ганчу, кислотами называются соединения водорода, в которых последний может быть замещён на металл или неметаллический радикал с образованием соли .
В 1923 году появились теории кислот и оснований Брёнстеда — Лоури и Льюиса, широко применяемые в настоящее время .

В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо и почти одновременно датским учёным Й. Брёнстедом и английским учёным Т.-М. Лоури (Лаури) , кислотой называется соединение или молекулярный ион, способные отдавать протон другому химическому соединению — основанию . Согласно теории Брёнстеда — Лоури, в химическом взаимодействии кислот и оснований всегда принимают участие кислота — донор протона (кислота Брёнстеда) и сопряженное с ней основание — любое соединение, способное присоединять протон (основание Брёнстеда). Поскольку основание может быть рассмотрено как продукт отщепления протона от кислоты, электрический заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного с ней основания. Так, например, кислоте HCl соответствует сопряженное с ней основание — хлорид-ион Cl − .
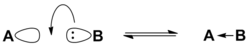
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Н. Льюисом , кислота — это вещество, принимающее электронную пару и образующее связь с основанием Льюиса за счёт этой пары электронов . Кислотами в теории Льюиса могут быть молекулы с незаполненной восьмиэлектронной оболочкой ( BF 3 , SO 3 ), катионы металлов-комплексообразователей (Fe 2+ , Zn 2+ ), галогениды переходных металлов ( TiCl 4 ), молекулы с полярными двойными связями ( SO 2 ), карбокатионы . По сравнению с теорией Брёнстеда — Лоури, теория Льюиса является более общей и охватывает более широкий круг кислот .
Ключевым свойством, определяющим способность взаимодействия кислоты Льюиса с основанием Льюиса, является энергетическое соответствие между низшей свободной молекулярной орбиталью, принимающей электронную пару, и высшей занятой молекулярной орбиталью, с которой эта электронная пара уходит. Эта способность была учтена в рамках принципа жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО). Данный принцип устанавливает, что мягкие кислоты наиболее склонны взаимодействовать с мягкими основаниями и жёсткие кислоты — с жёсткими основаниями. При этом под жёсткими кислотами следует понимать кислоты Льюиса, обладающие большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью . Напротив, мягкие кислоты обладают малым положительным зарядом, низкой электроотрицательностью и высокой поляризуемостью. Поскольку данные свойства изменяются плавно, ряд кислот Льюиса занимает промежуточное положение между жёсткими и мягкими . Принцип ЖМКО не имеет количественного критерия оценки силы кислот, поэтому он не может быть применён для аналитических расчётов .
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
|---|---|---|
| H + , Li + , Na + , K + , Mg 2+ , Ca 2+ , Al 3+ , Cr 3+ , Fe 3+ , BF 3 , B(OR) 3 , AlR 3 , AlCl 3 , SO 3 , RCO + , CO 2 , RSO 2 + | Cu 2+ , Fe 2+ , Zn 2+ , SO 2 , R 3 C + , C 6 H 5 + , NO + | Ag + , Cu + , Hg 2+ , RS + , I + , Br + , Pb 2+ , BH 3 , карбены |
| Жёсткие основания | Промежуточные основания | Мягкие основания |
| OH − , RO − , F − , Cl − , RCOO − , NO 3 − , NH 3 , RNH 2 , H 2 O, ROH , SO 4 2− , CO 3 2− , R 2 O, NR 2 − , NH 2 − | Br − , C 6 H 5 NH 2 , NO 2 − , C 5 H 5 N | RS − , RSH , I − , H − , R 3 C − , алкены , C 6 H 6 , R 3 P, (RO) 3 P |
В 1939 году М. И. Усанович сформулировал общую теорию кислот и оснований, согласно которой кислотой является частица, которая может отдавать катионы , в том числе протон , или присоединять анионы , в том числе электрон . Таким образом, понятие кислоты, по Усановичу, включает как кислоты Брёнстеда, так и кислоты Льюиса, а также окислители . Кроме того, само понятие кислотности, как и основности, в общей теории Усановича рассматривается не как функция вещества как такового, а как роль, которую оно играет в зависимости от партнёра по реакции .

Кроме подразделения на кислоты Льюиса и кислоты Брёнстеда, последние принято классифицировать по различным формальным признакам:
Названия кислородсодержащих кислот состоят из двух частей: собственного названия кислоты, выраженного прилагательным , и группового слова кислота ( серная кислота , фосфорная кислота ). Собственное название кислоты образуется от русского названия кислотообразующего элемента путём добавления различных суффиксов:
Если кислотообразующий элемент в двух кислотах находится в одной и той же степени окисления, но кислоты отличаются по «содержанию воды», то для кислоты с меньшим содержанием кислорода к названию добавляют приставку мета- , а для кислоты с большим содержанием кислорода — приставку орто- , например, метафосфорная кислота HPO 3 и ортофосфорная кислота H 3 PO 4 .
Кислородсодержащие кислоты с несколькими кислотообразующими элементами называются . Их обычно называют традиционными названиями ( дифосфорная кислота H 4 P 2 O 7 , дисерная кислота H 2 S 2 O 7 ).
Кислоты, в которых атомы кислорода заменены на атомы серы , называются и имеют соответствующую приставку тио- ( тиофосфорная кислота H 3 PO 3 S). Если гидроксильные группы кислоты или атомы кислорода замещены на атомы галогенов или аминогруппу , то к названию также добавляется соответствующая приставка ( H 2 PO 3 NH 2 ), а замещённые серные кислоты по традиции называют сульфоновыми ( хлорсульфоновая кислота ClSO 3 H).
Кислоты с пероксидным мостиком –O–O– относятся к пероксокислотам и имеют приставку пероксо- ( пероксомоносерная кислота H 2 SO 5 ) либо над- ( надсерная кислота ) .
В систематических названиях кислот к корню латинского названия кислотообразующего элемента добавляют суффикс -ат , а названия остальных элементов или их групп в анионе обозначаются приставками. В скобках указывают степень окисления кислотообразующего элемента, если она имеет целочисленное значение. В противном случае в название включают и число атомов водорода: HClO 4 — тетраоксохлорат(VII) водорода ( хлорная кислота ), HAuCl 4 — тетрахлороаурат(III) водорода ( золотохлористоводородная кислота ), H[Sb(OH) 6 ] — гексагидроксостибат(V) водорода и т. д.
Традиционно для простейших карбоновых кислот наиболее распространены тривиальные названия , некоторые из которых образовались ещё в XVII веке ( уксусная кислота , масляная кислота , адипиновая кислота , фталевая кислота ). Высшие карбоновые кислоты с чётным числом атомов углерода также имеют тривиальные названия, которые, однако, так сходны, что их употребление может вызывать путаницу ( каприловая кислота , каприновая кислота ).
Систематические названия карбоновых кислот образуются путём добавления окончания -овая кислота к названию соответствующего кислоте алкана ( гексановая кислота , пентакозановая кислота ). В случае дикарбоновых кислот используется окончание -диовая кислота (декандиовая кислота). Иногда название более удобно образовывать при помощи окончания -карбоновая кислота , которое означает замену одного атома водорода в соединении на карбоксильную группу. Такой подход применяется в тех случаях, когда карбоксильная группа присоединена к циклической системе ( циклопропанкарбоновая кислота ).
Если в карбоновой кислоте содержится пероксидный мостик, то к названию таких кислот добавляются приставки перокси- , пер- или над- ( надуксусная кислота , пероксибензойная кислота ).
Для обозначения серосодержащих органических кислот используют окончания -сульфоновая кислота (RSO 3 H), -сульфиновая кислота (RSO 2 H), -сульфеновая кислота (RSOH), аналогичным образом добавляя их к названию родоначального алкана RH .
| Формула | Название по ИЮПАК | Тривиальное название | Происхождение тривиального названия |
|---|---|---|---|
| НСООН | метановая кислота | муравьиная кислота | лат. formica — муравьи |
| СН 3 -СООН | этановая кислота | уксусная кислота | лат. acetum — уксус |
| СН 3 -СН 2 -СООН | пропановая кислота | пропионовая кислота | др.-греч. proto + pion — первый + жир |
| СН 3 -(СН 2 ) 2 -СООН | бутановая кислота | масляная кислота | лат. butyrum — масло |
| СН 3 -(СН 2 ) 3 -СООН | пентановая кислота | валериановая кислота | лат. Valeriána — валериана |
| СН 3 -(СН 2 ) 4 -СООН | гексановая кислота | капроновая кислота | лат. caper — коза |
| СН 3 -(СН 2 ) 5 -СООН | гептановая кислота | энантовая кислота | др.-греч. oenanthe — цветок винограда |
| СН 3 -(СН 2 ) 6 -СООН | октановая кислота | каприловая кислота | лат. caper — коза |
| СН 3 -(СН 2 ) 7 -СООН | нонановая кислота | пеларгоновая кислота | лат. Pelargonium — пеларгония |
| СН 3 -(СН 2 ) 8 -СООН | декановая кислота | каприновая кислота | лат. caper — коза |
| СН 3 -(СН 2 ) 9 -СООН | ундекановая кислота | ундециловая кислота | |
| СН 3 -(СН 2 ) 10 -СООН | додекановая кислота | лауриновая кислота | лат. Laurus — лавр |
| СН 3 -(СН 2 ) 11 -СООН | тридекановая кислота | тридециловая кислота | |
| СН 3 -(СН 2 ) 12 -СООН | тетрадекановая кислота | миристиновая кислота | лат. Myristica — мускатный орех, др.-греч. mύρων — оливковое масло |
| СН 3 -(СН 2 ) 13 -СООН | пентадекановая кислота | пентадециловая кислота | |
| СН 3 -(СН 2 ) 14 -СООН | гексадекановая кислота | пальмитиновая кислота | лат. palma — пальмовое дерево |
| СН 3 -(СН 2 ) 15 -СООН | гептадекановая кислота | маргариновая кислота | др.-греч. margaron — жемчуг |
| СН 3 -(СН 2 ) 16 -СООН | октадекановая кислота | стеариновая кислота | др.-греч. stear — сало |
| СН 3 -(СН 2 ) 17 -СООН | нонадекановая кислота | нонадециловая кислота | |
| С 6 Н 5 -СООН | бензолкарбоновая кислота | бензойная кислота | |
| СН 2 =СН-СООН | пропеновая кислота | акриловая кислота | лат. acer + olere — острый запах |
| СН≡С-СООН | пропиновая кислота | пропиоловая кислота | |
| СН 3 -С(СН 3 ) 2 -СООН | 2,2-диметилпропановая | сокр. от + валериановая кислота |
Теория кислот и оснований Брёнстеда, рассматривающая кислоту, как частицу, способную отдавать протон , даёт возможность количественно оценить эту способность кислоты — её силу. Сила кислот описывается при помощи константы равновесия реакции диссоциации кислоты в водном растворе, называемой также константой кислотности K a . Чем больше значение K a , тем больше способность кислоты отдавать протон и тем выше её сила. Также константа кислотности выражается в виде более удобной величины p K a — отрицательного логарифма величины K a . Например, уравнение диссоциации и константу кислотности плавиковой кислоты можно записать следующим образом :
Для многоосновных кислот используют несколько значений констант диссоциации K a1 , K a2 и т. д., соответствующих каждой ступени диссоциации. Например, фосфорная кислота диссоциирует по трём ступеням :
| Кислота | Значение ( m — n ) | K a |
|---|---|---|
| HClO | 0 | 10 −8 |
| H 3 AsO 3 | 0 | 10 −10 |
| Н 2 SО 3 | 1 | 10 −2 |
| Н 3 РО 4 | 1 | 10 −2 |
| HNO 3 | 2 | 10 1 |
| H 2 SO 4 | 2 | 10 3 |
| HClO 4 | 3 | 10 10 |
Кислоты принято условно подразделять по их силе на очень сильные ( p K a < 0 ), сильные ( 0 < p K a < 4,5 ), средней силы ( 4,5 < p K a < 9 ), слабые ( 9 < p K a < 14 ), очень слабые ( p K a > 14 ) .
Для приблизительной оценки силы кислот применяют эмпирические правила Полинга . Так, для неорганических кислородсодержащих кислот вида H n XO m известно эмпирическое правило, по которому значение первой константы связано со значением ( m — n ). Если A=( m — n ) = 0, то кислота очень слабая, при 1 — слабая, при 2 — сильная, и, наконец, при 3 кислота очень сильная . Кроме того, если такую кислоту записать в виде (HO) a XO b , выделив отдельно атомы кислорода, входящие в состав гидроксильных групп (заметим, что b = m ― n), то величину константы диссоциации по первой ступени можно оценить по уравнению:
то есть величина первой константы диссоциации определяется, в основном, числом негидроксильных атомов кислорода b . Эту зависимость связывают с отрицательным индуктивным влиянием этих атомов кислорода на связи O–H, за счёт которого облегчается отщепление протона от молекулы кислоты .
Л. Полингу также приписывают эмпирическое правило, связанное с кислотностью многоосновных кислот, которое говорит, что последовательные константы диссоциации многоосновных кислот p K a1 , p K a2 , p K a3 находятся в отношении 1 : 10 −5 : 10 −10 . Уменьшение констант кислотности связано с увеличением заряда образующегося аниона . Рассчитанные по правилам Полинга значения p K a отличаются от экспериментальных всего на ±1 .
Другой характеристикой силы кислоты может служить степень диссоциации α — отношение количества диссоциированных на ионы молекул кислоты к их исходному количеству в растворе. Степень диссоциации выражается в процентах либо в виде безразмерной величины от 0 до 1 :
| Формула кислоты | p K a | Формула кислоты | p K a |
|---|---|---|---|
| HClO 4 | -5 ± 0,5 | H 2 PO 4 - | 7,20 |
| H 2 SO 4 | -2,8 ± 0,5 | HClO | 7,25 |
| H 3 O + | -1,74 | H 3 BO 3 | 9,24 |
| HNO 3 | -1,32 | NH 4 + | 9,25 |
| (COOH) 2 | 1,26 | HCN | 9,22 |
| H 2 SO 3 | 1,92 | HCO 3 - | 10,33 |
| HSO 4 - | 1,96 | H 2 O 2 | 11,62 |
| H 3 PO 4 | 2,12 | HPO 4 2- | 12,32 |
| HF | 3,14 | H 2 O | 15,74 |
| HNO 2 | 3,35 | NH 3 (ж.) | 33 |
| CH 3 COOH | 4,76 | H 2 | 38,6 |
| H 2 S | 7,05 | СH 4 | ~58 |

На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все кислоты с константами кислотности p K a < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что для таких кислот равновесие практически нацело смещено в сторону образования иона гидроксония H 3 O + , который является единственной кислотой в растворе. По сути, ион гидроксония представляет собой самую сильную кислоту в водных растворах, поскольку все более сильные кислоты нацело превращаются в него и таким образом выравниваются по своей силе. Например, все кислоты с p K a < 0 (HCl, HBr, H 2 SO 4 ) нацело диссоциированы в водных растворах.
Аналогичная ситуация наблюдается и в других растворителях: если p K a протонной кислоты в системе «кислота-растворитель» превосходит кислотность протонированного растворителя (его сопряженной кислоты), то происходит полный перенос протонов от кислоты к растворителю и единственной и наиболее сильной кислотой в растворе становятся катионы протонированного растворителя; кислотность раствора при этом определяется кислотностью сопряженной кислоты растворителя. Данное явление получило название нивелирующего эффекта растворителя . Аналогичным образом, и очень слабые кислоты с p K a > 14 в водных растворах выравниваются по силе .
Кислотность протонированной уксусной кислоты CH 3 CO 2 + H 2 значительно выше, чем кислотность протонированной воды H 3 O + , поэтому нивелирующий эффект в уксуснокислых растворах наблюдается при значительно более низких p K a кислот.
Кислоты с p K a от 0 до 14 в воде диссоциированы не полностью: их кислотные свойства в растворе зависят от значения p K a . Например, монохлоруксусная и дихлоруксусная кислоты с p K a 2,86 и 1,26 соответственно сильно отличаются по степени диссоциации (в 0,1 М растворе первая диссоциирует на 11 %, а вторая — на 52 %) . В этом случае говорят о дифференцирующем эффекте растворителя . Интервал p K a , в котором кислоты дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола , 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных кислот для них разный .
Если растворитель обладает основными свойствами, то в нём все кислоты становятся более сильными и большее число кислот нивелируется по силе (например, в аммиаке уксусная кислота диссоциирует нацело, хотя в водных растворах она имеет среднюю силу). Напротив, если основные свойства растворителя понижаются, то сильные кислоты могут стать слабыми, а число нивелированных кислот понижается . Например, уксусная кислота служит нивелирующим растворителем для хлорной кислоты HClO 4 , диссоциирующей в ней нацело, и для хлороводородной кислоты HCl, и для серной кислоты H 2 SO 4 , являющихся в уксусной кислоте слабыми .
На диссоциацию кислот сильное действие оказывает диэлектрическая проницаемость растворителя. Это влияние особенно заметно при сравнении двух кислот разного зарядового типа. При диссоциации нейтральной кислоты, например, фенола C 6 H 5 OH, в растворе образуются два иона. Положительно заряженные кислоты, например, ион триэтиламмония (C 2 H 5 )NH + , диссоциируют с образованием одного положительно заряженного иона. Таким образом, в первом случае после реакции число ионов увеличивается, а во втором случае это число не изменяется .
Следовательно, переход от растворителя с высокой диэлектрической проницаемостью (более полярных) к растворителям с меньшей диэлектрической проницаемостью (менее полярным) должен сильно уменьшать силу нейтральных кислот и сравнительно мало влиять на заряженные кислоты. Так, в воде фенол в 5 раз сильнее иона триэтиламмония, однако, в метаноле фенол в 2500 раз слабее этого иона .
Растворитель может сильно увеличивать кислотность веществ, специфически стабилизируя анионы, образующиеся в результате диссоциации. Так, кислотность веществ в воде, выражающаяся в их депротонировании, определяется как диэлектрической проницаемостью воды (электростатическая сольватация), так и ее способностью образовывать водородные связи (специфическая сольватация), в то время как, например, депротонирование веществ в нитрометане , не склонном к образованию водородных связей, определяется только их способностью к электростатической сольватации .
Существует несколько факторов, которые определяют относительную силу органических и неорганических кислот и которые связаны со строением той или иной кислоты. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы .


Количественную оценку кислотно-основных свойств очень сильных или концентрированных кислот невозможно провести с использованием шкалы pH , поскольку для водных растворов эта шкала ограничена снизу значением pH = 0, которому соответствует 5%-ый раствор серной кислоты H 2 SO 4 . В то же время такая необходимость возникает. Для решения данной задачи в 1932 году Л. Гамметом и А. Дейрупом была предложена функция кислотности Гаммета H 0 . Их подход заключался в изучении кислотно-основного равновесия очень сильных кислот в присутствии менее сильного основания, чем вода, и измерении соотношения концентраций протонированной и непротонированной форм этого основания методом электронной спектроскопии . Это дало возможность продлить шкалу кислотности в отрицательную области, благодаря чему стала возможной оценка кислотности концентрированных растворов неорганических кислот .
Введённая Гамметом шкала кислотности широко применяется для оценки силы суперкислот — сред с кислотностью выше, чем кислотность 100%-ой серной кислоты , функция кислотности Гаммета для которой составляет H 0 = −12. Среди индивидуальных неорганических соединений сильными кислотами являются хлорная кислота HClO 4 ( H 0 = −13), хлорсульфоновая кислота ClSO 3 H ( H 0 = −13,8) и фторсульфоновая кислота FSO 3 H ( H 0 = −15,1). Самой сильной из известных органических кислот является трифторметансульфокислота CF 3 SO 3 H ( H 0 = −14,1) .
К суперкислотам относятся также смеси кислот Брёнстеда и кислот Льюиса, например, смесь HF и фторида сурьмы(V) SbF 5 в разных соотношениях ( H 0 < −30 при соотношении 1:1). Известным примером суперкислоты является олеум , где роль кислоты Льюиса выполняет SO 3 , который при реакции с серной кислотой даёт суперкислоту H 2 S 2 O 7 ( H 0 = −14,5) .


(в данном случае образуется неустойчивая угольная кислота H 2 CO 3 , которая сразу же распадается на воду и углекислый газ )
Например:
Кислоты получают:
Нелетучая серная кислота при нагревании способна вытеснять летучие кислоты из их солей (таким путём нельзя получить бромоводород и иодоводород из-за их окисления концентрированной серной кислотой) .