Interested Article - Липидные рафты

- 2021-05-05
- 1

Липи́дные ра́фты — особые участки (микродомены) плазматической мембраны , обогащённые гликосфинголипидами и холестерином . Эти участки координируют клеточные процессы, влияют на , служат организующими центрами для сборки сигнальных молекул , регулируют перемещение мембранных белков , рецепторов , а также регулируют нейротрансмиссию . Липидные рафты более структурированы и упакованы плотнее, чем окружающий их липидный бислой ; при этом они способны свободно в нём перемещаться .
История изучения
До 1982 года было широко распространено мнение, что фосфолипиды и мембранные белки распределены в клеточной мембране случайным образом — в соответствии с строения клеточной мембраны, предложенной в 1972 году и . В модели предполагалось, что мембранные белки «плавают» в однородном липидном море .
Однако в 1970-х годах А. Штир и Э. Закман, а также М. Дж. Карновски с коллегами с использованием физических методов доказали существование особых мембранных микродоменов . Существование этих микродоменов объяснялось физическими свойствами и организацией липидных смесей . В 1974 году наблюдение влияния температуры на поведение мембраны позволило выдвинуть предположение о существовании в мембранах «кластеров липидов», а в 1975 году было открыто, что эти кластеры могут представлять собой «квазикристаллические» участки, располагающиеся внутри более жидких липидных областей. В 1978 году исследования с использованием дали новый толчок развитию идеи «кластеров» и позволили определить микродомены как «липиды в более упорядоченном состоянии». В 1982 году Карновски и его сотрудники сформулировали концепцию липидных доменов в мембране. Их исследования установили неоднородность во времени жизни флуоресценции молекул 1,6-дифенил-1,3,5-гексатриена , что свидетельствует о наличии нескольких липидных фаз в мембране . Один тип таких микродоменов образован холестерином и сфинголипидами . Они формируются в результате выделения данных липидов в отдельную фазу, что было показано экспериментально . Также было установлено, что такие микродомены («рафты») имеются и в клеточных мембранах .
В результате постепенно сформировалась новая концепция строения клеточной мембраны, отражающая динамическую реструктуризацию с формированием молекулярных высокоуровневых кластеров . Термин «липидные рафты» был впервые предложен в 1988 году и . Они применили данный термин ( англ. lipid raft ‘липидный плот’) к участкам плотно упакованного липида, плавающего на поверхности более текучего фосфолипида . Первоначально концепция рафтов использовалась для объяснения транспорта холестерина из транс -отдела аппарата Гольджи в плазматическую мембрану. Эту идею впервые представили Симонс и Э. Иконен в 1997 году . В 2006 году на Главном симпозиуме по липидным рафтам и клеточным функциям ( англ. Keystone Symposium of Lipid Rafts and Cell Function ) липидные рафты были определены как «небольшие (10—200 нм), гетерогенные, высоко динамичные домены, обогащенные стеролами и сфинголипидами, которые компартментализуют клеточные процессы. Небольшие рафты могут иногда объединяться в более крупные через белок-белковые взаимодействия». В последнее время было опубликовано много противоречивых работ, касающихся липидных рафтов; к числу спорных моментов можно отнести размер и время существования липидных рафтов (подробнее ).
К настоящему моменту следующие вопросы о липидных рафтах остаются без ответов :
- Какой эффект оказывают различия в содержании мембранных белков?
- Какова физиологическая роль липидных рафтов?
- Какой эффект на образование рафтов оказывает перемещение липидов?
- Какой эффект на липидные рафты оказывает питание и приём различных препаратов?
- Какое действие на липидные рафты оказывают белки , расположенные на их границе?
Основные свойства

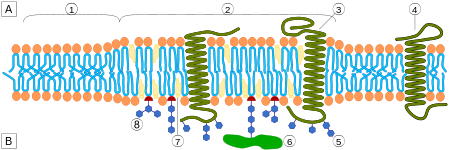
Одним из главных различий липидных рафтов и плазматической мембраны является их липидный состав. Исследования показали, что липидные рафты содержат в 3—5 раз больше холестерина, чем окружающий их липидный бислой . Кроме того, липидные рафты обогащены сфинголипидами — например, сфингомиелином , содержание которого в липидных рафтах обычно на 50 % превышает таковое в плазматической мембране. Глицерофосфолипидов в рафтах практически нет . Чтобы компенсировать повышенное содержание сфингомиелина, доля фосфатидилхолина в липидных рафтах снижена, в результате чего процент холин -содержащих липидов в них также почти на 50 % ниже по сравнению с окружающей мембраной. Холестерин предпочтительнее взаимодействует со сфинголипидами (хотя и не только с ними), что обусловлено их структурой и степенью насыщения их углеводородных цепочек. Хотя не все фосфолипиды в рафте полностью насыщены, их гидрофобные ацильные группировки более насыщены и упакованы плотнее, чем в липидах окружающего бислоя .
Холестерин служит динамическим «клеем», который скрепляет липиды рафта воедино и заполняет все пустоты между ними. Из-за жёсткой природы стерольной группы холестерин предпочтительнее располагается в рафтах, где длинные насыщенные ацильные хвосты сфинголипидов могут образовывать более компактные и прочные связи с его кольцевой системой, чем более короткие и часто ненасыщенные хвосты фосфолипидов окружающего бислоя. По этой причине липидные рафты являются менее жидкими по сравнению с остальным бислоем .
Некоторые исследователи связывают возникновение рафтов в модельных мембранах с разделением мембраны на (Lo-фаза) и неупорядоченную (Ld-, или Lα-фаза) жидкие фазы . Причины такого разделения на фазы неясны, однако их несмешиваемость, по-видимому, сводит к минимуму свободную энергию этих двух фаз. Показано, что липидные рафты и окружающая мембрана имеют различную толщину по причине того, что углеводородные цепи у сфинголипидов более длинные и прямые, чем у других липидов мембраны . Это приводит к тому, что гидрофобные слои рафтов и остального бислоя не стыкуются друг с другом на границе двух фаз. Было установлено, что такое различие в толщине увеличивает поверхностное натяжение на границе разделения двух фаз, в результате чего возникают более крупные рафты с округлыми границами, и тем самым затраты энергии на поддержание рафтов как отдельных фаз сводятся к минимуму. Другие спонтанные события — такие, как изгиб мембраны или слияние мелких рафтов в более крупные — могут также минимизировать натяжение на границе разделения фаз .
Из-за своего строения и устойчивости к действию не ионных детергентов — таких, как Triton X-100 или Brij-98 — липидные рафты также называют детергент-нерастворимыми комплексами, обогащёнными гликолипидами ( англ. detergent-insoluble glycolipid-enriched complexes (GEMs) or DIGs ) или детергент-устойчивыми мембранами ( англ. Detergent Resistant Membranes (DRMs) ). Это свойство липидных рафтов можно использовать для того, чтобы оценить долю поверхности клетки, занятой рафтами, по фракции, устойчивой к солюбилизации детергентами. В некоторых случаях она может составлять 50 %. Косвенные измерения размеров рафтов позволяют грубо оценить диаметр одного рафта в 50 нм (впрочем, на этот счёт есть и другие мнения, ).
Липидные рафты чрезвычайно обогащены интегральными мембранными белками двух классов: одни заякорены в мембране при помощи двух ковалентно связанных с этими белками длинноцепочечных насыщенных жирных кислот (две пальмитоильные или пальмитоильная и миристоильная группы), а другие — посредством гликозилфосфатидилинозитольного (GPI-) якоря. Между белками рафта и остального бислоя происходит постоянный обмен: мембранные белки могут заходить внутрь рафтов и выходить наружу за время порядка нескольких секунд . Для процесса, в котором взаимодействуют два мембранных белка, их одновременное присутствие в одном и том же рафте очень сильно увеличивает вероятность их столкновения. Поэтому некоторые мембранные рецепторы и сигнальные белки обособляются вместе именно в мембранных рафтах, причём передачу сигнала через эти белки можно прервать с помощью манипуляций, которые выводят холестерин из мембраны и разрушают рафты; таким образом, липидные рафты принимают участие во многих сигнальных путях клетки .
Типы липидных рафтов
Предполагают существование двух типов липидных рафтов: планарные (также известные как некавеолярные , или гликолипидные рафты) и кавеолярные липидные рафты. Планарные липидные рафты лежат в плоскости плазматической мембраны (не образуют впячиваний) и не имеют отличительных морфологических особенностей. Кавеолярные рафты, напротив, формируют в плазматической мембране колбообразные впячивания, содержащие белок кавеолин , который входит в состав особых углублений мембраны — кавеол ; большинство наблюдаемых рафтов относятся к этому типу. Кавеолины интенсивно экспрессируются в мозге , микрососудах нервной системы , эндотелиальных клетках, астроцитах , олигодендроцитах , шванновских клетках , спинальных ганглиях и нейронах гиппокампа . Планарные рафты содержат белок и встречаются в нейронах, лишённых кавеол. Оба типа рафтов имеют сходный липидный состав (обогащены холестерином и сфинголипидами). Флотиллин и кавеолин обладают способностью рекрутировать сигнальные молекулы к липидным рафтам, тем самым играя важную роль в передаче сигналов, опосредованной нейромедиаторами . Было высказано предположение, что эти микродомены отвечают за такую пространственную организацию сигнальных молекул, которая способствует кинетически выгодным взаимодействиям, необходимым для передачи сигнала. Впрочем, эти же микродомены и разделяют сигнальные молекулы, подавляя ненужные взаимодействия и приводя к затуханию сигнала .
Роль в передаче сигналов
Термин «передача сигнала» относится к любому процессу, при помощи которого клетка превращает один тип сигнала или стимула в другой. Путь сигнала или стимула может быть простым, как в случае с молекулами рецепторов. Более сложная передача сигнала включает участие комплексов лиганд -рецептор во многих внутриклеточных процессах, например, фосфорилирование тирозинкиназами или . Специфичность и точность передачи сигнала необходимы для эффективного ответа клетки на изменения окружающей среды . Отчасти это достигается при помощи различной локализации белков, участвующих в сигнальных путях. В плазматической мембране отчасти такую компартментализацию осуществляют липидные рафты .
Одним из важных доказательств в пользу существования липидных рафтов является их работа как платформ, на которых концентрируются отдельные рецепторы после активации при связывании с лигандом . Если же активация рецептора происходит в самом липидном рафте, то сигнальный комплекс оказывается защищённым рафтом от внешних ферментов , например, мембранных фосфатаз . В общем, липидные рафты привлекают белки в новую микросреду, так что их (де)фосфорилированное состояние может быть изменено локальными киназами и фосфатазами и дать начало последующим реакциям сигнального пути . Было установлено, что липидные рафты участвуют во многих сигнальных путях — например, сигнальном пути , Т- и В-клеточных антигеновых рецепторов, рецептора эпидермального фактора роста (EGF), инсулинового рецептора и др. Некоторые примеры таких сигнальных путей приведены ниже.
Сигнальный путь иммуноглобулина E


1. Соединение нескольких рецепторов FcεR.
2. Рекрутирование киназы Lyn и фосфорилирование ITAM.
3. Связывание киназы Syk с рецепторным комплексом.
4. Киназа Syk связывает и активирует другие белки, включая LAT и др., что запускает сигнальный каскад.
Изучение сигнального пути иммуноглобулина Е (IgE) впервые убедительно продемонстрировало участие липидных рафтов в передаче сигнала . Доказательствами участия липидных рафтов в этом процессе служат сниженная растворимость Fc-эпсилон рецепторов (FcεR) в детергенте Triton X-100 при переходе от одиночного состояния к связанному поперечными сшивками с другим рецептором того же типа ; формирование скоплений из ганглиозидов и GPI-заякоренных белков, достаточно больших для того, чтобы быть различимыми в флуоресцентный микроскоп ; прекращение работы пути при удалении поверхностного холестерина при помощи метил-β- циклодекстрина и др.
Последовательность событий этого сигнального пути такова. Сначала IgE связывается с Fc-эпсилон рецепторами, находящимися в плазматических мембранах тучных клеток и базофилов , через их Fc-сегмент. Тетрамер FcεR состоит из одной α-, одной β- и двух γ-цепей . Сначала один тетрамер FcεR связывается с одной молекулой IgE. С IgE связывается α-цепь, а три другие цепи содержат ( англ. immune receptor tyrosine-based activation motifs (ITAM) ). Далее олигомерный антиген связывается с несколькими молекулами IgE, уже связанным к тому моменту с FcεR, сшивая вместе два или более рецепторных комплексов. После такого соединения для фосфорилирования ITAM двух рецепторов привлекается дважды Src -подобная тирозинкиназа . Далее тирозинкиназа семейства Syk связывается с фосфотирозиновыми остатками ITAM (результат работы Lyn) и начинает сигнальный каскад . Syk, в свою очередь, может активировать другие белки, например, LAT. Белки LAT, связываясь друг с другом, могут рекрутировать в рафт другие белки и дополнительно амплифицировать (усиливать) сигнал .
Сигнальный путь Т-клеточного антигенового рецептора


Т-клеточный антигеновый рецептор (TCR) — это молекула, имеющаяся на поверхности Т-лимфоцитов (Т-клеток). Он включает в себя αβ- гетеродимер , CD3- (γδε) комплекс и ξ-гомодимер. α- и β- субъединицы содержат внеклеточные сайты связывания для пептидов , которые представлены на белках главного комплекса гистосовместимости (МНС) и классов, расположенных на поверхности антигенпрезентирующих клеток (APC). CD3- и ξ-субъединицы содержат цитоплазматические мотивы ITAM. При передаче сигнала молекулы MHC связываются с TCR, соединяя два или более рецептора вместе. Такое соединение рецепторов, как и в сигнальном пути IgE, рекрутирует дважды ацетилированные нерецепторные Src-подобные тирозинкиназы для фосфорилирования мотивов ITAM. TCR привлекает не только тирозинкиназу Lyn, но и Fyn . После этого белок , не участвующий в сигнальном пути IgE, связывается с фосфорилированными ITAM, благодаря чему активируется сам и активирует LAT. Активация LAT даёт амплификацию сигнала. Другое отличие сигнального пути TCR от сигнального пути IgE заключается в том, что TCR активируют белок Lck , что может приводить к более сильной кластеризации рафтов и тем самым дополнительно усиливать сигнал. Одним из возможных механизмов отрицательной регуляции этого пути может быть связывание цитозольной киназы Csk с ассоциированным с рафтами белком CBP . После этого Csk может подавлять работу киназ семейства Src через фосфорилирование .
Сигнальный путь В-клеточного антигенового рецептора
В-клеточный антигеновый рецептор (BCR) представляет собой комплекс мембранносвязанной молекулы иммуноглобулина (mIg) и гетеродимера Igα-Igβ, состоящего из двух полипептидов , которые связаны друг с другом дисульфидными связями . И Igα, и Igβ содержат мотив ITAM.
Сигнальный путь BCR схож с сигнализацией IgE и TCR. Широко распространено мнение, что, помимо действия через BCR, липидные рафты могут принимать участие во многих событиях, происходящих на поверхности В-клетки при её активации. К функциям липидных рафтов в В-клетках относится их участие в сигнальном пути BCR, модуляция работы сигнальных путей при помощи корецепторов , сигнальные пути CD40 , эндоцитоз пептидных антигенов, связанных с BCR, и их последующая загрузка в ранние эндосомы (пептиды, образующиеся при разрушении пептидного антигена ферментами эндосом, в дальнейшем будут выставлена на поверхности клетки в комплексе с молекулами MHC II и презентированы Т-клеткам) .
Липидные рафты как платформы для проникновения вирусов в клетку
Для проникновения в клетку вирусов , облигатных внутриклеточных паразитов , необходимо специфическое взаимодействие вируса и клеточных рецепторов на плазматической мембране. Накапливаются подтверждения того, что вирусы попадают в клетку через специфические мембранные микродомены, в том числе липидные рафты.
Вирусы без оболочки
Наиболее хорошо изученными примерами проникновения в клетку через липидные рафты вирусов, не имеющих оболочки, являются вирус обезьян SV40 ( сем. Papovaviridae ) и эховирус I типа (EV1, сем. Picornaviridae ) .
Для проникновения в клетку SV40 использует два различных рецептора: ганглиозид , располагающийся в липидных рафтах, и молекулу MHC I типа . Связывание SV40 с молекулой MHC I типа вызывает кластеризацию и перераспределение рецепторов. SV40 может привлечь к себе больше кавеол из цитоплазмы и даже вызвать образование новых кавеол в месте проникновения. Сигнальный каскад, запускаемый при присоединении вируса к клетке, приводит к опосредованному кавеолами эндоцитозу вируса в течение 20 минут. В некоторых типах клеток вирус может проникать в кавеосомы (отпочковавшиеся от мембраны кавеолы) непосредственно из неокаймлённых везикул , отпочковавшихся от липидных рафтов .
EV1 в качестве клеточного рецептора использует интегрин α2β1 . Множество интегриновых гетеродимеров может связываться с соседними участками на капсиде вируса. Как и в случае с SV40, прикрепление вируса и его связывание с клеткой запускает кластеризацию и перемещение молекул интегрина из липидных рафтов в кавеолоподобные структуры. При удалении холестерина из липидных рафтов эховирусная инфекция не развивается .
Существуют также вирусы, которые используют некавеолярный эндоцитоз, опосредованный рафтами, например, эховирус 11 (EV11, сем. Picornaviridae ), однако детальный механизм этих процессов ещё не изучен .
Вирусы с оболочкой
Вирусы гриппа связываются с клеточным рецептором — сиаловой кислотой , которая присоединена к гликоконъюгату , инициирующему эндоцитоз. После переноса вируса в поздние эндосомы из-за низкого значения pH происходит изменение конформации вирусного гемагглютинина (HA), после чего липидная оболочка вируса сливается с мембраной эндосомы, и вирусные комплексы высвобождаются в цитоплазму. Этот выход запускается потоком протонов через вирусный протонный канал М2, для работы которого необходимо связывание с холестерином. Для проникновения в клетку (SFV, сем. Togaviridae ) и (SIN, сем. Togaviridae ) используют холестерин и сфинголипиды и задействуют липидные рафты для слияния их липидной оболочки с мембраной, опосредованного содержащимся в их оболочке гликопротеином , и последующего попадания в цитоплазму . Т-лимфотропный вирус человека (HTLV-1, сем. Retroviridae ) попадает в клетку через глюкозный транспортер 1 ( GLUT1 ). Вирус Эбола и вирус Марбург используют в качестве клеточного рецептора -α (FRα), являющийся GPI-заякоренным белком. Вирус гепатита B распознает человеческий рецептор комплемента 2-го типа (CR2, или CD21). Человеческий вирус герпеса 6 типа (HHV-6) связывается с рецептором CD46 на поверхности клетки. Все эти клеточные рецепторы располагаются в липидных рафтах или перемещаются туда при инфекции .
Вирус иммунодефицита человека (ВИЧ), передающийся половым путём , для проникновения в организм хозяина должен преодолеть барьер эпителиальных клеток, которые не экспрессируют рецептор CD4 или (эти рецепторы часто используются для попадания в клетку). Альтернативным рецептором для гликопротеина оболочки ВИЧ на эпителиальных клетках является гликосфинголипид (GalCer), которым изобилуют липидные рафты .
Методы изучения
Одной из причин многочисленных противоречий, возникших вокруг липидных рафтов, является сложность их изучения в живых клетках, которые не находятся в термодинамическом равновесии . Липидные рафты представляют собой маленькие микродомены размером 10—200 нм . Поскольку их размер находится за дифракционным пределом светового микроскопа , визуализировать липидные рафты непосредственно чрезвычайно сложно. В настоящий момент исследуются искусственные мембраны, однако их использование имеет массу недостатков. Во-первых, содержание белков в искусственных мембранах значительно меньше такового в биологических мембранах. Во-вторых, сложно смоделировать взаимодействия мембраны и цитоскелета , которые имеют место в биомембранах. В-третьих, искусственные мембраны лишены естественной асимметрии, и их невозможно изучать в неравновесном состоянии .
Другой интенсивно используемый метод изучения липидных рафтов — флуоресцентная микроскопия. Например, широко используются флуорофоры , связанные с В-субъединицей холерного токсина , который связывается с обязательной составляющей рафтов — ганглиозидом GM1. Также используются липофильные мембранные красители, которые либо встраиваются между рафтами и остальной мембраной, либо изменяют свои флуоресцентные свойства в зависимости от фазы мембраны. Примером таких красителей может служить часто используемый . Рафты также можно пометить с помощью экспрессии флуоресцентно-меченных белков — например, Lck- GFP .
Секвестрация холестерина с помощью филипина , нистатина и амфотерицина В , удаление с помощью метил-В-циклодекстрина, подавление его синтеза с помощью ингибиторов HGM-СоА-редуктазы служат примерами таких методов. Они позволяют пронаблюдать за изменениями передачи сигналов нейромедиаторами при уменьшении уровня холестерина в мембране .
При использовании визуализации с высоким разрешением и математического моделирования было показано, что белки липидных рафтов собраны в нанокластеры высокой плотности радиусом 5—20 нм. Используя измерение ( англ. fluorescence resonance energy transfer, FRET ) между одними и теми же пробами (гомо-FRET или флуоресцентная анизотропия ), Шарма и коллеги заключили, что часть (20—40 %) GPI-заякоренных белков организована в кластеры высокой плотности и радиусом 4—5 нм . В настоящее время для преодоления проблемы малого размера и динамической природы липидных рафтов всё чаще используется наблюдение за движением отдельных частиц и молекул при помощи охлаждённых, чувствительных ПЗС -камер и микроскопии с полным внутренним отражением (TIRF). Эта техника позволяет получить информацию о способности частиц диффундировать в исследуемой мембране, а также выявить на этой мембране зоны с ограниченной диффузией и барьеры для диффузии .
Используются и другие оптические техники. Например, и взаимнокорелляционная спектроскопия ( англ. Fluorescence Correlation and Cross-Correlation Spectroscopy (FCS/FCCS) ) могут применяться для получения информации о подвижности флуорофора в мембране. С помощью техники FRET ( англ. Fluorescence Resonance Energy Transfer ) можно определить, когда флуорофоры находятся в непосредственной близости, а техники с применением оптических пинцетов могут дать информацию о вязкости мембраны .
Для изучения липидных рафтов также используют атомно-силовая микроскопия , ( англ. Scanning Ion Conductance Microscopy (SICM) ), , ядерный магнитный резонанс ; однако флуоресцентная микроскопия по-прежнему выступает доминирующей техникой изучения липидных рафтов. Есть надежды, что в будущем (например, STED-микроскопия ) и различные формы структурированной иллюминационной микроскопии помогут преодолеть проблемы, вызванные дифракционным ограничением.
Кроме того, для работы с рафтами используются иммуноферментный анализ (ELISA), вестерн-блоттинг и флуоресцентно-активированная сортировка клеток (FACS) .
Споры вокруг липидных рафтов
Роль рафтов во внутриклеточной передаче сигналов, метаболизме и поддержании структуры клетки ещё не полностью определена, несмотря на множество проведенных экспериментов, использующих различные методы, и даже само существование липидных рафтов ставится под вопрос .
Против существования липидных рафтов свидетельствуют следующие аргументы:
- Во-первых, между Lα- и Lo-фазами должно существовать линейное натяжение, а значит, и граница фаз. Такая граница, действительно, наблюдается в модельных мембранах, но не в клеточных системах.
- Во-вторых, не существует единого мнения относительно размеров рафта, причём возможные их значения в разных работах оцениваются от 1 до 1000 нм.
- В-третьих, время существования рафтов неизвестно. Если они существуют, то время их существования может не соответствовать временной шкале биологических процессов.
- В-четвёртых, вся мембрана может существовать в Lo-фазе.
Первое опровержение последнего пункта — Lo-фаза рафта более плотная из-за межмолекулярных водородных связей между молекулами сфинголипидов и холестерина, причём эти связи не образуются в других местах .
Второй аргумент против существования липидных рафтов обусловлен эффективностью разрушения липидных рафтов при исследованиях. Удаление холестерина из рафтов может иметь негативные последствия для достоверности дальнейших результатов о функциях рафтов . Большинство исследователей использовало жёсткие методы удаления холестерина из мембран, которые разрушали не только рафты, но и другой мембранный фосфолипид — (PI(4,5)P 2 ). Данный фосфолипид играет важную роль в регуляции цитоскелета , и его разрушение может привести к тем результатам, которые обычно объясняют удалением холестерина, в том числе белков в мембране . Так как наиболее часто используемые методы разрушают и рафты, и PI(4,5)P 2 , то влияние удаления холестерина на определённый процесс не может быть отнесено только лишь к разрушению рафтов, поскольку могут быть затронуты и многие процессы, не связанные с рафтами. Наконец, хотя сейчас предполагается, что рафты каким-то образом присоединены к белкам, некоторые исследователи считают, что белки могут привлекаться в рафт только за счёт взаимодействия с ацильными хвостами липидов, которые скрыты внутри мембраны, и никак иначе .
Примечания
- ↑ , с. 964.
- ↑ , с. 543.
- ↑ Thomas S. , Preda-Pais A. , Casares S. , Brumeanu T. D. (англ.) // Molecular immunology. — 2004. — Vol. 41, no. 4 . — P. 399—409. — doi : . — .
- Thomas S. , Kumar R. S. , Brumeanu T. D. (англ.) // Archivum immunologiae et therapiae experimentalis. — 2004. — Vol. 52, no. 4 . — P. 215—224. — .
- ↑ Korade Z. , Kenworthy A. K. (англ.) // Neuropharmacology. — 2008. — Vol. 55, no. 8 . — P. 1265—1273. — doi : . — .
- ↑ Pike L. J. (англ.) // Journal of lipid research. — 2009. — Vol. 50 Suppl. — P. 323—328. — doi : . — .
- Simons K. , Ehehalt R. (англ.) // The Journal of clinical investigation. — 2002. — Vol. 110, no. 5 . — P. 597—603. — doi : . — .
- Singer S. J. , Nicolson G. L. (англ.) // Science (New York, N.Y.). — 1972. — Vol. 175, no. 4023 . — P. 720—731. — .
- ↑ Веснина Л. Э. // Актуальні проблеми сучасної медицини. — 2013. — Т. 13, вип. 2 (42) . — С. 5—10 . 4 марта 2016 года.
- Stier A. , Sackmann E. (англ.) // Biochimica et biophysica acta. — 1973. — Vol. 311, no. 3 . — P. 400—408. — .
- Karnovsky M. J. , Kleinfeld A. M. , Hoover R. L. , Klausner R. D. (англ.) // The Journal of cell biology. — 1982. — Vol. 94, no. 1 . — P. 1—6. — .
- Israelachvili J. N. , Marcelja S. , Horn R. G. (англ.) // Quarterly reviews of biophysics. — 1980. — Vol. 13, no. 2 . — P. 121—200. — .
- Estep T. N. , Mountcastle D. B. , Barenholz Y. , Biltonen R. L. , Thompson T. E. (англ.) // Biochemistry. — 1979. — Vol. 18, no. 10 . — P. 2112—2117. — .
- Goodsaid-Zalduondo F. , Rintoul D. A. , Carlson J. C. , Hansel W. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1982. — Vol. 79, no. 14 . — P. 4332—4336. — .
- Simons K. , van Meer G. (англ.) // Biochemistry. — 1988. — Vol. 27, no. 17 . — P. 6197—6202. — .
- Simons K. , Ikonen E. (англ.) // Nature. — 1997. — Vol. 387, no. 6633 . — P. 569—572. — doi : . — .
- Anchisi L. , Dessì S. , Pani A. , Mandas A. (англ.) // Frontiers in physiology. — 2012. — Vol. 3. — P. 486. — doi : . — .
- Rietveld A. , Simons K. (англ.) // Biochimica et biophysica acta. — 1998. — Vol. 1376, no. 3 . — P. 467—479. — .
- Fivaz M. , Abrami L. , van der Goot F. G. (англ.) // Trends in cell biology. — 1999. — Vol. 9, no. 6 . — P. 212—213. — .
- ↑ , с. 545.
- ↑ Allen J. A. , Halverson-Tamboli R. A. , Rasenick M. M. (англ.) // Nature reviews. Neuroscience. — 2007. — Vol. 8, no. 2 . — P. 128—140. — doi : . — .
- King, Michael W. (10 февраля 2013). Дата обращения: 26 мая 2015. 27 мая 2015 года.
- ↑ Janes P. W. , Ley S. C. , Magee A. I. , Kabouridis P. S. (англ.) // Seminars in immunology. — 2000. — Vol. 12, no. 1 . — P. 23—34. — doi : . — .
- Schmitz G. , Grandl M. (англ.) // Current opinion in clinical nutrition and metabolic care. — 2008. — Vol. 11, no. 2 . — P. 106—112. — doi : . — .
- Simons K. , Toomre D. (англ.) // Nature reviews. Molecular cell biology. — 2000. — Vol. 1, no. 1 . — P. 31—39. — doi : . — .
- ↑ Field K. A. , Holowka D. , Baird B. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1995. — Vol. 92, no. 20 . — P. 9201—9205. — .
- ↑ Sheets E. D. , Holowka D. , Baird B. (англ.) // Current opinion in chemical biology. — 1999. — Vol. 3, no. 1 . — P. 95—99. — .
- ↑ Baird B. , Sheets E. D. , Holowka D. (англ.) // Biophysical chemistry. — 1999. — Vol. 82, no. 2-3 . — P. 109—119. — .
- Stauffer T. P. , Meyer T. (англ.) // The Journal of cell biology. — 1997. — Vol. 139, no. 6 . — P. 1447—1454. — .
- Holowka D. , Sheets E. D. , Baird B. (англ.) // Journal of cell science. — 2000. — Vol. 113 ( Pt 6). — P. 1009—1019. — .
- Sheets E. D. , Holowka D. , Baird B. (англ.) // The Journal of cell biology. — 1999. — Vol. 145, no. 4 . — P. 877—887. — .
- Goitsuka R. , Kanazashi H. , Sasanuma H. , Fujimura Y. , Hidaka Y. , Tatsuno A. , Ra C. , Hayashi K. , Kitamura D. (англ.) // International immunology. — 2000. — Vol. 12, no. 4 . — P. 573—580. — .
- Langlet C. , Bernard A. M. , Drevot P. , He H. T. (англ.) // Current opinion in immunology. — 2000. — Vol. 12, no. 3 . — P. 250—255. — .
- Zhang W. , Trible R. P. , Samelson L. E. (англ.) // Immunity. — 1998. — Vol. 9, no. 2 . — P. 239—246. — .
- Brdiĉka T. , Cerný J. , Horejŝí V. (англ.) // Biochemical and biophysical research communications. — 1998. — Vol. 248, no. 2 . — P. 356—360. — .
- Cary L. A. , Cooper J. A. (англ.) // Nature. — 2000. — Vol. 404, no. 6781 . — P. 945—947. — doi : . — .
- ↑ Gupta N. , DeFranco A. L. (англ.) // Seminars in cell & developmental biology. — 2007. — Vol. 18, no. 5 . — P. 616—626. — doi : . — .
- ↑ Chazal N. , Gerlier D. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2003. — Vol. 67, no. 2 . — P. 226—237. — .
- ↑ Pietiäinen V. M. , Marjomäki V. , Heino J. , Hyypiä T. (англ.) // Annals of medicine. — 2005. — Vol. 37, no. 6 . — P. 394—403. — doi : . — .
- Rajendran L. , Simons K. (англ.) // Journal of cell science. — 2005. — Vol. 118, no. Pt 6 . — P. 1099—1102. — doi : . — .
- Rawat S. S. , Viard M. , Gallo S. A. , Rein A. , Blumenthal R. , Puri A. (англ.) // Molecular membrane biology. — 2003. — Vol. 20, no. 3 . — P. 243—254. — doi : . — .
- Campbell S. M. , Crowe S. M. , Mak J. (англ.) // Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. — 2001. — Vol. 22, no. 3 . — P. 217—227. — .
- Alving C. R. , Beck Z. , Karasavva N. , Matyas G. R. , Rao M. (англ.) // Molecular membrane biology. — 2006. — Vol. 23, no. 6 . — P. 453—465. — doi : . — .
- Jacobson K. , Mouritsen O. G. , Anderson R. G. (англ.) // Nature cell biology. — 2007. — Vol. 9, no. 1 . — P. 7—14. — doi : . — .
- Sharma P. , Varma R. , Sarasij R. C. , Ira , Gousset K. , Krishnamoorthy G. , Rao M. , Mayor S. (англ.) // Cell. — 2004. — Vol. 116, no. 4 . — P. 577—589. — .
- Ritchie K. , Shan X. Y. , Kondo J. , Iwasawa K. , Fujiwara T. , Kusumi A. (англ.) // Biophysical journal. — 2005. — Vol. 88, no. 3 . — P. 2266—2277. — doi : . — .
- Eggeling C. , Ringemann C. , Medda R. , Schwarzmann G. , Sandhoff K. , Polyakova S. , Belov V. N. , Hein B. , von Middendorff C. , Schönle A. , Hell S. W. (англ.) // Nature. — 2009. — Vol. 457, no. 7233 . — P. 1159—1162. — doi : . — .
- Thomas S. , Kumar R. S. , Casares S. , Brumeanu T. D. (англ.) // Journal of immunological methods. — 2003. — Vol. 275, no. 1-2 . — P. 161—168. — .
- Thomas S. , Kumar R. , Preda-Pais A. , Casares S. , Brumeanu T. D. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2003. — Vol. 170, no. 12 . — P. 5981—5992. — .
- Munro S. (англ.) // Cell. — 2003. — Vol. 115, no. 4 . — P. 377—388. — .
- Barenholz Y. (англ.) // Sub-cellular biochemistry. — 2004. — Vol. 37. — P. 167—215. — .
- Pike L. J. , Miller J. M. (англ.) // The Journal of biological chemistry. — 1998. — Vol. 273, no. 35 . — P. 22298—22304. — .
- Caroni P. (англ.) // The EMBO journal. — 2001. — Vol. 20, no. 16 . — P. 4332—4336. — doi : . — .
- Kwik J. , Boyle S. , Fooksman D. , Margolis L. , Sheetz M. P. , Edidin M. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2003. — Vol. 100, no. 24 . — P. 13964—13969. — doi : . — .
- Edidin M. (англ.) // Annual review of biophysics and biomolecular structure. — 2003. — Vol. 32. — P. 257—283. — doi : . — .
Литература
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки / Пер. с англ. А. Н. Дьяконовой, А. В. Дюбы и А. А. Светлова. Под ред. Е. С. Шилова, Б. П. Копнина, М. А. Лагарьковой, Д. В. Купраша. — М. —Ижевск: НИЦ «Регулярная и хаотическая динамика», 2013. — Т. 2. — С. 964. — 1052 с. — ISBN 978-5-4344-0137-1 .
- Нельсон Д., Кокс М. Основы биохимии Ленинджера: в 3 т. — М. : БИНОМ, 2011. — Т. 1. — С. 543—546. — 694 с. — ISBN 978-5-94774-365-4 .
Ссылки
- Чугунов, Антон; Полянский, Антон. . // Сайт Biomolecula.ru (22 января 2012). Дата обращения: 24 марта 2018.
- Усик, Мария. . // Сайт Biomolecula.ru (8 декабря 2015). Дата обращения: 24 марта 2018.
- 2021-05-05
- 1