Interested Article - Цезий

- 2021-10-25
- 1
| 55 |
Цезий
|
|
|
|
| [Xe]6s 1 | |
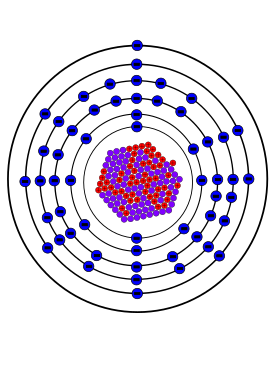
Це́зий ( химический символ — Cs , от лат. Caesium ) — химический элемент 1-й группы (по устаревшей классификации — главной подгруппы первой группы, IA), шестого периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 55.
Простое вещество цезий — это мягкий, вязкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил по цвету двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
История
Цезий открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии , став первым элементом, открытым при помощи спектрального анализа . В чистом виде цезий впервые был выделен в 1881 году шведским химиком при электролизе расплава смеси цианида цезия (CsCN) и бария .
Нахождение в природе. Добыча
Основным цезиевым минералом является поллуцит . В виде примесей цезий входит в ряд алюмосиликатов : лепидолит , флогопит , биотит , амазонит , петалит , берилл , циннвальдит , лейцит , карналлит . Также содержится в редком минерале авогадрите . В качестве промышленного сырья используются поллуцит и лепидолит .
Подтверждённые мировые запасы цезия на начало 2012 года оцениваются в 70 000 тонн .
По добыче цезиевой руды ( поллуцита ) лидирует Канада — в месторождении (юго-восточная Манитоба , северо-западный берег озера Берник-Лейк ) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве . В России месторождения поллуцита есть на Кольском полуострове , в Восточном Саяне и Забайкалье . Месторождения поллуцита также имеются в Казахстане , Монголии и Италии (о. Эльба ), но они обладают малыми запасами и не имеют важного экономического значения .
Мировая добыча обогащённой руды цезия составляет около 20 тонн в год. Мировой объём производства металлического (чистого) цезия — около 9 тонн в год .
Некоторые источники утверждают, что потребности в цезии более чем в 8,5 раза превышают его добычу, что положение в металлургии цезия ещё более тревожное, чем, например, в металлургии тантала или рения , и производители не могут обеспечить постоянно растущий спрос на металлический цезий.
Геохимия и минералогия
Среднее содержание цезия в земной коре — 3,7 г/т . Наблюдается некоторое увеличение содержания цезия от ультраосновных пород (0,1 г/т ) к кислым (5 г/т ). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах цезия ( поллуците и др.). Постоянно повышенные количества цезия наблюдаются в морганите (1—4 %), (около 5 %), авогадрите и лепидолите (0,85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0,01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0,4 %, что примерно в 40 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещённых микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связаны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Максимальное содержание цезия составляет лишь 15 г/т . Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощённого основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует «пассивно», в глинистых частичках речных вод. В морской воде концентрация цезия составляет ок. 0,5 мкг/л . Из числа собственно цезиевых минералов наиболее распространены поллуцит (Cs, Na)[AlSi 2 O 6 ]· n H 2 O (22—36 % Cs 2 O), цезиевый берилл ( пеццоттаит ) Be 2 CsAl 2 (Si 6 O 18 ) и авогадрит (KCs)BF 4 . Последние два минерала содержат до 7,5 % окиси цезия. Из других цезиевых минералов известны также (Cs,Tl)(Hg,Cu,Zn) 6 (As,Sb) 4 S 12 и маргаритасит (Cs,K,H 3 O) 2 (UO 2 ) 2 V 2 O 8 ·H 2 O.
Изотопы
Известны изотопы цезия с массовыми числами от 112 до 151 (количество протонов 55, нейтронов от 57 до 96), и 22 ядерных изомеров . Природный цезий — моноизотопный элемент , состоящий из единственного стабильного изотопа 133 Cs .

Самым долгоживущим искусственным радиоактивным нуклидом цезия является с периодом полураспада T 1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137 Cs ( T 1/2 = 30,17 года ).
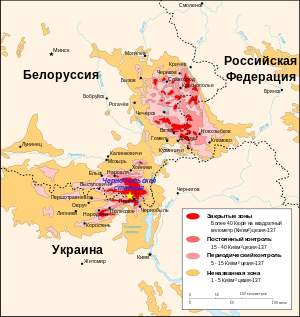
Цезий-137 является одним из виновников радиоактивного загрязнения биосферы , так как образуется при делении ядер в ядерных реакторах и при испытаниях ядерного оружия . Цезий-137 претерпевает бета-распад , дочерний изотоп стабильный барий-137 .
Физические свойства

Полная электронная конфигурация атома цезия: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 4d 10 5p 6 6s 1
Цезий — мягкий металл, из-за низкой температуры плавления ( T пл = 28,6 °C ) при комнатной температуре находится в полужидком состоянии. Твёрдость цезия по шкале Мооса составляет 0,2.
Металлический цезий из-за релятивистских эффектов электронов представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото , но светлее. Расплав цезия — подвижная жидкость, цвет которой является более серебристым. Жидкий цезий хорошо отражает свет. Пары цезия окрашены в зеленовато-синий цвет.
Цезий образует кристаллы кубической сингонии (объёмно-центрированная решётка), пространственная группа Im 3 m , параметры ячейки a = 0,6141 нм , Z = 2 . При высоком давлении может переходить в другие полиморфные модификации . Цезий — парамагнетик .
Цезий растворяется в жидком аммиаке (тёмно-синие растворы) и расплавленном CsOH.
Цезий образует легкоплавкие сплавы с другими щелочными металлами. Его сплав с калием и натрием имеет температуру плавления −78 °С.
Химические свойства
Цезий является наиболее химически активным металлом , за исключением радиоактивного франция , практически отсутствующего в природе. Является сильнейшим восстановителем. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO 2 .
При ограниченном доступе кислорода или на холоде, окисляется до оксида Cs 2 O .
Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид цезия и водород H 2 .
Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами , галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами , сухим льдом (взаимодействие протекает с сильным взрывом). Реагирует с бензолом . Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом , но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает количество одновременно реагирующего вещества).
Многие образуемые цезием соли — нитраты , хлориды , бромиды , фториды , иодиды , хроматы , манганаты , азиды , цианиды , карбонаты и т. д. — чрезвычайно легко растворимы в воде и ряде органических растворителей ; наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития , не вступает в реакцию с азотом при обычных условиях и, в отличие от бария , кальция , магния и ряда других металлов, неспособен образовать с азотом соединений даже при сильном нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разъедает стекло даже при обычной температуре, а расплав разрушает железо , кобальт , никель , а также платину , корунд и диоксид циркония и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и некоторые его сплавы.
Цезий весьма активен и агрессивен по отношению к контейнерным материалам и требует хранения, например, в сосудах из специального стекла в атмосфере аргона или водорода (обычные марки лабораторного стекла цезий разрушает).
Цезий способен присоединяться к этилену с образованием дицезиоэтилена CsCH 2 CH 2 Cs.
Получение
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой , добавление хлорида сурьмы SbCl 3 для осаждения соединения Cs 3 [Sb 2 Cl 9 ] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl . При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO 4 ) 2 ·12H 2 O.
Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода , азота , кислорода и многократная ступенчатая кристаллизация .
Сложности получения цезия обусловливают постоянный поиск его минералов: извлечение этого металла из руд неполное, в процессе эксплуатации материал рассеивается и безвозвратно теряется, Промышленность нуждается именно в очень чистом материале (на уровне 99,9—99,999 %), и это является одной из труднейших задач в металлургии редких элементов .
В России переработка и извлечение солей цезия из поллуцита ведётся в Новосибирске на ЗАО «Завод редких металлов» .
Существует несколько лабораторных методов получения цезия . Он может быть получен:
- нагревом в вакууме смеси хромата или дихромата цезия с цирконием ;
- разложением азида цезия в вакууме ;
- нагревом смеси хлорида цезия и специально подготовленного кальция или лития .
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике , радио- , электро- , рентгенотехнике , химической промышленности , оптике, медицине , ядерной энергетике . В основном применяется стабильный природный цезий-133 , и ограниченно — его радиоактивный изотоп цезий-137 , выделяемый из суммы осколков деления урана , плутония , тория в реакторах атомных электростанций .
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов , фотоумножителей . В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой , кальцием , барием , алюминием или серебром , которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной , до коротковолновой ультрафиолетовой области электромагнитного излучения , что делает цезиевые фотоэлементы эффективнее рубидиевых .
Детекторы ионизирующего излучения
Иодид цезия в виде монокристаллов (обычно активированный небольшой примесью таллия ) является одним из наиболее распространённых сцинтилляторов — веществ, конвертирующих энергию ионизирующего излучения в свет. Это связано с высокой эффективностью поглощения гамма-квантов из-за большого атомного номера обоих основных составляющих иодида цезия, а также с высоким световыходом этого сцинтиллятора. Детекторы заряженных частиц и гамма-излучения на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так, например, измерения элементного состава поверхности Марса выполнялись с помощью на основе CsI(Tl), установленного на космическом орбитальном аппарате « Марс-5 ». Недостатком этого сцинтиллятора является некоторая гигроскопичность, из-за которой он может длительно использоваться без герметичной оболочки лишь в достаточно сухом воздухе. Впрочем, его гигроскопичность на порядки ниже, чем у другого распространённого сцинтиллятора — иодида натрия .
Оптика
Иодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты , бутилового спирта , в реакциях дегидрогенизации и при получении муравьиной кислоты . Особенно эффективным является применение цезия как промотора при каталитическом получении аммиака, синтезе бутадиена . В ряде катализаторов оказалось эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга), в частности, используется рутений-цезий-углеродный катализатор. Цезий промотирует действие серебряного катализатора и повышает его селективность при эпоксидировании этилена .
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём ( ).
Радиационная техника
Гамма-излучение цезия-137 используется в гамма-дефектоскопии , измерительной технике и при стерилизации пищевых продуктов (консервы, туши птиц и животных, мяса), а также для стерилизации медицинских препаратов и лекарств, в радиотерапии для лечения злокачественных опухолей. Также цезий-137 используется в производстве радиоизотопных источников тока , где он применяется в виде хлорида цезия (плотность 3,9 г/см³ , энерговыделение около 1,27 Вт/см³ ). Цезий-137 используется в датчиках предельных уровней сыпучих веществ в непрозрачных бункерах.
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении. Его соли, подобно препаратам лития , способны проявлять нормотимический эффект .
Применение цезия в энергетике
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %.
Ввиду того, что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 % и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C среди сплавов.
Прочие области применения цезия
Фторид цезия применяют для пьезоэлектрической керамики , специальных стёкол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена. Атомные переходы в пара́х цезия используются как эталон частоты в атомных часах .
Биологическая роль
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии .
Цезий в живых организмах
Цезий в живых организмах — постоянный химический микроэлемент организма растений и животных. Морские водоросли, например, содержат 0,01—0,1 мкг цезия в 1 г сухого вещества, наземные растения — 0,05—0,2 мкг/г . Животные получают цезий с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г цезия, пресмыкающихся — 0,04 мкг/г , млекопитающих — 0,05 мкг/г . Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л . Цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Цезий-137 — радиоактивный изотоп цезия, испускающий бета-излучение и гамма-кванты , и один из главных компонентов техногенного радиоактивного загрязнения биосферы наряду со стронцием-90 , тритием , криптоном-85 , рутением-106 , европием-154 и -155 , и трансурановыми элементами ( плутоний , кюрий , америций в виде смесей различных относительно долгоживущих изотопов). Продукт деления урана-235 , урана-238 (только на быстрых нейтронах с энергией свыше 1 МэВ ), плутония-239 и других делящихся изотопов. Содержится в радиоактивных осадках, образующихся при применении и испытании ядерного оружия ; некоторых радиоактивных отходах (Далеко не все. Многие отходы, например, химической очистки урана, вовсе не содержат цезия-137, но содержат все члены рядов урана-238 и урана-235: радий , полоний , актиний , протактиний , свинец-210 , и так далее). Интенсивно сорбируется почвой и донными отложениями, очень активно окисляется; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых ( маслята , моховики , свинушка , горькушка , польский гриб ) считается «аккумуляторами» радиоцезия .
Примечания
- , с. 1047—1078.
- ↑ .
- ↑ Справочник химика. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2-й. — 1168 с.
- ↑ .
- . NIST . Дата обращения: 13 марта 2011. 12 марта 2011 года.
- Setterberg C. (нем.) // Justus Liebigs Annalen der Chemie. — 1881. — Bd. 221 , H. 1 . — S. 100–116 . — doi : . 7 декабря 2022 года.
- ↑ .
- . Дата обращения: 31 марта 2016. Архивировано из 15 апреля 2016 года.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- .
- (недоступная ссылка)
- Руководство по неорганическому синтезу. Т. 3. Под ред. Брауэра Г. М.: Мир 1985.
- . Дата обращения: 28 января 2014. 1 февраля 2014 года.
- . Дата обращения: 9 декабря 2010. Архивировано из 19 января 2012 года.
- А. Г. Шишкин. (2003). — Радиоэкологические исследования грибов и дикорастущих ягод. Дата обращения: 27 июля 2009. Архивировано из 22 февраля 2014 года.
Литература
- Перельман Ф. М.. Рубидий и цезий. М., Изд-во АН УССР, 1960. 140 стр. с илл.
- Кульварская Б. С., Соболева Н. А., Татаринова Н. В. Композиционные соединения щелочных металлов — новые эффективные источники ионов и электронов. Изв. АН СССР. Сер. физич.; 1988. Т.52. № 8. С.1509-1512.
- Лидин Р.А. и др. Химические свойства неорганических веществ. — 3-е изд., испр. — Москва: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. - М.-Л.: Химия, 1970.- 407 с
- Солодов Н. А., Рубидий и цезий, М., 1971;
- Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия, М., 1975
- Коган Б. И., Названова В. А., Солодов Н. А., Рубидий и цезий , М., 1971;
- Моисеев А. А., Рамзаев П. В., Цезий-137 в биосфере , М., 1975;
- Редкол.: Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — 783 с. — ISBN 5-85270-310-9 .
-
Audi G.
,
Kondev F. G.
,
Wang M.
,
Huang W. J.
,
Naimi S.
(англ.)
//
. — 2017. —
Vol. 41
,
iss. 3
. —
P. 030001-1—030001-138
. —
doi
:
. —
.

- Mattsson S., Radionuclides in lichen, reindeer and man , Lund, 1972.
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. (англ.) // Pure and Applied Chemistry . — 2013. — Vol. 85 , no. 5 . — doi : .
Ссылки
- . Мировой и российский рынок цезия 2013 . MetalResearch. Металлургические исследования (декабрь 2013). Дата обращения: 31 марта 2016.
- 2021-10-25
- 1





![{\displaystyle {\mathsf {Cs+6NH_{3}\rightarrow [Cs(NH_{3})_{6}]}}}](/images/008/283/8283078/13.jpg?rand=125806)