РНК-интерференция
- 1 year ago
- 0
- 0

Редакти́рование РНК ( англ. RNA editing) — процесс, в ходе которого нуклеотиды в новосинтезированной РНК подвергаются химическим модификациям. Редактирование РНК также может включать вставку , делецию или замену нуклеотидов в молекуле РНК. Редактирование РНК — довольно редкий процесс, и типичные этапы процессинга мРНК ( кэпирование , полиаденилирование , сплайсинг ) обычно не рассматриваются как редактирование.
Редактированию подвергаются некоторые тРНК , рРНК , мРНК и микроРНК у эукариот и поражающих их вирусов , а также прокариот . Редактирование РНК происходит в клеточном ядре и цитозоле , а также в митохондриях и пластидах . У позвоночных редактирование РНК происходит редко и обычно выражается во внесении лишь небольших изменений в молекулу РНК. У некоторых других организмов, напротив, редактирование РНК происходит так интенсивно, что в конечной мРНК остаётся лишь несколько неотредактированных нуклеотидов. Процессы редактирования РНК очень разнообразны и в ходе эволюции появились независимо. Редактирование РНК может приводить к превращению цитидина (C) в уридин (U) и аденозина (A) в инозин (I) в результате дезаминирования , а также присоединению к РНК новых нуклеотидов и удалению уже входящих в её состав. Редактирование РНК может так изменить мРНК, что поменяется аминокислотный состав кодируемого белка и он будет отличаться от полипептида , предсказанного по последовательности гена .

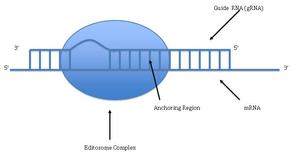
Редактирование РНК путём встраивания или удаления урацилов было описано в митохондриях кинетопластид . Редактирование РНК начинается со спаривания нередактированного транскрипта с направляющей (гидовой) РНК , которая содержит комплементарные последовательности около сайтов встраивания или удаления. Образующийся двуцепочечный участок далее покрывается эдитосомой — крупным многобелковым комплексом , катализирующим редактирование РНК . Эдитосома начинает встраивание уридинов по первому положению неспаренных нуклеотидов. Встраиваемые уридины образуют комплементарные связи с направляющей РНК, и встраивание продолжается, пока в направляющей РНК встречаются A или G, и останавливается при появлении C или U . Встраиваемые нуклеотиды вызывают сдвиг рамки считывания и приводят к тому, что транслируемый белок отличается от кодирующей области гена .
В ходе редактирования происходит разрезание по сайту, где не образуются комплементарные пары между направляющей РНК и нередактированным транскриптом. Следующая стадия катализируется ферментом концевой уридинтрансферазой, которая добавляет U из UTP к 3'-концу мРНК . «Открытые» концы удерживаются другими белками эдитосомного комплекса. Другой фермент, U-специфичная , удаляет неспаренные уридины. После того как эдитосомный комплекс делает последовательность мРНК комплементарной направляющей РНК, РНК- лигаза соединяет концы отредактированной мРНК . Эдитосомный комплекс способен редактировать мРНК лишь в направлении от 3'-конца к 5'-концу . Комплекс способен редактировать только по одной РНК в момент времени. РНК, для которой требуется значительное редактирование, нуждается в нескольких направляющих РНК и нескольких эдитосомных комплексах.
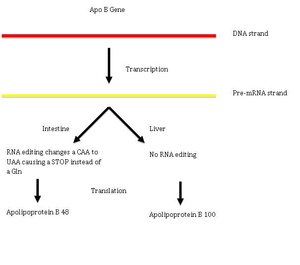
Под действием фермента происходит реакция дезаминирования , превращающая цитидин в урацил. Редактирование C → U может быть рассмотрено на примере гена аполипопротеина B у человека . В печени экспрессируется его изоформа Apo B100, а в кишечнике — apo B48. В клетках кишечника мРНК аполипопротеина B подвергается C → U редактированию, из-за которого кодон CAA превращается в стоп-кодон UAA, и синтезируется изоформа apo B48. Редактирование C → U часто происходит в митохондриальных РНК цветковых растений . У разных растений интенсивность редактирования C → U варьирует: у мха в митохондриальных РНК происходит восемь актов редактирования, а у плауна — около 1700 . Превращение C → U осуществляется семейством белков с пентатрикопептидными повторами ( англ. pentatricopeptide repeat, PPR). Это семейство богато представлено у цветковых растений: так, у Arabidopsis насчитывается 450 белков этого семейства. Белки PPR были описаны также в пластидах и митохондриях .
На долю превращений аденозина в инозин (A → I) приходится около 90 % всех случаев редактирования РНК. Дезаминирование аденозина катализируется ( англ. double-stranded RNA-specific adenosine deaminase, ADAR), которые обычно действуют на предшественников мРНК (пре-мРНК). Дезаминирование аденозина с образованием инозина разрушает спаривание оснований в двуцепочечной РНК (дцРНК), поэтому некоторые двуцепочечные РНК дают начало меньшему количеству малых интерферирующих РНК , чем другие. В дезаминированной дцРНК формируются wobble-взаимодействия между парами оснований, из-за чего молекула приобретает необычную структуру, подавляющую инициацию трансляции . РНК, содержащая пары U — I, привлекает , участвующие в образовании гетерохроматина , кроме того, сайты редактирования A → I часто совпадают с сайтами связывания с микроРНК, что создаёт конкуренцию между двумя процессами . Редактирование A → I активно изучается в связи с концепцией , которая гласит, что химические модификации РНК могут влиять на её функции . Когда в ходе трансляции рибосома встречается с инозином, она распознаёт его как гуанин , хотя некоторые исследования свидетельствуют, что I может считываться как A и U. Кроме того, показано, что рибосома замедляется, когда встречает инозин в мРНК .
Интенсивность редактирования A → I может быть тканеспецифичной , как в случае человека . В числе факторов, влияющих на интенсивность редактирования, называют эффективность сплайсинга пре-мРНК .
В связи с интенсивным развитием технологий высокопроизводительного секвенирования стало возможным создание баз данных , содержащих сведения о редактировании различных РНК. В 2013 году был открыт каталог RADAR (от англ. Rigorously Annotated Database of A-to-I RNA editing), содержащий сайты редактирования A → I, а также данные о таких тканеспецифичных заменах у человека, мыши и дрозофилы . В базу постоянно заносятся новооткрытые сайты редактирования .
В случае гена было описано альтернативное редактирование РНК U → C , кроме того, случаи неканонического редактирования G → A известны для транскриптов K в нормальных и злокачественных клетках толстой кишки . Редактирование G → A было также отмечено, наряду с неклассическим превращением U → C, в транскриптах триптофангидроксилазы 2 в нейронах . Хотя наиболее простым механизмом превращения U → C может быть обратное аминирование , предполагается, что в митохондриальных транскриптах в основе редактирования U → C лежат реакции трансаминирования и трансгликозилирования . В середине 2010-х годов исследование редактирования G → A в транскрипте WT1 показало, что это превращение наиболее активно происходит в двух точках под действием фермента (каталитический полипептид 3A фермента редактирования мРНК аполипопротеина B) .
Многочисленные исследования показали, что в митохондриях растений РНК подвергается только редактированию C → U и, очень редко, U → C . Сайты редактирования находятся преимущественно в кодирующих областях мРНК, интронах и других нетранслируемых областях . Редактирование РНК может быть необходимым для восстановления функциональности молекул тРНК . Хотя сайты редактирования C → U в пластидах и митохондриях изучены относительно хорошо , все белки, образующие соответствующие эдитосомы, ещё не идентифицированы. Показано, что в распознавании сайтов редактирования участвуют члены многочисленного белкового семейства PPR . Для редактирования в некоторых сайтах необходимы белки семейства MORF (от англ. Multiple Organellar RNA editing Factor). Так как некоторые белки семейства MORF взаимодействуют с членами семейства PPR, возможно, что белки MORF входят в состав эдитосомы . Ферменты, ответственные за дезаминирование и трансаминирование в органеллах , ещё не определены, но, возможно, эти реакции осуществляют члены семейства PPR. Редактирование РНК необходимо для нормального клеточного дыхания и трансляции в клетках растений . Редактирование антикодоновой петли может восстанавливать функциональность молекул тРНК .
Некоторые вирусы, такие как возбудители кори , и парагриппа , используют редактирование РНК для получения новых вариантов белков . Вирусные РНК синтезируют кодируемые вирусами РНК-зависимые РНК-полимеразы , которые иногда «запинаются» на определённых сочетаниях нуклеотидов. Остановка РНК-полимеразы может привести к вставке дополнительных гуаниновых или адениноных нуклеотидов. Вставка дополнительных нуклеотидов смещает рамку считывания , что приводит к образованию новых форм белков. Кроме того, к 3'-концу созревающих вирусных мРНК может добавляться до нескольких сотен дополнительных адениновых нуклеотидов, которые стабилизируют мРНК .
Редактирование РНК может выполнять несколько функций. В частности, оно может быть связано с деградацией РНК. В 2008 году было показано, что ADAR и (фермент, участвующий в нонсенс-опосредованном распаде ) взаимодействуют друг с другом и со сплайсосомой , формируя супрасплайсосому, и могут подавлять экспрессию некоторых генов. Подобно альтернативному сплайсингу , редактирование РНК может приводить к появлению новых форм белков за счёт замен, а также появления или удаления сайтов сплайсинга. Редактирование некодирующих РНК может изменить их структуру или привести к новым мутациям в вирусных геномах. Редактирование РНК может также представлять собой механизм защиты от ретротранспозонов .

У истоков редактирования РНК животных могли стоять мононуклеотиддезаминазы, которые дали начало обширным белковым семействам, включающим такие ферменты редактирования РНК, как ADAR и . Последовательности этих генов сближают их с бактериальными дезаминазами, участвующими в метаболизме нуклеотидов. Аденозиндезаминаза кишечной палочки Escherichia coli не может катализировать дезаминирование нуклеозида в РНК: её «карман», в котором и происходит реакция, слишком мал, чтобы вместить целую молекулу РНК. Однако расширение активного сайта наблюдается в человеческих белках APOBEC1 и ADAR, которые могут катализировать дезаминирование РНК . Масштабное редактирование РНК, зависимое от направляющих РНК, такое как вставка нескольких уридиновых нуклеотидов у трипаносом , представляет собой совершенно иную биохимическую реакцию. Ферменты, ответственные за этот процесс, произошли от абсолютно других предшественников . Однако специфичность вставки нуклеотидов, определяемая взаимодействием направляющей РНК с мРНК, схожа с процессом редактирования тРНК, протекающим в митохондриях животных и амёб . Более того, этот процесс схож с метилированием рибозы в рРНК с участием направляющих РНК, которое происходит у всех эукариот .
Кардинально различающиеся пути редактирования РНК свидетельствуют, что они возникали независимо в ходе эволюции . В некоторых источниках редактирование РНК рассматривают как процесс, направленный на устранение дефектов в последовательностях генов или их компенсацию .