Колыванская медь
- 1 year ago
- 0
- 0
| 29 |
Медь
|
|
|
|
| 3d 10 4s 1 | |
Медь ( химический символ — Cu , от лат. Cu prum ) — химический элемент 11-й группы (по устаревшей классификации — побочной подгруппы первой группы, IB) четвёртого периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 29.
В виде простого вещества медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки ).
C давних пор широко используется человеком.
Медь — один из первых металлов , хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото , серебро и железо . Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк . Медный век , когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком . Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий .
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом ( бронзу ) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век .
Первоначально медь добывали из малахитовой руды, а не из сульфидной , так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос ( Эквадор ) ещё в XV — XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков .
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы ), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор , где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи ) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике .
Латинское название меди Cuprum ( древнелат. , ) произошло от названия острова Кипр , где было богатое месторождение.
У Страбона медь именуется , от названия города Халкиды на Эвбее . От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди ( санскр. ayas , готск. aiz , нем. , англ. ) означает руда или рудник.
Медь обозначалась алхимическим символом « ♀ » — « зеркало Венеры », и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера ( Афродита ), являлась богиней Кипра , и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода , им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской . С Гумёшевским рудником Полевского , — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале , — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы , покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры .
Русское слово медь (и медный ) встречается в древнейших русских литературных памятниках: ст.‑слав. *mědь , «медь» не имеет чёткой этимологии, возможно, исконное слово . В. И. Абаев предполагал, что, возможно, слово „ Медь “ произошло от названия страны Мидия : *Мѣдь из иранского Мādа — через посредство греч. Μηδία . Согласно этимологии М. Фасмера , слово «медь» родственно др-герм. smid «кузнец», smîdа «металл» .

Среднее содержание меди в земной коре (кларк) — (0,78-1,5)·10 −4 % (по массе) . В морской и речной воде содержание меди гораздо меньше: 3·10 −7 % и 10 −7 % (по массе) соответственно .
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS 2 , также известный как медный колчедан, халькозин Cu 2 S и борнит Cu 5 FeS 4 . Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu 2 O, азурит Cu 3 (CO 3 ) 2 (OH) 2 , малахит Cu 2 CO 3 (OH) 2 . Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн . Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы . Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае , Жезказган в Казахстане , меденосный пояс Центральной Африки и Мансфельд в Германии . Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси) .
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.

Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием , цезием и золотом , медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку , пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра ). Удельная электропроводность при 20 °C: 55,5—58 МСм /м . Медь имеет относительно большой температурный коэффициент сопротивления : 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком .
Существует ряд сплавов меди: латуни — с цинком , бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = (атом/м³).
Природная медь состоит из двух стабильных изотопов — 63 Cu ( изотопная распространённость 69,1 %) и 65 Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67 Cu с периодом полураспада 62 часа .
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия , гидрометаллургия и электролиз .
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu 2 S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака ; из полученных растворов медь вытесняют металлическим железом:
Электролиз раствора сульфата меди :

В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях ( Cu 2 O , CuCl , CuI и т. п.) или комплексах (например, [Cu(NH 3 ) 2 ] + ). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B 11 H 11 ) 2 3− , полученных в 1994 году.
Не изменяется на воздухе в отсутствие влаги и диоксида углерода . Является слабым восстановителем , не вступает в реакцию с водой и разбавленной соляной кислотой . Окисляется концентрированными серной и азотной кислотами , « царской водкой », кислородом , галогенами , халькогенами , оксидами неметаллов . Вступает в реакцию при нагревании с галогеноводородами .
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода в воздухе:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной соляной кислотой в присутствии кислорода:
C разбавленной соляной кислотой в присутствии перекиси водорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов :
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
Медный порошок реагирует с хлором , серой (в жидком сероуглероде ) и бромом (в эфире), при комнатной температуре:
С йодом (йодида меди(II) не существует):
При 300—400 °C реагирует с серой и селеном :
C оксидами неметаллов:
С концентрированной соляной кислотой и хлоратом калия :
С хлоридом железа(III):
Вытесняет менее активные металлы из их солей:
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl , CuBr и CuI нерастворимы. Также присутствую не растворимые в воде комплексы(например, дихлорокупрат(I)-ион [CuCl 2 ] − устойчив:
Следует обратить внимание на то, что сульфат меди(I) нестабилен Он мгновенно разлагается и переходит в устойчивый сульфат меди(II) .
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют :
Примером диспропорционирования может служить реакция оксида меди(I) с разбавленной серной кислотой:
Степени окисления +1 соответствует оксид Cu 2 O красно-оранжевого цвета, который разлагается при температуре 1800°С:
Можно восстановить до элементарной меди:
Также протекает процесс алюминотермии :
Реагирует с концентрированными растворами щелочей:
С концентрированной соляной кислотой:
С разбавленными галоген кислотами(Hal = Cl , Br , I ):
С разбавленной соляной кислотой в присутствии кислорода:
С концентрированной азотной кислотой:
С концентрированной серной кислотой:
С разбавленной серной кислотой:
С гидросульфитом натрия:
С аммиаком:
С раствором аммиака:
С азотистоводородной кислотой в разных условиях при охлаждении:
С серой:
С Сульфидом меди(I):
С кислородом:
С хлором:
С оксидами щелочных металлов(Ме = Li , Na , K , Rb , Cs ):
С оксидом бария :
Соответствующий гидроксид CuOH (жёлтого цвета) разлагается при температуре 100°С с образованием оксида меди(I).
Гидроксид CuOH проявляет основные свойства.
Также реагирует с раствором аммиака:
Реагирует с гидроксидом калия:
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует оксид CuO чёрного цвета, который разлагается при температуре 1100 °С:
Реагирует с раствором аммиака с образованием Реактива Швейцера :
Растворяется в концентрированных щелочах с образованием комплексов:
При сплавлении с щелочами образуются купраты металлов:
С азотной кислотой:
Реагирует с йодоводородной кислотой с образованием йодида меди(I), так как йодида меди(II) не существует :
Протекают процессы магниетермии и алюминотермии:
Также можно восстановить до элементарной меди следующими способами:
Оксид меди(II) используются для получения оксида иттрия бария меди (YBa 2 Cu 3 O 7-δ ), который является основой для получения сверхпроводников .
Соответствующий гидроксид Cu(OH) 2 (голубого цвета), который при длительном стоянии разлагается, переходя в оксид меди(II) чёрного цвета:
Также в избытке влаги возможно окисление меди, и переход в гидроксид куприла, в котором степень окисления меди +3:
При нагревании до 70 °С разлагается:
Реагирует с растворами концентрированных щелочей с образованием гидроксокомплексов синего цвета (это подтверждает преимущественно основный характер Cu(OH)_2):
С образованием солей меди(II) растворяется во всех кислотах(в том числе кислотах окислителях) кроме йодоводородной :
Реакция с йодоводородной кислотой отличается тем, что образуется йодид меди(I), так как йодида меди(II) не существует:
Реакция с водным раствором аммиака является из важных в химии, так как образуется реактив Швейцера (растворитель целлюлозы ):
Также суспензия гидроксида меди реагирует с углекислым газом с образованием дигидроксокарбонатом меди(II) :
Большинство солей двухвалентной меди имеют синюю или зелёную окраску. При растворении солей меди(II) в воде образуются голубые аквакомплексы [Cu(H 2 O) 6 ] 2+ . Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга). Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды

Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO 4 ∙5H 2 O, используется как фунгицид .
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Имеются данные о получении сесквиоксида Cu 2 O 3 , также известны различные купраты (III), как в виде смешанных оксидных систем с другими металлами, например, серебром – Ag 2 Cu 2 O 4 , так и координационных соединений; наличие у меди конфигурации d 8 в этих соединениях является дискуссионной .
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.

Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки , при внесении в него платиновой проволочки, смоченной исследуемым раствором.
Из-за низкого удельного сопротивления (уступает лишь серебру , удельное сопротивление при 20 °C: 0,01724—0,0180 мкОм·м/ ), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже . Медные провода, в свою очередь, также используются в обмотках электроприводов ( быт: электродвигателях ) и силовых трансформаторов . Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость . Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 % .


Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления , компьютерных кулерах , тепловых трубках .
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения , отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 , а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.


В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь . Оба сплава являются общими названиями для целого семейства материалов, в которые, помимо олова и цинка , могут входить никель , висмут и другие металлы . Например, в состав пушечной бронзы , использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз , благодаря технологичности и высокой пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Медь и её сплавы латунь и бронза обладают высокой коррозионной стойкостью, электро- и теплопроводностью, антифрикционными показателями. При этом медь хорошо сваривается и обрабатывается резанием.
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав ( мельхиор ) используются для чеканки разменной монеты .
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости. Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.

Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Оксиды меди используются для получения оксида иттрия-бария-меди ( купрата ) YBa 2 Cu 3 O 7-δ , который является основой для получения высокотемпературных сверхпроводников . Медь применяется для производства медно-окисных гальванических элементов и батарей.
Медь — самый широко употребляемый катализатор полимеризации ацетилена . Из-за того, что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 .
Медь может быть использована для снижения переноса инфекции в лечебных учреждениях через поверхности, к которым прикасается рука человека. Из меди могут быть изготовлены ручки дверей, водозапорной арматуры, перила, поручни кроватей, столешницы .
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм .
Также медь применяется в пиротехнике для окрашивания в синий цвет. [ источник не указан 1159 дней ]
По объёму мирового производства и потребления металлов медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т . Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы , на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов . Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Выплавка меди в 2019 ожидается 25,5 млн т .
Объём мирового потребления меди в 2023 году, по последним оценкам компании « Норникель », составит 25,4 млн тонн (рост на 2 % по отношению к прошлому году). В то же время «Норникель» прогнозирует объем добычи меди в 2023 году в размере 22,4 млн тонн (рост на 2 % год к году). Объем дефицита рынка прогнозируется на уровне 160 тыс. тонн.
Лидеры производства:
Запасы и добыча в России: см. Добыча полезных ископаемых в России#Медь . Производство рафинированной меди в России в 2006 году составило 881,2 тыс. т, потребление — 591,4 тыс. т .
Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг « Металлоинвест », выкупивший права на разработку нового месторождения меди « Удоканское » . Мировое производство меди в 2007 году составляло 15,4 млн т, а в 2008 году — 15,7 млн т.
Сейчас известно более 200 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили ). В зависимости от глубины залегания, руда добывается открытым или закрытым методом .
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах .
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в карьере медного рудника.
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долларов в феврале 2011 года .
На 2011 год стоимость меди составляла около 8900 долларов за тонну . Вследствие кризиса мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышала 4700 долларов .
В мае 2021 года цена меди на Лондонской бирже металлов (LME) взлетела до 10 307 долл. за тонну . Пиковая цена зафиксирована в середине октября 2021 — стоимость контракта на одну тонну меди с поставкой через 3 месяца в моменте превышала 10 тыс. долл. .

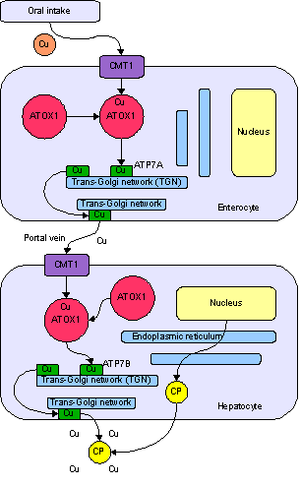
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином . После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов , например, в цитохром-с-оксидазе , в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине . В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте , поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей .
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная организация здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта .
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь . Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла . Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин -устойчивого штамма стафилококка золотистого , известного как «супермикроб» MRSA . Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/ H1N1 (т. н. « свиной грипп ») .
Излишняя концентрация ионов меди придаёт воде отчётливый « металлический вкус ». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг / л . Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.