Interested Article - Гигантские вирусы

- 2020-08-29
- 1
Гигантские вирусы ( англ. Giant viruses ) — группа очень крупных вирусов , которые можно рассмотреть под световым микроскопом ; по размерам не уступают бактериям , из-за этого сначала были отнесены к грамположительным бактериям . Их геномы чрезвычайно велики и часто содержат гены , кодирующие компоненты синтеза белка , что никогда не наблюдается у остальных вирусов; кроме того, некоторые гены, выявленные у представителей этой группы вирусов, неизвестны ни для каких иных организмов. Большинство гигантских вирусов имеют белковый капсид , характерный для остальных вирусов, однако некоторые гигантские вирусы окружены особым тегументом (белковой оболочкой). Как правило, гигантские вирусы поражают протистов . На некоторых гигантских вирусах паразитируют вирофаги . Считается, [ кем? ] что для человека гигантские вирусы безвредны, однако появляется [ где? ] всё больше фактов, свидетельствующих об обратном [ источник не указан 606 дней ] .
По данным ICTV на 2018 год, признаны два семейства гигантских вирусов — Mimiviridae и Marseilleviridae .
Иногда по отношению к гигантским вирусам используют термин «гирусы» .
История изучения
История изучения гигантских вирусов началась в 1992 году в Англии . Изучая причины возникновения вспышки пневмонии , учёные исследовали образцы воды, взятые из воздухоохлаждающей системы. Образцы некоторое время инкубировали вместе с культурой амёб , чтобы выявить патогенные микроорганизмы , похожие на бактерий рода Legionella , которые обитают внутри амёб. Исследователи смогли обнаружить неизвестный патоген, который был видим в световой микроскоп и красился по Граму положительно , в связи с чем и был отнесен к бактериям. Однако новооткрытую бактерию никак не удавалось вырастить в чистой культуре без амёб. В течение более чем десяти лет попытки классифицировать новую бактерию не давали результатов. Стандартный способ определения новых видов бактерий и архей основан на размножении с помощью полимеразной цепной реакции (ПЦР) участка генома , кодирующего 16S рРНК , и его последующем секвенировании . Однако получить этот участок генома неизвестной бактерии никак не удавалось, несмотря на использование разнообразных протоколов ПЦР. В 2003 году неизвестный микроорганизм изучила с помощью электронной микроскопии французская исследовательская группа Дидье Рауля . Оказалось, что это не бактерия, а очень крупный вирус с икосаэдрическим капсидом. За свое сходство с микроорганизмами новый вирус получил название «мимивирус» (от англ. mimicking microbes — «похожий на микроорганизмы»). С самого открытия вирусов в конце XIX века было принято считать, что вирусы невозможно рассмотреть с помощью светового микроскопа, поэтому открытие мимивируса противоречило устоявшимся догмам вирусологии . Генов 16S рРНК у мимивируса не было просто потому, что у вирусов не бывает рибосом .
После открытия мимивируса множество исследовательских групп начали инкубировать культуры амёб с различными образцами из окружающей среды, и по прошествии некоторого времени во многих случаях в культуре обнаруживали очень крупные вирусы. Появилось множество усовершенствований первоначального протокола, делающих его всё более и более эффективным. Впоследствии учёные стали выращивать вирусы не только в культурах амёб, но и в культурах других протистов . Одних видов мимивирусов на данный момент известно около сотни. Гигантские вирусы были обнаружены даже в образце сибирской вечной мерзлоты . В последние годы несколько гигантских вирусов удалось обнаружить с помощью метагеномики . В 2008 году был открыт первый вирофаг ( Спутник ) — вирус, который может размножаться в клетках только в присутствии вируса-хозяина (как правило, гигантского вируса) и мешает его успешному размножению. На данный момент известно более десяти видов вирофагов .
Общая характеристика
Под гигантскими вирусами обычно понимают вирусы с геномом длиннее 200 тысяч пар оснований (п. о.) и вирионами больше 0,2 мкм в диаметре . Кроме того, гигантским вирусам присущ ряд общих генетических и структурных особенностей. Во-первых, их геномы всегда представлены двухцепочечной ДНК и содержат значительную долю генов-сирот — от 31 % у Cedratvirus до 84 % у . Генами-сиротами называют гены, которые больше не обнаруживаются ни у каких живых организмов (в англоязычных источниках их называют ORFans из-за игры слов: ORF (open reading frame) — открытая рамка считывания , а слово ORFan звучит как orphan — «сирота»). Во-вторых, в их геномах имеются интроны и (участки белковых молекул , которые могут сами вырезаться и сращивать концы разрыва), а также мобильные генетические элементы ( у мимивирусов и MITEs у Pandoravirus salinus ) .
Самым главным отличием гигантских вирусов от остальных вирусов является то, что в их геномах закодированы молекулы, принимающие участие в трансляции : аминоацил-тРНК-синтетазы , факторы трансляции и тРНК . Таких генов нет только у Pithovirus sibericum . Представители родов Marseillevirus , Pithovirus , Faustovirus , Kauamoebovirus и Cedratvirus не имеют генов, кодирующих тРНК. Гигантских вирусов сближают и некоторые особенности структуры. Например, вирионы мимивируса и Marseillevirus снабжены особыми фибриллами. Для выхода генетического материала в цитоплазму амёбы у гигантских вирусов имеются поры, находящиеся в вершинах капсидов или тегументов. У тех гигантских вирусов, вирионы которых покрыты настоящим капсидом, в его мажорном белке имеется особый мотив , известный как двойной . Он имеется только у белков капсидов вирусов с двухцепочечным геномом и нигде более в живом мире. Такие белки формируют олигомеры по типу черепицы, в конечном итоге собираясь в замкнутую белковую оболочку . У Faustovirus с двуслойным капсидом мотив jelly-roll обнаруживается только у белков верхнего слоя .
Таксономическое положение гигантских вирусов ещё не до конца определено, и многие недавно описанные виды, роды и даже семейства гигантских вирусов ещё не получили официального признания Международным комитетом по таксономии вирусов ( англ. International committee on virus taxonomy , ICTV). Пока ICTV признал два семейства гигантских вирусов: и . В 2012 году было предложено [ кем? ] объединить гигантских вирусов и NCLDV в новый порядок — Megavirales . В порядок Megavirales хотят включить Mimiviridae , Marseilleviridae , , Iridoviridae , , асфаровирусы и поксвирусы .
Разнообразие
Mimiviridae

Вирион мимивируса, первого открытого представителя семейства Mimiviridae , состоит из икосаэдрического капсида размером 500 нм и покрывающих его фибрилл длиной 75 нм . Эти фибриллы имеют уникальное для вирусов строение и позволяют вириону прикрепляться к клеткам бактерий , членистоногих и грибов . Спустя год после описания мимивируса его геном был секвенирован . Оказалось, что геном мимивируса представлен кольцевой двухцепочечной ДНК длиной 1,2 миллиона п. о., в которой, предположительно, находятся 979 генов. Некоторые из них, такие как гены белков трансляции (аминоацил-тРНК-синтетаз и факторов трансляции), раньше никогда не находили в вирусных геномах. В целом гены мимивируса можно разделить на четыре группы:
- кóровые гены;
- гены, приобретённые с помощью горизонтального переноса ;
- дуплицированные гены ( паралоги );
- гены-сироты .
К коровым генам относят гены, имеющиеся также у так называемых ядерно-цитоплазматических крупных ДНК-содержащих вирусов (NCLDCV) — вирусов, которые до открытия мимивируса считались самыми большими. В геноме мимивируса обнаруживаются последовательности, позаимствованные у бактерий, эукариот , архей и других вирусов. Однако абсолютное большинство генов мимивируса — сироты, для которых во всех базах данных нет гомологов . В вирионе мимивируса, кроме геномной ДНК, содержится некоторое количество мРНК .
Сейчас мимивирус и близкие к нему вирусы выделяют в семейство Mimiviridae , подразделяющееся на три линии: А, В и С. К линии А относятся такие вирусы, как мимивирус и амёбы , к линии В относится Acantamoeba polyphaga , а представителем линии С может служить Megavirus chiliensis . Некоторых представителей Mimiviridae не удалось отнести ни к одной из перечисленных линий, как, например, (CroV), поражающий протиста .
Marseilleviridae
Через шесть лет после открытия мимивируса был описан ещё один гигантский вирус, поражающий амёб. Как и мимивирус, его обнаружили в воде из воздухоохлаждающего сооружения, но на этот раз в Париже . Новый вирус получил название Marseillevirus . Его вирион мельче вириона мимивируса и имеет икосаэдрический капсид размером 250 нм . Геном Marseillevirus представлен кольцевой двухцепочечной ДНК, в которой находятся 457 генов , значительно отличающихся от генов мимивируса. Среди них есть два гена, кодирующие гистоноподобные белки. Однако среди генов Marseillevirus можно выделить всё те же четыре основные группы — коровые гены, гены-паралоги, горизонтально приобретённые гены и гены-сироты. Как и у мимивируса, в геноме Marseillevirus есть гены, полученные от эукариот (в том числе амёбы-хозяина), бактерий, архей и вирусов, в том числе и гигантских. Предполагается, что такая высокая степень мозаицизма генома обусловлена интенсивным обменом генами с другими организмами, обитающими в цитоплазме амёбы-хозяина .
В 2011—2014 годах в образцах воды из разных частей света были обнаружены четыре вируса, родственных Marseillevirus . Кроме того, один родственный вирус нашли в Тунисе в насекомом , а ещё один родственник Marseillevirus — в кале здорового человека в Сенегале , что стало первым прецедентом обнаружения гигантских вирусов в образцах человеческого происхождения. Marseillevirus и родственные ему вирусы выделяют в семейство Marseilleviridae .
Pandoravirus
В 2013 году были описаны два новых гигантских вируса, получивших названия Pandoravirus salinus и . Эти организмы были известны давно, но, как в случае с мимивирусом, их вирусная природа была установлена далеко не сразу. В заблуждение, как и в случае с мимивирусом, ввёл необычный размер: их вирионы достигают около 1 мкм в длину и 0,5 мкм в диаметре. Размер их генома составляет 1,9 и 2,5 миллиона п.о. соответственно, что на данный момент является абсолютным рекордом среди вирусов. Подавляющее большинство генов Pandoravirus (84 % для P. salinus ) являются генами-сиротами. У Pandoravirus имеются свои уникальные транспозоны , известные как (от англ. miniature inverted repeat transposable elements — «миниатюрные мобильные элементы с инвертированными повторами») .
До 2017 года считалось, что для вирусов рода Pandoravirus характерно полное отсутствие в их геноме генов, гомологичных каким-либо генам, кодирующим белки капсида. По этой причине у них нет капсида и какой-либо структуры, хотя бы отдалённо на него похожей. Их вирионы окружены особым чехлом (тегументом) толщиной около 70 нм , и на его верхушке имеется пора, через которую содержимое вириона попадает в цитоплазму амёбы. В 2017 году у Pandoravirus был идентифицирован ген, который может кодировать белок капсида. Кроме того, другие вирусные черты в полной мере присущи Pandoravirus : как и все вирусы, они размножаются в клетках и покидают их в виде вирионов, а в их геномах отсутствуют гены, кодирующие компоненты рибосом и белки, связанные с клеточным делением .
В 2015 году был описан третий вид рода Pandoravirus — Pandoravirus inopinatum . Его геном содержит 2,24 миллиона п. о. и на 85 и 89 % совпадает с геномами P. salinus и P. dulcis соответственно. В 2018 году сообщалось об открытии ещё трёх видов рода — Pandoravirus quercus , Pandoravirus neocaledonia , Pandoravirus macleodensis . Предложено также выделить род Pandoravirus в собственное семейство Pandoraviridae .
Pithovirus

В 2013 году был открыт вирус, по сей день считающийся самым крупным вирусом, — Pithovirus sibericum . Его выделили из образца сибирской вечной мерзлоты возрастом более 30 тысяч лет при помощи культивирования в клетках амёбы Acanthamoeba castellanii . Внешне его вирионы похожи на вирионы Pandoravirus , но существенно крупнее — их длина может достигать 1,5 мкм , что на данный момент является абсолютным рекордом в вирусном мире. Как и у Pandoravirus , вирионы Pithovirus окружены тегументом толщиной 60 нм с апикальной порой в форме правильного шестиугольника . Типичного капсида у Pithovirus тоже нет, однако в геноме этого вируса нашёлся ген, отдалённо похожий на ген, кодирующий белок капсида у представителей семейства Iridoviridae . По составу генов Pithovirus наиболее близок к Marseilleviridae и Iridoviridae . Более одной пятой генома Pithovirus представлено регулярно расположенными копиями одного и того же некодирующего повтора .
Поскольку первый Pithovirus выделили из очень древнего образца, высказывали предположения, что Pithovirus давно вымерли. Однако в 2016 году нашли ещё один Pithovirus — Pithovirus massiliensis — в образце сточных вод с юга Франции . Удивительно, но, несмотря на колоссальный размер вирионов Pithovirus , их геномы не так уж и велики: размер генома P. sibericum составляет около половины генома мимивируса .
Mollivirus
В 2014 году из того же образца вечной мерзлоты, что и Pithovirus , был выделен ещё один гигантский вирус — Mollivirus sibericum . Как и Pithovirus , он размножается в амёбах Acanthamoeba castellanii . Сферический вирион молливируса достигает 500—600 нм в диаметре и заключает в себе геном длиной 625 тысяч п. о. В вирионы, помимо вирусного генома, упаковываются многие белки амёбы, в том числе . Генетически молливирус, хотя и весьма отдалённо, наиболее близок к Pandoravirus .
Faustovirus

Помимо амёб рода , в качестве клеток для выделения гигантских вирусов используют амёбу — наиболее типичную для человеческих фекалий и образцов больничной воды. С помощью этой амёбы в 2015 году из сточных вод выделили ещё один гигантский вирус — Faustovirus . Его капсид имеет форму икосаэдра и состоит из двух белковых слоёв, а не одного, как у большинства вирусов. Впоследствии вирусы рода Faustovirus обнаружили в разных частях света, но во всех случаях их выявляли только в сточных водах, благодаря чему они могут служить индикатором загрязнения воды фекалиями. Среди гигантских вирусов и NCLDVs ближайшими родственниками Faustovirus являются Asfarviridae — патогены свиней , однако геном Faustovirus в три раза крупнее геномов Asfarviridae . Геномы Faustovirus достигают 456—491 тысяч п. о. и содержат 457—519 генов. Любопытно, что гены, кодирующие белки капсида, разбросаны по участку длиной 17 тысяч п. о., поэтому эти гены могут подвергаться интенсивному сплайсингу . До этого в вирусном мире сплайсинг был описан только у аденовирусов и у гена белка капсида мимивируса .
Kaumoebavirus
Использование V. vermiformis для культивации вместе с различными пробами из окружающего мира позволило описать ещё одну группу гигантских вирусов, известную как Kaumoebavirus . Как и Faustovirus , они выделены из образцов сточных вод и не имеют близких родственников среди известных вирусов. Наиболее близки к Kaumoebavirus вирусы рода Faustovirus и семейства Asfaviridae . Капсид имеет икосаэдрическую форму. Гены белков капсида разбросаны по участку длиной 5 тысяч п. о. По размеру генома Kaumoebavirus наиболее близок к Marseillevirus .
Cedratvirus
В 2016 году в образце воды из Алжира с помощью амёбы обнаружили новый гигантский вирус — Cedratvirus . Из известных на данный момент вирусов к нему наиболее близок Pithovirus , хотя лишь одна пятая генов Cedratvirus похожа на гены Pithovirus . От других гигантских вирусов Cedratvirus отличается наличием двуслойных покровов. На ранних стадиях инфекции вирионы покрыты тегументом толщиной 40 нм , а у зрелых вирионов его толщина составляет 55 нм . Содержимое вириона попадает в цитоплазму через апикальную пору. Размер генома Cedratvirus близок к таковому у Pithovirus . Ещё один представитель рода Cedratvirus описан в 2017 году. В геномах обоих отсутствуют некодирующие повторы, которые так обильно представлены в геноме Pithovirus .
Pacmanvirus
Pacmanvirus был описан в 2017 году с помощью амёбы A. castellanii . Свое название эти вирусы получили за форму капсида, наблюдаемую при негативном окрашивании в электронный микроскоп : он похож на главного героя одноименной видеоигры Pac-Man . Pacmanvirus очень быстро размножается, и уже через 8 часов после заражения наступает лизис клеток амёб. По размеру вирионов и геномов Pacmanvirus близок к Kaumoebavirus и Faustovirus , а наиболее близкими родственниками Pacmanvirus являются Faustovirus , Asfaviridae и Kaumoebavirus .
Tupanvirus
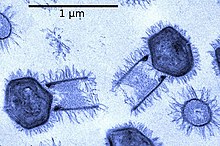
В феврале 2018 года было объявлено об открытии двух близкородственных гигантских вирусов, получивших названия Tupanvirus Soda Lake и Tupanvirus Deep Ocean согласно происхождению проб воды, из которых они были выделены. Они могут заражать амёб A. castellanii и V. vermiformis . Капсиды Tupanvirus по размеру примерно соответствуют мимивирусным (около 450 нм ), однако они также имеют длинный цилиндрический хвост длиной около 550 нм , прикреплённый к основанию капсида. Ни у одного из известных на данный момент вирусов нет таких крупных придатков капсида .
Геном Tupanvirus представлен линейной двухцепочечной ДНК длиной около 1,5 млн п. о. В геноме содержится 1200—1400 открытых рамок считывания, из которых около 380 являются генами-сиротами. Виды рода Tupanvirus — абсолютные рекордсмены среди вирусов по количеству кодируемых компонентов трансляции. По сути, для полного набора им не хватает только рибосом. Они имеют гены около 20 аминоацил-тРНК-синтетаз, 70 тРНК , причем у Tupanvirus Deep Ocean есть даже тРНК для редкой аминокислоты пирролизина , восьми факторов инициации трансляции , одного фактора элонгации и одного фактора терминации , а также ряда вспомогательных белков, участвующих в трансляции. Ближайшие родственники Tupanvirus — мимивирусы, причём настолько близкие, что род Tupanvirus предполагается включить в семейство Mimiviridae .
Medusavirus
В 2019 году было объявлено об открытии нового гигантского вируса, поражающего амёбу A. castellanii , из воды горячего источника в Японии . Новый вирус получил название Medusavirus . Он имеет икосаэдрический капсид диаметром 260 нм , несущий необычные придатки со сферическими наконечниками. Геном представлен двуцепочечной молекулой ДНК длиной 381 тыс. п. о., в нём закодирован 461 предполагаемый белок. Между Medusavirus и амёбой-хозяином имели место многочисленные акты горизонтального переноса генов в обоих направлениях. Благодаря им в геноме Medusavirus появились гены, кодирующие все пять гистонов и эукариотическую ДНК-полимеразу , а в геноме A. castellanii обнаруживаются гены, кодирующие белки капсида. Морфологически и филогенетически Medusavirus весьма далёк от остальных гигантских вирусов, поэтому первооткрыватели предложили выделить его в собственное семейство Medusaviridae .
Жизненные циклы
Большинство известных на данный момент гигантских вирусов поражает амёбы рода Acanthamoeba . Однако неизвестно, есть ли у них другие хозяева. Эти амёбы питаются самыми разнообразными микроорганизмами : бактериями, дрожжами и другими грибами, вирусами и водорослями , поэтому в их цитоплазме находится много чужеродной ДНК. Вероятно, мозаицизм геномов гигантских вирусов обусловлен интенсивным горизонтальным переносом генов от «соседей по клетке». Некоторые гигантские вирусы описаны у другого вида амёб — V. vermiformis . Ряд далёких родственников мимивирусов заражает морских жгутиконосцев и одноклеточные водоросли. Попытки использовать для выращивания гигантских вирусов клетки, отличные от амёб, пока не увенчались успехом .
Однако имеются некоторые свидетельства, что гигантские вирусы могут обитать не только в амёбах. Например, эксперименты показали, что мимивирусы могут проникать в фагоцитирующие клетки ( моноциты и макрофаги ) человека и мыши , а у мышей даже описали мимивирусную инфекцию, затронувшую макрофаги. Показано также, что мимивирус может размножаться в одноядерных периферических кровяных клетках человека, стимулируя выделение и подавляя экспрессию генов , стимулируемых интерфероном , в этих клетках. Кроме того, вирусы рода Marseillevirus могут проникать в иммортализованные человеческие Т-лимфоциты , и их даже удалось обнаружить в макрофагах из лимфоузлов .
Жизненный цикл гигантских вирусов длится от 6 до 24 часов. Как правило, вирусы оказываются в клетке посредством фагоцитоза , однако вирусы рода Marseillevirus могут попадать в цитоплазму при помощи эндоцитоза . Этим гигантские вирусы значительно отличаются от остальных вирусов, которые проникают в клетку после взаимодействия с рецепторами на её поверхности. После попадания вириона в цитоплазму его внутренняя мембрана , залегающая под капсидом, сливается с мембраной везикулы , и содержимое вириона изливается в цитоплазму. После этого начинается формирование вирусных фабрик — особых зон цитоплазмы, где проходят репликация вирусной ДНК и сборка вирусных частиц. Нередко при инфицировании гигантскими вирусами изменяется и морфология ядра . В клетках, заражённых Pandoravirus или Mollivirus , наблюдаются впячивания ядерной оболочки , а в случае Mollivirus вирусные фабрики даже попадают в ядро. По сути, вирусная фабрика становится функциональным ядром клетки, заражённой вирусом (вироклетки) .
Сборка вирионов у гигантских вирусов происходит по-разному. В случае мимивирусов образование внутренней мембраны, сборка капсида, упаковка ДНК и сборка фибрилл происходят последовательно и сопровождаются перемещением вирионов из центра вирусной фабрики к её краям. У Pandoravirus и Mollivirus сборка оболочки и внутреннего содержимого вириона происходят одновременно. Выход вирионов гигантских вирусов сопровождается лизисом клетки амёбы, и только вирионы Mollivirus покидают клетку посредством экзоцитоза .
Судя по наличию в геномах гигантских вирусов генов, кодирующих белки транскрипции и трансляции, в плане репликации они в той или иной мере независимы от клетки-хозяина. Впрочем, Pandoravirus , Mollivirus и один из Marseilleviridae лишены белков, связанных с транскрипцией, поэтому для их репликации всё-таки необходимо ядро амёбы. В случае одного представителя Marseilleviridae транскрипция начинается в вирусной фабрике, но, по-видимому, за счёт привлечения транскрипционного аппарата клетки-хозяина .
Вирофаги

Вместе с открытием нового члена семейства мимивирусов, [ дата? ] Mamavirus , был открыт первый вирофаг — вирус, размножение которого зависит от вируса-хозяина. В вирусных фабриках мамавируса обнаружили маленькие икосаэдрические вирионы, не похожие на вирионы Mamavirus . Новый вирус получил название «вирофаг Спутник» .
Геномы вирофагов представлены кольцевой ДНК длиной от 17 до 29 тысяч п. о. и содержат 16—34 гена, из которых некоторые гомологичны генам гигантских вирусов. После Спутника описали ещё несколько вирофагов, размножающихся при участии мимивирусов всех трёх линий (А, В и С). Был описан вирофаг, который мог паразитировать только на мимивирусах линий В и С; мимивирусы линии А были к нему устойчивы. Этот вирофаг получил название Замилон . При этом в геноме мимивирусов линии А нашли последовательности, принадлежащие Замилону. Образуемый ими кластер получил название MIMIVIRE (от англ. mimivirus virophage resistant element ), и вначале считалось, что принцип его работы схож с работой бактериальных систем CRISPR /Cas, обеспечивающих защиту от бактериофагов . Тем не менее последние исследования говорят о том, что MIMIVIRE не имеет к CRISPR/Cas никакого отношения. Любопытно, что копии геномов вирофагов обнаружены в геноме морской хлорарахниофитовой водоросли .
Гигантские вирусы страдают не только от вирофагов. В 2012 году в геноме одного из мимивирусов были найдены мобильные генетические элементы, получившие название «трансповироны». Трансповироны состоят из семи тысяч п. о. и содержат 6—8 белоккодирующих генов, а на их концах находятся длинные . Все трансповироны кодируют белки, содержащие хеликазный домен I типа и домен с цинковыми пальцами типа Cys2His2 (C2H2). По-видимому, для размножения трансповироны используют как собственные белки, так и белки вируса-хозяина. Трансповироны выявляются даже в геномах вирофагов, вставленных в геном водоросли B. natans . Как уже было упомянуто, мобильные генетические элементы (известные как MITEs) выявлены в геноме Pandoravirus salinus . Как и трансповироны, они имеют концевые инвертированные повторы, но не кодируют никаких белков .
Положение в системе живого мира
Одной из самых необычных черт, отделяющих гигантские вирусы от прочих вирусов, является наличие генов, продукты которых задействованы в трансляции. У Tupanvirus имеется даже полный комплект белков и РНК, необходимых для трансляции, кроме компонентов рибосом. Французский микробиолог Дидье Рауль (впервые изучивший мимивирус) высказал предположение, что гигантские вирусы возникли как результат эволюционной редукции древней клетки и представляют собой четвёртый домен жизни, наряду с археями, бактериями и эукариотами. Возможно, что во время возникновения гигантских вирусов на Земле обитали несколько независимо возникших линий клеточных организмов, из которых до наших дней дожила одна, а гигантские вирусы могут быть потомками одной из вымерших линий .
Однако в строгом смысле слова гигантские вирусы не могут являться доменом, поскольку разделение клеточных организмов на три домена было осуществлено путём сравнения генов рРНК , которых у гигантских вирусов нет. Поэтому в 2013 году Дидье Рауль предложил отказаться от системы трёх доменов и перейти к системе четырёх TRUC — аббревиатура от Things Resisting Uncompleted Classification (с англ. — «сущности, не поддающиеся незавершённой классификации»). Таким образом всю земную жизнь можно подразделить на четыре TRUC — эукариоты, бактерии, археи и гигантские вирусы. При этом остальные вирусы по-прежнему остаются вне системы живого мира. Выделение гигантских вирусов в отдельную ветвь жизни скептически встретил американский биолог Евгений Кунин , который считает, что обособление гигантских вирусов связано с ошибками реконструкции филогении , а большое число генов, общих с клеточными организмами, есть результат горизонтального переноса .
Гигантские вирусы являются микроорганизмами , так как микроорганизмы, по определению, — это организмы, различимые в световой микроскоп, что в полной мере относится к гигантским вирусам .
Гигантские вирусы и происхождение эукариот
Тот факт, что вирусная фабрика гигантских вирусов, по сути, является ядром заражённой клетки (вироклетки), наводит на мысль, что эволюция гигантских вирусов и эволюция эукариот могут быть тесно связаны. Сходство вирусной фабрики и клеточного ядра отнюдь не поверхностно: обе структуры залегают в цитоплазме, и часто вирусные фабрики окружают себя мембранами эндоплазматического ретикулума , которые служат источником мембран для вирионов. У многих NCLDVs вирусные фабрики собираются вблизи центра организации микротрубочек , который задействован в делении ядра. С помощью атомно-силовой микроскопии было показано, что вирусные фабрики также образуются при слиянии везикул, произошедших от впячивания ядерной оболочки. Наконец, Mollivirus и отчасти Pandoravirus используют в качестве вирусной фабрики само ядро, а в роли источника для внутренних мембран вирионов — ядерные мембраны .
Можно предположить, что клеточное ядро произошло от вирусной фабрики древнего NCLDV, размножавшегося в протоэукариотической клетке. После этого вирусный геном слился с геномом протоэукариотической клетки и утратил способность к формированию вирионов, навеки став частью эукариотического генома .
Предлагался и другой сценарий, согласно которому гигантские вирусы, наоборот, произошли от ядра древней эукариотической клетки. Можно предположить, что клеточное ядро стало вирусной фабрикой, после того как в нём появились гены, необходимые для формирования вирионов. Впрочем, неясно, каким образом в вирион могла упаковаться целая хромосома .
Согласно третьей гипотезе, клеточное ядро появилось в качестве защитной структуры в результате взаимодействия протоэукариотической клетки с вирусом. Ядро давало возможность обезопасить репликацию и транскрипцию генома клетки от действия вируса, однако в ходе эволюции большинство вирусов научилось преодолевать эту преграду .
Взаимодействие с человеком
Судя по всему, гигантские вирусы распространены в природе очень широко: их удалось обнаружить в пробах морской и пресной вод, а также в образцах почв , собранных по всему миру. Их амёбы-хозяева также распространены очень широко и часто обитают рядом с человеком. Некоторые гигантские вирусы, а именно мимивирусы, удалось выделить из различных животных — устриц , пиявок , мартышек и коров . Marseillevirus выделили из двукрылых насекомых, а фаустовирус однажды был найден в организме мокреца .
Гигантские вирусы неоднократно обнаруживали в биологических материалах, взятых от людей. Они были выявлены в кале и крови здоровых людей, соскобах верхних дыхательных путей больных пневмонией и даже в жидкости для контактных линз , использовавшихся пациентами с кератитом . В 2013 году Marseillevirus обнаружили в крови и лимфоузлах одиннадцатимесячного ребёнка, страдавшего от . Гигантские вирусы часто выявляют в метагеномных данных, связанных с человеком. Так, последовательности, вероятно, принадлежащие мимивирусам, обнаружены в человеческом кале и копролитах , слюне , слизистой вагины . Последовательности, относящиеся к вирофагам, найдены в желудочно-кишечном тракте . Pandoravirus , Pithovirus и Faustovirus были выявлены в плазме крови пациентов, страдающих от разных патологий печени .
Мимивирусы могут проникать в человеческие и мышиные фагоциты. В течение 30 часов после попадания мимивируса в мышиный макрофаг количество вирусной ДНК в клетке значительно увеличивается, а экстракт из заражённых макрофагов приводит к лизису амёб. Также было обнаружено, что мимивирус может размножаться в одноядерных клетках периферической крови человека и подавлять в этих клетках экспрессию генов, стимулированных интерфероном. Через 21 день после заражения Marseillevirus иммортализованных человеческих Т-лимфоцитов в них удалось выявить не только вирусную ДНК, но и целые вирионы. Таким образом, гигантские вирусы могут успешно размножаться и вне амёб .
Мимивирус был обнаружен случайно при исследовании причин вспышки пневмонии. В плазме крови пациентов с пневмонией мимивирусы обнаруживают в существенно бóльшем количестве, чем у здоровых людей. У пациентов, заразившихся пневмонией уже в больнице, в крови выявляли многочисленные антитела против мимивируса. При этом независимые исследования показали, что в больницах мимивирусы присутствуют в гораздо бóльшем количестве, чем в обычных помещениях. Был описан один случай заболевшего пневмонией лаборанта, который много работал с мимивирусом голыми руками. В его крови обнаружили антитела к 23 белкам мимивируса, из которых 4 были уникальны для мимивируса. Похожий случай произошёл в 1968 году с лаборантом, не соблюдавшим правила техники безопасности при работе с вирусом Эпштейна — Барр , который в итоге заболел инфекционным мононуклеозом . Как стало известно впоследствии, инфекционный мононуклеоз вызывается именно вирусом Эпштейна — Барр. У двух пациентов, вернувшихся во Францию из поездки в Лаос и страдавших от астении , лихорадки , миалгии и тошноты , в крови выявили антитела к вирофагу Спутник, который паразитирует на мимивирусах .
Таким образом, на данный момент однозначно записать гигантские вирусы в список человеческих патогенов ещё рано, однако можно определённо сказать, что они участвуют в патогенезе многих заболеваний человека .
Примечания
Комментарии
- На английском языке .
Источники
- . Дата обращения: 27 декабря 2018. 20 марта 2020 года.
- Van Etten James. (англ.) // American Scientist. — 2011. — Vol. 99 , no. 4 . — P. 304 . — ISSN . — doi : .
- ↑ Aherfi Sarah , Colson Philippe , La Scola Bernard , Raoult Didier. (англ.) // Frontiers in Microbiology. — 2016. — 22 March ( vol. 7 ). — ISSN . — doi : .
- ↑ Colson Philippe , La Scola Bernard , Raoult Didier. (англ.) // Annual Review of Virology. — 2017. — 29 September ( vol. 4 , no. 1 ). — P. 61—85 . — ISSN . — doi : .
- Cheng Shanshan , Brooks Charles L. (англ.) // PLoS Computational Biology. — 2013. — 7 February ( vol. 9 , no. 2 ). — P. e1002905 . — ISSN . — doi : .
- Legendre M. , Fabre E. , Poirot O. , Jeudy S. , Lartigue A. , Alempic J. M. , Beucher L. , Philippe N. , Bertaux L. , Christo-Foroux E. , Labadie K. , Couté Y. , Abergel C. , Claverie J. M. (англ.) // Nature Communications. — 2018. — 11 June ( vol. 9 , no. 1 ). — ISSN . — doi : .
- ↑ Abrahão Jônatas , Silva Lorena , Silva Ludmila Santos , Khalil Jacques Yaacoub Bou , Rodrigues Rodrigo , Arantes Thalita , Assis Felipe , Boratto Paulo , Andrade Miguel , Kroon Erna Geessien , Ribeiro Bergmann , Bergier Ivan , Seligmann Herve , Ghigo Eric , Colson Philippe , Levasseur Anthony , Kroemer Guido , Raoult Didier , La Scola Bernard. (англ.) // Nature Communications. — 2018. — 27 February ( vol. 9 , no. 1 ). — ISSN . — doi : .
- Yoshikawa Genki , Blanc-Mathieu Romain , Song Chihong , Kayama Yoko , Mochizuki Tomohiro , Murata Kazuyoshi , Ogata Hiroyuki , Takemura Masaharu. (англ.) // Journal of Virology. — 2019. — 6 February. — ISSN . — doi : .
- Villain Adrien , Gallot-Lavallée Lucie , Blanc Guillaume , Maumus Florian. (англ.) // Current Opinion in Virology. — 2016. — April ( vol. 17 ). — P. 130—137 . — ISSN . — doi : .
- Sun Cheng , Feschotte Cédric , Wu Zhiqiang , Mueller Rachel Lockridge. (англ.) // BMC Biology. — 2015. — 12 June ( vol. 13 , no. 1 ). — ISSN . — doi : .
- ↑ Yutin Natalya , Raoult Didier , Koonin Eugene V. (англ.) // Virology Journal. — 2013. — Vol. 10 , no. 1 . — P. 158 . — ISSN . — doi : .
- ↑ Forterre Patrick , Gaïa Morgan. (англ.) // Current Opinion in Microbiology. — 2016. — June ( vol. 31 ). — P. 44—49 . — ISSN . — doi : .
- ↑ Colson Philippe , Aherfi Sarah , La Scola Bernard , Raoult Didier. (англ.) // Current Opinion in Microbiology. — 2016. — June ( vol. 31 ). — P. 199—208 . — ISSN . — doi : .
Ссылки
- Елизавета Минина. (31 августа 2018). Дата обращения: 22 января 2019.
- 2020-08-29
- 1