Хлоропреновый каучук
- 1 year ago
- 0
- 0
| 17 |
Хлор
|
|
|
|
| 3s 2 3p 5 | |
Хлор ( химический символ — Cl , от др.-греч. χλωρός — «изжелта-зелёный» , от лат. Chlorum ) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) третьего периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 17.
Простое вещество хлор (при нормальных условиях ) — ядовитый удушающий двухатомный газ (формула — Cl 2 ) желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Соединение с водородом — газообразный хлороводород — был впервые получен Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле , описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки , его способность взаимодействовать с золотом и киноварью , а также его отбеливающие свойства. Однако Шееле , в соответствии с господствовавшей в химии того времени теорией флогистона , предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту . Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетического элемента мурия . Однако попытки его выделения оставались безуспешными вплоть до работ Г. Дэви , которому электролизом удалось разложить поваренную соль на натрий и хлор, доказав элементарную природу последнего.
В 1811 г. Дэви предложил для нового элемента название « хлорин » ( chlorine ). Спустя год Ж. Гей-Люссак «сократил» французское название до хлора ( chlore ), хотя в английском языке оно осталось прежним. В том же 1811 г. немецкий физик Иоганн Швейгер предложил для хлора название « галоген » (дословно солерод ), однако впоследствии этот термин закрепился за всей 17-й (VIIA) группой элементов, в которую входит и хлор .
В 1826 году атомная масса хлора была с высокой точностью определена шведским химиком Йёнсом Якобом Берцелиусом (отличается от современных данных не более чем на 0,1 %) .
В земной коре хлор — самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl·NaCl, бишофита MgCl 2 ·6Н 2 О, карналлита KCl·MgCl 2 ·6Н 2 O, каинита KCl·MgSO 4 ·3Н 2 О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л ). На долю хлора приходится 0,025 % от общего числа атомов земной коры ; кларковое число хлора — 0,017 %. Человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 % . Свойства стабильных и некоторых радиоактивных изотопов хлора перечислены в таблице (см. , :
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35 Cl | 34,968852721 | Стабилен | — | 3/2 |
| 36 Cl | 35,9683069 | 301 тыс. лет | β-распад в | 2 |
| 37 Cl | 36,96590262 | Стабилен | — | 3/2 |
| 38 Cl | 37,9680106 | 37,2 минуты | β-распад в 38 Ar | 2 |
| 39 Cl | 38,968009 | 55,6 минуты | β-распад в 39 Ar | 3/2 |
| 40 Cl | 39,97042 | 1,38 минуты | β-распад в 40 Ar | 2 |
| 41 Cl | 40,9707 | 34 c | β-распад в 41 Ar | |
| 42 Cl | 41,9732 | 46,8 c | β-распад в 42 Ar | |
| 43 Cl | 42,9742 | 3,3 c | β-распад в 43 Ar |
Некоторые изотопы хлора имеют удобные ядерно-физические характеристики (спин и период полураспада), позволяющие исследовать его методом ЯМР :

При нормальных условиях хлор — жёлто-зелёный газ с резким запахом. Некоторые его физические свойства представлены в таблице.
| Свойство | Значение |
|---|---|
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
|
Температура разложения
(диссоциации на атомы) |
~1400 °C |
| Плотность (газ, н.у. ) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоёмкость (298 К, газ) | 34,94 Дж/(моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 кДж/моль |
| Стандартная энтропия образования (298 К, газ) | 222,9 Дж/(моль·K) |
| Энтальпия плавления | 6,406 кДж/моль |
| Энтальпия кипения | 20,41 кДж/моль |
| Энергия гомолитического разрыва связи Х—Х | 243 кДж/моль |
| Энергия гетеролитического разрыва связи Х—Х | 1150 кДж/моль |
| Энергия ионизации | 1255 кДж/моль |
| Энергия сродства к электрону | 349 кДж/моль |
| Атомный радиус | 0,073 нм |
| Электроотрицательность по Полингу | 3,20 |
| Электроотрицательность по Оллреду — Рохову | 2,83 |
| Устойчивые степени окисления | −1, 0, +1, +3, (+4), +5, (+6), +7 |
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a = 6,29 Å , b = 4,50 Å , c = 8,21 Å . Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную , имеющую пространственную группу P 4 2 / ncm и параметры решётки a = 8,56 Å и c = 6,12 Å .
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl 4 , SiCl 4 , SnCl 4 | Растворим |
Степень диссоциации молекулы хлора Cl 2 → 2Cl при 1000 К равна 2,07⋅10 −4 %, а при 2500 К — 0,909 %.
Порог восприятия запаха в воздухе равен 2—3 мг/м³.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов (благодаря сильному сродству к электрону, что приводит к практически полному отсутствию свободных носителей заряда): он проводит ток почти в миллиард раз хуже, чем дистиллированная вода , и в 10 22 раз хуже серебра . Скорость звука в газообразном хлоре примерно в полтора раза меньше, чем в воздухе.
На валентном уровне атома хлора содержится 1 неспаренный электрон : 1s 2 2s 2 2p 6 3s 2 3p 5 , поэтому валентность , равная 1 для атома хлора, очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность |
Возможные
степени окисления |
Электронное состояние
валентного уровня |
Пример соединений |
|---|---|---|---|
| I | +1, −1, 0 | 3s 2 3p 5 | NaCl , NaClO , Cl 2 |
| III | +3 | 3s 2 3p 4 3d 1 | NaClO 2 |
| V | +5 | 3s 2 3p 3 3d 2 | KClO 3 |
| VII | +7 | 3s 1 3p 3 3d 3 | KClO 4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентности IV и VI, например, ClO 2 и Cl 2 O 6 . Однако оксид хлора(IV) является стабильным радикалом , то есть имеет неспаренный электрон, а оксид хлора(VI) содержит два атома хлора, имеющих степени окисления +5 и +7.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
C неметаллами (кроме углерода , азота , фтора , кислорода и инертных газов ) образует соответствующие хлориды .
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикально-цепному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода . Смесь хлора с водородом в небольших концентрациях горит бесцветным или жёлто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.
С кислородом хлор образует оксиды , в которых проявляет степень окисления от +1 до +7: Cl 2 O , ClO 2 , Cl 2 O 5 , Cl 2 O 7 . Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. Напрямую хлор с кислородом не реагирует.
При реакции с фтором образуется не хлорид, а фториды :
Известны фторид хлора(I) , фторид хлора(III) и фторид хлора(V) (ClF, ClF 3 и ClF 5 ), Могут быть синтезированы из элементов, степень окисления хлора меняется в зависимости от условий синтеза. Все они представляют собой при комнатной температуре бесцветные ядовитые тяжёлые газы с сильным раздражающим запахом. Сильные окислители, реагируют с водой и стеклом. Используются как фторирующие агенты.
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При реакции с монооксидом углерода образуется фосген :
При растворении в воде или щелочах, хлор диспропорционирует , образуя хлорноватистую (а при нагревании хлорноватую ) и соляную кислоты , либо их соли:
Хлор взаимодействует с водой в присутствии солей кобальта [ источник не указан 525 дней ] :
Хлорированием сухого гидроксида кальция получают хлорную известь :
Действием хлора на аммиак можно получить трихлорид азота :
Хлор — очень сильный окислитель :
Раствор хлора в воде используется для отбеливания тканей и бумаги.
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl 3 или FeCl 3 ):
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение.
Первоначально промышленный способ получения хлора основывался на методе Шееле , то есть реакции оксида марганца(IV) ( пиролюзита ) с соляной кислотой :
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха . Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода , являющегося побочным продуктом при промышленном хлорировании органических соединений.
Ввиду доступности хлора в лабораторной практике обычно используется сжиженный хлор в баллонах.
Хлор можно получить действием кислоты на гипохлорит натрия :
При этом также выделяется кислород. Если использовать соляную кислоту, то реакция выглядит по-другому:
Для получения хлора обычно используются процессы, основанные на окислении хлороводорода сильными окислителями (чаще всего диоксидом марганца или перманганатом калия , но также и хлоритом кальция , хроматом калия , дихроматом калия , диоксидом свинца , бертолетовой солью и т. п.) :
При невозможности использования баллонов и химических методов получения хлора могут быть использованы электрохимические — при помощи небольших электролизёров с обычным или для получения хлора.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза водного раствора поваренной соли , основные процессы которого можно представить суммарной формулой:
На тонну выделяющегося хлора образуется 1,13 т гидроксида натрия . Поскольку хлор является одним из наиболее востребованных продуктов химической промышленности, расходы электроэнергии на его производство весьма заметны: в США для производства хлора используется около 2% всей генерируемой электроэнергии и 28% энергии, потребляемой электрохимическими промышленными установками .
Гораздо реже в промышленности используется электролиз раствора хлорида калия .
Применяется три варианта электрохимического метода получения хлора. Два из них — электролиз с твёрдым катодом: диафрагменный и мембранный методы. Третий — электролиз с жидким ртутным катодом (ртутный метод производства). Качество хлора, получаемого электрохимическими методами, отличается мало:
| Ртутный метод | Диафрагменный метод | Мембранный метод | |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия ( кВт·ч ) на 1 т хлора | 3150 | 3260 | 2520 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Массовая доля O 2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Начало применения | XIX век | XIX век | 1975 год |
Наиболее простым из электрохимических методов получения хлора, в плане организации процесса и конструкционных материалов для электролизёра, является диафрагменный метод.
Раствор соли в диафрагменном электролизёре непрерывно подается в анодное пространство и протекает через, как правило, насаженную на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Насасывание диафрагмы производится путём прокачивания через электролизёр пульпы из асбестовых волокон, которые, застревая в сетке катода, образуют слой асбеста, играющий роль диафрагмы.
Во многих конструкциях электролизёров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из-под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизёра. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH - ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит -ион (ClO - ), который затем может окисляться на аноде до хлорат -иона ClO 3 - . Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе. Так же вредит и выделение кислорода, которое к тому же ведёт к разрушению анодов и, если они из углеродных материалов, попадания в хлор примесей фосгена .
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов галита , бишофита и других минералов, содержащих хлорид натрия, а также растворением их в специальных ёмкостях на месте производства. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения хлора до сих пор широко используется в промышленности.
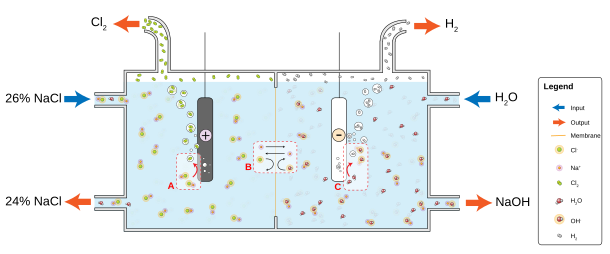
Мембранный метод производства хлора наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизёре, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли, а в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов, и выходит хлор, а из катодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Однако питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищаются от любых примесей. Такая тщательная очистка определяется высокой стоимостью полимерных катионообменных мембран и их уязвимостью для примесей в питающем растворе.
Кроме того, ограниченная геометрическая форма, а также низкая механическая прочность и термическая стойкость ионообменных мембран , во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.

В ряду электрохимических методов получения хлора ртутный метод позволяет получать самый чистый хлор.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые , угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего раствора поваренной соли.
На аноде происходит окисление ионов хлора из электролита и выделяется хлор:
Хлор и анолит отводятся из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения хлора с твёрдым катодом.
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — защитный цвет c зелёной полосой. При длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый трихлорид азота , и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора:
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объёмная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля трёххлористого азота , не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:


Это старинный способ отбеливания тканей, бумаги, картона.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов .
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов в виде соединений.
У животных и человека ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК ( нейромедиатор ) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия . В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока . Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике . Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na + /K + — АТФ-азы . В клетках аккумулируется 10—15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах . Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90—95 %), калом (4—8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно (взаимно) с гидрокарбонат-ионами HCO 3 − (кислотно-щелочной баланс).
Человек потребляет 5—10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20—0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3—6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование . Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами , стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла , уменьшать активность фотосинтеза, задерживать рост и развитие растений .
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки , на которых нет конкуренции. Растения, произрастающие на засоленных почвах, называются галофитами . Они накапливают хлориды в течение , а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду, притеняя поверхности от солнечного света.
Среди микроорганизмов также известны галофилы — галобактерии , — которые обитают в сильносоленых водах или почвах.



Хлор — токсичный удушающий газ, сильный ирритант , при попадании в лёгкие вызывает ожог лёгочной ткани (в результате образования в них хлорноватистой и соляной кислоты), удушье .
Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе уже от 1 до 6 мг/м³ (что близко к хлора), при 12 мг/м³ переносится с трудом, концентрации больше 100 мг/м³ опасны для жизни ( смерть от остановки дыхания наступает через 5—25 минут, при высоких концентрациях — мгновенно) .
Предельно допустимая концентрация хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na 2 SO 3 или тиосульфата натрия Na 2 S 2 O 3 .
Хлор был одним из первых химических отравляющих веществ , использованных в Первую мировую войну , впервые применён Германией в 1915 году во время битвы при Ипре .