Периодическая функция
- 1 year ago
- 0
- 0
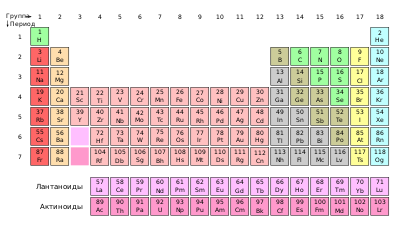
Периоди́ческая систе́ма хими́ческих элеме́нтов ( табли́ца Менделе́ева ) — классификация химических элементов , устанавливающая зависимость различных свойств элементов от заряда их атомного ядра . Система является графическим выражением периодического закона , открытого русским учёным Д. И. Менделеевым в 1869 году и установившего зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы ).
Первоначальный вариант был разработан Д. И. Менделеевым в 1869 и приведён к традиционному графическому виду в 1871 году. Всего предложено несколько сотен вариантов изображения периодической системы (аналитические кривые, таблицы, геометрические фигуры и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец ( группа ) определяет основные физико-химические свойства, а строки представляют собой периоды , в определённой мере подобные друг другу.
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Иоганн Дёберейнер опубликовал найденный им «закон триад»: атомная масса многих элементов приблизительно равна среднему арифметическому двух других элементов, близких к исходному по химическим свойствам ( стронций , кальций и барий ; хлор , бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который создал «Теллуров винт», разместив элементы на винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Эти модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс , модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии было предпринято ещё несколько попыток систематизации химических элементов, и ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Однако главное отличие его модели заключалось в том, что за основу периодичности была взята валентность , которая не является единственной и постоянной для отдельно взятого элемента, и поэтому такая таблица не могла претендовать на полноценное описание физики элементов и не отражала периодического закона.

По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово» .
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима ), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим .

В результате раскладывания этого «химического пасьянса», 17 февраля (1 марта) 1869 года был завершён самый первый целостный вариант Периодической системы химических элементов, который получил название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» , в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов ). Эта дата знаменует собой открытие Менделеевым Периодического закона , но правильнее считать эту дату началом открытия.
Согласно окончательной хронологии первых публикаций Таблицы Менделеева , впервые Таблица была опубликована 14-15 марта (26-27 марта) 1869 года в 1-м издании учебника Менделеева «Основы Химии» (ч. 1, вып. 2). И уже после этого, осознав во время двухнедельной поездки по провинции великое значение своего открытия, Менделеев по возвращении в Петербург заказал в середине марта в типографии «Общественная польза» отдельные листки с этой таблицей, которые были напечатаны 17 марта (29 марта) 1869 года специально для рассылки «многим химикам». Позднее, в начале мая 1869 года, «Опыт системы элементов» был напечатан с химическим обоснованием в программной статье Менделеева «Соотношение свойств с атомным весом элементов» (журнал Русского химического общества ).
В Европе Таблица Менделеева стала известна в апреле 1869 года: первая публикация Таблицы Менделеева в международной печати, согласно точной хронологии , вышла в свет 5 апреля (17 апреля) 1869 года в лейпцигском «Журнале практической химии» и стала достоянием мировой науки.
И только спустя более чем полгода, в декабре 1869 года, выходит работа немецкого химика Мейера, который изменил своё решение в пользу мысли Д. И. Менделеева и в зарубежной литературе считается либо «одним из первооткрывателей», либо «независимо от Менделеева опубликовавшим этот периодический закон». Однако этот вывод тенденциозен: Л. Мейер в своих исследованиях не пошёл дальше расстановки части (28 из 63) открытых на тот момент элементов в сплошной ряд и периодического закона не формулировал вообще, в то время как Д. И. Менделеев в своей таблице оставил несколько свободных мест и предсказал ряд фундаментальных свойств ещё не открытых элементов и само их существование, а также свойства их соединений (экабор, экаалюминий, экасилиций, экамарганец — соответственно, скандий , галлий , германий , технеций ). Некоторые элементы, а именно, бериллий , индий , уран , торий , церий , титан , иттрий , имели на момент работы Менделеева над Периодическим законом неправильно определённый атомный вес, и поэтому Менделеев исправил их атомные веса на основании открытого им закона. Этого не могли сделать ни Деберейнер, ни Мейер, ни Ньюлендс, ни де Шанкуртуа.
В 1871 году Менделеев в «Основах химии» (ч. 2, вып. 2) публикует второй вариант Периодической системы ( «Естественную систему элементов» ), имеющий более привычный нам вид: строки элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном . Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, их свойства начинают повторяться. Например, натрий похож на калий , фтор похож на хлор , а золото — на серебро и медь . Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было в том, что основой для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев предпринял очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия , индия , урана , тория , церия , титана , иттрия ), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий , считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности ), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон , форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), существование которых, опираясь на периодическую систему, предсказал Менделеев и с поразительной точностью описал целый ряд их физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра , равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства. Заряд ядра, который соответствует номеру элемента в периодической системе, назван числом Менделеева .
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы , природные и искусственно полученные радиоактивные элементы . В 2010 году с синтезом 118 элемента седьмой период периодической системы был завершён. Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии .
В период с 2003 по 2009 год ИЮПАК утвердил 113-й химический элемент, открытый специалистами японского института естественных наук «Рикэн». 28 ноября 2016 года новый элемент получил название нихоний (Nh) . В тот же день элементы 115 и 117 получили названия московий (Mc) и теннессин (Ts) по предложениям ОИЯИ , Национальной лаборатории Ок-Ридж , Университета Вандербильта и Ливерморской национальной лаборатории в США. Тогда же 118-й элемент получил название оганесон (Og) , в честь профессора Юрия Оганесяна , внёсшего вклад в исследования сверхтяжёлых элементов. Наименование было предложено коллективами Объединенного института ядерных исследований и Ливерморской национальной лаборатории .
Наиболее распространёнными являются три формы таблицы Менделеева: « короткая » (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород иногда помещают в 7-ю («короткая» форма) или 17-ю («длинная» форма) группу таблицы .
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного.
|
Группа
→
Период ↓ |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
1
H Водород |
2
He Гелий |
||||||||||||||||
| 2 |
3
Li Литий |
4
Be Бериллий |
5
B Бор |
6
C Углерод |
7
N Азот |
8
O Кислород |
9
F Фтор |
10
Ne Неон |
||||||||||
| 3 |
11
Na Натрий |
12
Mg Магний |
13
Al Алюми- ний |
14
Si Кремний |
15
P Фосфор |
16
S Сера |
17
Cl Хлор |
18
Ar Аргон |
||||||||||
| 4 |
19
K Калий |
20
Ca Кальций |
21
Sc Скандий |
22
Ti Титан |
23
V Ванадий |
24
Cr Хром |
25
Mn Марганец |
26
Fe Железо |
27
Co Кобальт |
28
Ni Никель |
29
Cu Медь |
30
Zn Цинк |
31
Ga Галлий |
32
Ge Германий |
33
As Мышьяк |
34
Se Селен |
35
Br Бром |
36
Kr Криптон |
| 5 |
37
Rb Рубидий |
38
Sr Стронций |
39
Y Иттрий |
40
Zr Цирконий |
41
Nb Ниобий |
42
Mo Молибден |
43
Tc Технеций |
44
Ru Рутений |
45
Rh Родий |
46
Pd Палладий |
47
Ag Серебро |
48
Cd Кадмий |
49
In Индий |
50
Sn Олово |
51
Sb Сурьма |
52
Te Теллур |
53
I Иод |
54
Xe Ксенон |
| 6 |
55
Cs Цезий |
56
Ba Барий |
* |
72
Hf Гафний |
73
Ta Тантал |
74
W Вольфрам |
75
Re Рений |
76
Os Осмий |
77
Ir Иридий |
78
Pt Платина |
79
Au Золото |
80
Hg Ртуть |
81
Tl Таллий |
82
Pb Свинец |
83
Bi Висмут |
84
Po Полоний |
85
At Астат |
86
Rn Радон |
| 7 |
87
Fr Франций |
88
Ra Радий |
** |
104
Rf Резер- фордий |
105
Db Дубний |
106
Sg Сиборгий |
107
Bh Борий |
108
Hs Хассий |
109
Mt Мейтне- рий |
110
Ds Дармшта- дтий |
111
Rg Рентге- ний |
112
Cn Копер- ниций |
113
Nh Нихоний |
114
Fl Флеровий |
115
Mc Московий |
116
Lv Ливермо- рий |
117
Ts Теннессин |
118
Og Оганесон |
| Лантаноиды * |
57
La Лантан |
58
Ce Церий |
59
Pr Празеодим |
60
Nd Неодим |
61
Pm Прометий |
62
Sm Самарий |
63
Eu Европий |
64
Gd Гадоли- ний |
65
Tb Тербий |
66
Dy Диспро- зий |
67
Ho Гольмий |
68
Er Эрбий |
69
Tm Тулий |
70
Yb Иттербий |
71
Lu Лютеций |
|||
| Актиноиды ** |
89
Ac Актиний |
90
Th Торий |
91
Pa Протак- тиний |
92
U Уран |
93
Np Нептуний |
94
Pu Плутоний |
95
Am Америций |
96
Cm Кюрий |
97
Bk Берклий |
98
Cf Калифор- ний |
99
Es Эйнштей- ний |
100
Fm Фермий |
101
Md Менделе- вий |
102
No Нобелий |
103
Lr Лоурен- сий |
|||
На 2022 год известны все элементы первых семи периодов таблицы; самым тяжёлым из известных элементов является оганесон (18 группа, 7 период) с атомным номером 118. Предсказано существование гипотетических сверхтяжёлых элементов с номерами от 119 и далее, которым присвоены вре́менные систематические названия : унуненний , унбинилий , унбиуний , унбибий , унбитрий , унбиквадий , унбипентий , унбигексий и т.д. Предпринимаются попытки синтезировать некоторые из этих элементов, однако ни один элемент восьмого периода пока достоверно не наблюдался.
Короткая форма таблицы , содержащая восемь групп элементов , была официально отменена ИЮПАК в 1989 году . Несмотря на рекомендацию использовать длинную форму, короткую форму продолжают приводить во всех школьных учебниках по химии и во всех школьных химических кабинетах, в большом числе российских справочников и пособий и после 1989 года . Из современной иностранной литературы короткая форма исключена полностью, а вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации .
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов . Нильс Бор разрабатывал лестничную (пирамидальную) форму периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона . Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты , в том числе объёмные .
Группа , или семейство — одна из колонок периодической таблицы. Для групп, как правило, характерны более выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках . Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа . Впрочем, в некоторых областях таблицы, например, в d-блоке и f-блоке , горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные .
В соответствии с международной системой именования группам присваиваются номера от 1-го до 18-го в направлении слева направо — от щелочных металлов к благородным газам . Ранее для их идентификации использовались римские цифры . В американской практике после римских цифр ставилась также литера А (если группа располагалась в s-блоке или p-блоке ) или B (если группа находилась в d-блоке ). Применявшиеся тогда идентификаторы соответствуют последней цифре современных численных указателей. К примеру, элементам группы 4 соответствовало наименование IVB, а тем, которые ныне известны как группа 14 — IVA. Похожая система использовалась и в Европе, за тем исключением, что литера А относилась к группам, до десятой включительно, а В — к группам после десятой включительно. Группы 8, 9 и 10, кроме того, часто рассматривались как одна тройная группа с идентификатором VIII. В 1988 году в действие вступила новая система нотации ИЮПАК , и прежние наименования групп вышли из употребления .
Некоторым из этих групп были присвоены тривиальные, несистематические названия (например, « щелочноземельные металлы », « галогены » и т. п.); впрочем, некоторые из них используются редко. Группы с третьей по четырнадцатую включительно такими именами не располагают, и их идентифицируют либо по номеру, либо по наименованию первого представителя (« титановая », « кобальтовая » и так далее), поскольку они демонстрируют меньшую степень сходства между собой или меньшее соответствие вертикальным закономерностям .
Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу , энергии ионизации и электроотрицательности . По направлению сверху вниз в рамках группы радиус атома возрастает (чем больше у него заполненных энергетических уровней, тем дальше от ядра располагаются валентные электроны ), а энергия ионизации снижается (связи в атоме ослабевают, и, следовательно, изъять электрон становится проще), равно как и электроотрицательность (что, в свою очередь, также обусловлено возрастанием дистанции между валентными электронами и ядром) . Случаются, впрочем, и исключения из этих закономерностей — к примеру, в группе 11 по направлению сверху вниз электроотрицательность возрастает, а не убывает .
Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов .
В рамках периода элементы демонстрируют определённые закономерности во всех трёх названных выше аспектах (атомный радиус, энергия ионизации и электроотрицательность ), а также в энергии сродства к электрону . В направлении «слева направо» атомный радиус обычно сокращается (в силу того, что у каждого последующего элемента увеличивается количество заряженных частиц, и электроны притягиваются ближе к ядру ), и параллельно с ним возрастает энергия ионизации (чем сильнее связь в атоме, тем больше энергии требуется на изъятие электрона). Соответствующим образом увеличивается и электроотрицательность . Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой, соответственно, большим — за исключением благородных газов .
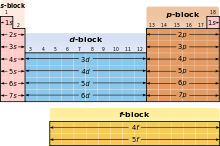
Ввиду значимости внешней электронной оболочки атома различные области периодической таблицы иногда описываются как блоки, именуемые в соответствии с тем, на какой оболочке находится последний электрон . S-блок включает первые две группы , то есть щелочные и щёлочноземельные металлы, а также водород и гелий ; p-блок состоит из последних шести групп (с 13-й по 18-ю, согласно стандарту именования ИЮПАК, или с IIIA до VIIIA — по американской системе) и включает, помимо других элементов, все металлоиды . D-блок — это группы с 3-й по 12-ю (ИЮПАК), они же — с IIIB до IIB (американская система), в которые входят все переходные металлы . F-блок , выносимый обычно за пределы таблицы, состоит из лантаноидов и актиноидов .

Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов:

Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства. Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице . Благодаря ей сложилось современное понятие о химическом элементе , были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов .
Разработанная в XIX веке в рамках науки химии , периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики , получивших развитие в начале XX веке — атомной физики и физики ядра . В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева ( атомный номер , называемый также числом Менделеева ), является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома , а номер вертикального ряда (группы) — квантовую структуру верхней электронной оболочки, чему элементы группы и обязаны сходством химических свойств.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
По решению ООН 2019 год был объявлен Международным годом Периодической таблицы химических элементов .