Interested Article - Роданистоводородная кислота
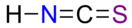
- 2020-05-28
- 2
Рода́нистоводоро́дная кислота́ ( ти́оциа́новая кислота́ , рода́нистый водоро́д , химическая формула — HNCS ) — сильная химическая неорганическая кислота .
При стандартных условиях тиоциановая кислота — это желтоватая, маслянистая, резко пахнущая жидкость .
Соли тиоциановой кислоты называются тиоцианатами . Органические простые эфиры тиоциановой кислоты называются органическими тиоцианатами .
Строение
Ранее была распространена точка зрения, что тиоциановая кислота представляет собой смесь двух таутомеров — тиоциановой и изотиоциановой кислоты:
- ,
но в дальнейшем выяснилось, что кислота имеет строение HNCS . Тиоцианаты щелочных металлов и аммония имеют формулу M + NCS − , для других тиоцианатов возможна формула M(SCN) x .
Нахождение в природе
В свободном виде HNCS содержится в соке лука репчатого Allium coepa и в корнях некоторых других растений , сравнительно малотоксична . В слюне человека содержится около 0,01% тиоцианат-иона SCN − . Также SCN − был обнаружен в крови и желудочном соке .
Физические свойства
Роданистоводородная кислота устойчива только при низких температурах (около −90 °C) или в разбавленных водных растворах (менее чем в 5%-ных), однако она более устойчива, чем циановая кислота HOCN. Является сильной кислотой — её растворы почти полностью диссоциированы, константа диссоциации 0,85 (при 18 °C). Хорошо растворяется в воде и ряде органических растворителей ( этанол , диэтиловый эфир , бензол ) .
В молекуле длина связи H—N составляет 98,87 пм, N—C 211,64 пм, C—S 156,05 пм. Участок NCS линеен, связь H—N расположена под углом 134,98° .
При стандартных условиях:
теплоёмкость
C
0
p
= 48,16 Дж/(моль·К),
энтальпия образования
Δ
H
0
обр
= 104,6 кДж/моль,
энтропия
S
0
298
= 247,36 Дж/(моль·К)
.
При низких температурах представляет собой бесцветную кристаллическую массу. Плавится при −110 °C, при дальнейшем нагревании в интервале от −90 °C до −85 °C вновь затвердевает, образуя тример — (HNCS) 3 , окрашенную в жёлтый цвет. При нагревании выше 0°C полимеризация идёт дальше с образованием смеси красных и тёмно-бурых твёрдых полимеров . Плотность = 2,04 г/см 3 .
Химические свойства
1) Водные растворы устойчивы до 5 % концентрации, в более концентрированных растворах на холоду разлагается, переходя в синильную кислоту (HCN) и т. н. ксантановый водород (3-имино-5-тион-1,2,4-дитиоазолидон) либо в NH 3 + COS .
2) Серная кислота при нагревании в водном растворе тиоциановой кислоты может разлагать её вплоть до свободной серы .
3) Реагирует с щелочными металлами .
4) Тиоциановая кислота восстанавливается цинком в соляной кислоте до метиламина и 1,3,5-тритиана (тример тиоформальдегида ):
-
-

Роданистоводородная кислота
-
5) Действие концентрированной серной кислоты на роданиды приводит к образованию :
6) Нагревание твердых роданидов приводит к их разложению, с выделением дициана :
7) Окисляется перманганатом калия до серной кислоты:
Окисление пероксидом водорода приводит к образованию синильной кислоты :
Окисление бромом приводит к образованию цианида брома :
8) Медленное мягкое окисление приводит к образованию крайне неустойчивого тиоциана ( родана (SCN) 2 ), обладающему свойствами псевдогалогенов. Сероводородом разлагается до сероуглерода и аммиака :
Присоединяется к ненасыщенным соединениям. Образуются как тиоцианаты (—SCN), так и изотиоцианаты (—NCS). Например, соли щелочных металлов и аммония являются изотиоцианатами. Органические изотиоционаты называются горчичными маслами, они образуются из эфиров-тиоцианатов при нагревании .
Образование кроваво-красных комплексов тиоцианат-иона с ионом Fe 3+ является одной из качественных реакций на железо.
Получение
Раствор тиоциановой кислоты получают действием разбавленной серной кислоты на водный раствор роданида калия . Безводную тиоциановую кислоту получают перегонкой в вакууме роданида калия с гидросульфатом калия в токе водорода, причём конденсация должна выполняться при −100 °C .
Применение
Практическое применение находят только соли роданистоводородной кислоты, а также её сложные эфиры , используемые как инсектициды и фунгициды .
Примечания
- ↑ Смирнов С. К. Тиоцианаты неорганические // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров . — М. : Большая Российская энциклопедия , 1995. — Т. 4: Полимерные — Трипсин. — С. 586—587. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8 .
- ↑ Чичибабин А. Е. Основные начала органической химии. — 7-е изд. — М. : Госхимиздат, 1963. — Т. I. — С. 826—827.
- . www.chem21.info . Дата обращения: 26 сентября 2021. 26 сентября 2021 года.
- Неорганическая химия в трех томах, том 2. Химия непереходных элементов. / под ред. Ю.Д. Третьякова. — ACADEMIA, 2004.
Литература
- Смирнов С. К. Тиоцианаты неорганические // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров . — М. : Большая Российская энциклопедия , 1995. — Т. 4: Полимерные — Трипсин. — С. 586—587. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8 .
- 2020-05-28
- 2