Тетрафтороборная кислота
- 1 year ago
- 0
- 0

Бо́рная кислота́ (от лат. acidum Boricum , ортоборная кислота, химическая формула — H 3 BO 3 или B(OH) 3 ) — слабая химическая неорганическая кислота , отвечающая высшей степени окисления бора (+3). Впервые была получена в 1702 году в Париже немецким химиком Вильгельмом Хомбергом (состава ее он, однако, не знал).
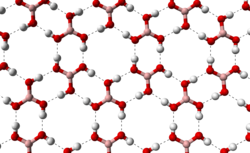
При стандартных условиях, борная кислота — это бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм .
Метаборная кислота ( HBO 2 ) — это бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-НВО 2 с кубической решёткой, β-НВО 2 с моноклинной решёткой и α-НВО 2 с ромбической решёткой.
В природе свободная борная кислота встречается в виде минерала сассолина , в горячих источниках и минеральных водах .
Борная кислота — это одноосновная кислота Льюиса , часто используемая в качестве инсектицида , антисептика , огнезащитного состава , поглотителя нейтронов или предшественника для получения иных химических составов.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H 2 B 4 O 7 . При дальнейшем нагревании обезвоживается до борного ангидрида .
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н 3m-2n В m О 3m-n . В природе встречается в виде минерала сассолина .
Расстояние между соседними слоями — 318 пм.
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением катиона Н + , а присоединением гидроксильного аниона:
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н 2 В 4 О 7 , которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH) 3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO 4 ) 3 .
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО 3 ) 3− , поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН) 4 ] − . В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
Мета- и тетрабораты гидролизуются , но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия :
При нагревании борная кислота растворяет оксиды металлов, образуя соли:
При избытке оксида образуется метаборат кальция:
При недостатке оксида образуется тетраборат кальция:
Взаимодействует с металлами при нагревании:
Термическое разложение борной кислоты происходит в две стадии при медленном нагревании:
Со спиртами в присутствии концентрированной серной кислоты образует эфиры :
Образование борнометилового эфира В(ОСН 3 ) 3 является качественной реакцией на Н 3 ВО 3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зелёным пламенем.
Борная кислота может быть получена путём смешения буры ( тетрабората натрия ) с минеральной кислотой, например, соляной :
Является продуктом гидролиза диборана или тригалогенидов бора :
Борный спирт (от лат. Solutio Acidi borici spirituosa) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии , а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении пероральным приёмом для взрослого человека составляет 15-20 г, для детей — 4-5 г .
Борная кислота применяется в медицине с 1860-х годов как антисептическое средство , не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью» .