Interested Article - Стволовые клетки

- 2020-08-15
- 1

Стволовы́е кле́тки — недифференцированные (незрелые) клетки , имеющиеся у многих видов многоклеточных организмов . Стволовые клетки способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей .
Историческая справка
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
|
|
Этот раздел статьи
ещё
не написан
.
|

- 1909: Термин «стволовая клетка» (в оригинале « нем. Stammzelle ») был предложен к широкому использованию 1 июня 1909 года на заседании гематологов в Берлине , где российско-американским гистологом Александром Максимовым методами своего времени были описаны гемопоэтические стволовые клетки в представленном докладе « Лимфоцит как общая стволовая клетка различных элементов крови в эмбриональном развитии и постфетальной жизни млекопитающих » :
Мною теперь обнаружено, что эти примитивные кровяные клетки, как я их называю, никоим образом не являются эритробластами, как следовало бы по общепринятому представлению, а совершенно недифференцированными элементами с круглым светлым ядром и узкой базофильной протоплазмой; они не являются ни красными, ни белыми кровяными тельцами, хотя, скорее всего, их всё же можно было бы назвать белыми кровяными тельцами, поскольку они иногда, в особенности у цыплят, имеют амёбоидную форму и очень похожи на большие лимфоциты. Они далее размножаются, причем в первое время их число возрастает ещё и путём замены эндотелиальных клеток в примитивных сосудах
- 1970: Первые трансплантации аутологичных (своих собственных) стволовых клеток . По некоторым сведениям, в 70-х годах престарелым членам Политбюро ЦК КПСС делали «прививки молодости» по 2-3 раза в год, инъецируя препараты стволовых клеток .
- 1978: в пуповинной крови обнаружены гемопоэтические стволовые клетки .
- 1981: эмбриональные клетки мыши получены из эмбриобласта (внутренней клеточной массы бластоцисты ) учёными Мартином Эвансом , Мэттью Кауфманом и, независимо от них, Гэйл Р. Мартин. Введение в обиход термина «эмбриональная стволовая клетка» приписывается Гэйл Мартин.
- 1992: нейральные стволовые клетки получены in vitro . Разработаны протоколы их культивирования в виде нейросфер .
- 1997: Новым подходом к использованию стволовых клеток в терапии почечной недостаточности стала концепция применения «биоискусственной вспомогательной системы почечных канальцев» (Bioartifical renal tubule assist device, RAD). Это дополнение к «обычному» диализу: систему трубчатых мембран, внутренняя поверхность которых служит опорой для клеток ЭКП, дифференцированных из СК. Система дополняет аппарат «искусственная почка», — при этом кровь пациента фильтруется через мембраны, обмениваясь низкомолекулярными веществами с зафиксированными на них живыми клетками ЭПК .
- 1998: Джеймс Томсон и его сотрудники из Висконсинского университета в Мадисоне вывели первую линию человеческих ЭСК (эмбриональных стволовых клеток).
- 1999: журнал Science признал открытие эмбриональных стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и проекта «Геном человека» .
- В 1999 году под руководством Humes H. D. была создана система, в которой использовались размноженные в течение нескольких пассажей, клетки эпителия проксимальных почечных канальцев поросят. Таким образом, использование «батареи» подобных катриджей может позволить достичь практически физиологической компенсации метаболической и эндокринной функции .
- 2005: перечень заболеваний, при лечении которых была успешно применена трансплантация стволовых клеток, достигает нескольких десятков. Основное внимание уделяется лечению злокачественных новообразований , различных форм лейкозов и других болезней крови . Появляются сообщения об успешной трансплантации стволовых клеток при заболеваниях сердечно-сосудистой и нервной систем. В различных исследовательских центрах проводятся исследования по применению стволовых клеток при лечении инфаркта миокарда и сердечной недостаточности . Разработаны международные протоколы лечения рассеянного склероза . Ищутся подходы к лечению инсульта , болезней Паркинсона и Альцгеймера .
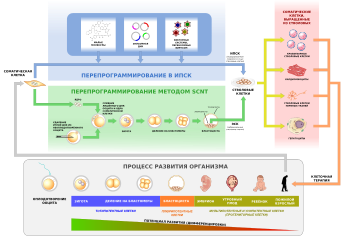
- Август 2006: журнал Cell публикует исследование Кадзутоси Такахаси и Синъя Яманака, посвящённое способу возвращения дифференцированных клеток в плюрипотентное состояние. Начинается эра индуцированных плюрипотентных стволовых клеток .
- Январь 2007: исследователи из Университета Уэйк Форест ( Северная Каролина , США ) под руководством доктора Энтони Атала из Гарварда сообщили об открытии нового вида стволовых клеток, обнаруженных в амниотической жидкости (околоплодных водах). Они могут стать потенциальной заменой ЭСК в исследованиях и терапии.
- Июнь 2007: три независимые исследовательские группы сообщили, что зрелые клетки кожи мышей могут быть репрограммированы в состояние ЭСК. В том же месяце учёный Шухрат Миталипов заявил о создании линии стволовых клеток примата путём терапевтического клонирования .
- Ноябрь 2007: в журнале Cell опубликовано исследование Кадзутоси Такахаси и Синъи Яманаки «Индукция плюрипотентных стволовых клеток из фибробластов зрелого человека при определённых факторах» , а в журнале Science вышла статья «Индуцированные плюрипотентные стволовые клетки, выведенные из соматических клеток человека» Цзюньин Юй, в соавторстве с другими учёными из исследовательской группы . Было доказано, что возможно индуцировать практически любую зрелую клетку человека и придать ей свойства стволовой, вследствие чего необходимость разрушения эмбрионов в лаборатории отпала, хотя предстоит определить риски канцерогенеза в связи с геном Мус и ретровирусным переносом генов.
- Январь 2008: Роберт Ланза и его коллеги из Advanced Cell Technology и Калифорнийского университета в Сан-Франциско вывели первые ЭСК человека без разрушения эмбриона .
- Январь 2008: посредством терапевтического клонирования культивированы клонированные бластоцисты человека.
- Февраль 2008: плюрипотентные стволовые клетки выведены из печени и желудка мыши , эти индуцированные клетки ближе к эмбриональным, чем индуцированные стволовые клетки, выведенные ранее и они не канцерогенны. Кроме того, гены, необходимые для индуцирования плюрипотентных клеток нет необходимости помещать в определённую область, что способствует развитию невирусных технологий репрограммирования клеток .
- Октябрь 2008: Сабина Конрад и её коллеги из Тюбингена ( Германия ) вывели плюрипотентные стволовые клетки из сперматогониальных клеток зрелого яичка человека путём культивирования in vitro с добавлением ФИЛ (фактора ингибирования (подавления) лейкемии).
- 30 октября 2008: эмбрионоподобные стволовые клетки выведены из человеческого волоса .
- Декабрь 2008: впервые опубликовано исследование врачей из Клиники регенеративной медицины Центено-Щульца (Centeno-Schultz Clinic), посвящённое успешной регенерации хряща в коленном суставе человека при использовании аутологичных зрелых МСК .
- 1 марта 2009: Андреаш Надь, Кэйсукэ Кадзи и их коллеги открыли способ выведения эмбрионоподобных стволовых клеток из обычных зрелых клеток с использованием инновационной технологии «обёртывания» для доставки специфических генов в клетки с целью репрограммирования без рисков, которые возникают при использовании вирусов . Помещение генов в клетку осуществляется при помощи электропорации .
- 28 мая 2009: Ким Гвансу и его коллеги из Гарварда заявили о том, что им удалось разработать способ манипулирования клетками кожи для выведения индуцированных плюрипотентных стволовых клеток с учётом индивидуальной специфики пациента, утверждая, что это «окончательное решение проблемы стволовых клеток».
- 2011: израильская исследовательница Инбар Фридрих Бен-Нун возглавила группу учёных, которая вывела первые стволовые клетки вымирающих видов животных . Это прорыв, и благодаря ему можно спасти виды, которым грозит исчезновение .
- 2012: Введение пациентам стволовых клеток, взятых из их собственного костного мозга через три или семь дней после инфаркта миокарда, является хотя и безопасным, но неэффективным методом лечения — таковы результаты клинического исследования, проведённого при поддержке Национального института здоровья США. Однако исследования, проведённые немецкими специалистами в отделении кардиологии в Гамбурге, показали положительные результаты в лечении сердечной недостаточности, но не инфаркта миокарда.
- 2012: Группа японских исследователей во главе с профессором Митинори Сайто из Университета Киото впервые в истории науки смогли вырастить яйцеклетки из стволовых клеток, оплодотворить их и добиться рождения здорового потомства у лабораторных мышей. 5 октября в электронном выпуске научного журнала Science они высказали предположение, что результаты их исследований внесут вклад в решение проблемы бесплодия .
- 23 января 2013: та же группа Центра исследования и применения стволовых клеток Университета Киото вырастила из стволовых клеток ткани почек, надпочечников и половые клетки: были получены пять типов клеток почек, а также выращен фрагмент почечного канальца, участвующего в фильтрации крови.
- 5 августа 2013: В результате многолетних опытов исследователей Маастрихтского университета на пути решения проблемы дефицита продовольствия в мире, создано мясо для стосорокаграммового гамбургера . Оно «сплетено» из 20 тысяч белковых волокон, выращенных за три месяца из коровьих стволовых клеток. В его производство инвестировано 250 000 евро .
- 2019: в Калифорнии генетики создали генную терапию в результате которой, стволовые клетки становятся «невидимыми» для иммунитета человека. Успешный опыт был проведён на «очеловеченных» мышах .
- Март 2020: Адам Кастильехо — второй человек в мире, который излечился от ВИЧ путём пересадки стволовых клеток донорского костного мозга.
Свойства

Все стволовые клетки обладают двумя неотъемлемыми свойствами:
- Самообновление, то есть способность сохранять неизменный фенотип после деления (без дифференцировки).
- Потентность (дифференцирующий потенциал), или способность давать потомство в виде специализированных типов клеток.
Самообновление
Существуют два механизма, поддерживающих популяцию стволовых клеток в организме:
- Асимметричное деление, при котором образуется две разных клетки (одна стволовая клетка и одна дифференцированная клетка ).
- Стохастическое деление: одни стволовые клетки делятся на две более специализированные, другие при делении дают две стволовых клетки.
Дифференцирующий потенциал
Классифицировали Вейгерс и Вейсман по способности продуцировать клеточные линии.
Дифференцирующий потенциал, или потентность, стволовых клеток — это способность производить определённое количество разных типов клеток. В соответствии с потентностью стволовые клетки делятся на следующие группы:
- Тотипотентные (омнипотентные) стволовые клетки могут дифференцироваться в клетки эмбриональных и экстраэмбриональных тканей, организованные в виде трёхмерных связанных структур (тканей, органов, систем органов, организма). Такие клетки могут дать начало полноценному жизнеспособному организму. К ним относится оплодотворённая яйцеклетка , или зигота. Клетки, образованные при первых нескольких циклах деления зиготы, также являются тотипотентными у большинства биологических видов. Однако к ним не относятся, например, круглые черви , зигота которых утрачивает тотипотентность при первом делении. У некоторых организмов дифференцированные клетки также могут обретать тотипотентность. Так, срезанную часть растения можно использовать для выращивания нового организма именно благодаря этому свойству.
- Плюрипотентные стволовые клетки являются потомками тотипотентных и могут давать начало практически всем тканям и органам, за исключением экстраэмбриональных тканей (например, плаценты ). Из этих стволовых клеток развиваются три зародышевых листка : эктодерма , мезодерма и энтодерма . В 2015 году учёные обнаружили новый тип клеток — плюрипотентные стволовые клетки, специфичные к месту (region-selective pluripotent stem cells). Они самостоятельно колонизируют ту или иную область тела зародыша, после чего могут развиваться в клетки различных тканей .
- Мультипотентные стволовые клетки порождают клетки разных тканей, но многообразие их видов ограничено пределами одного зародышевого листка. Эктодерма даёт начало нервной системе , органам чувств , переднему и заднему отделам кишечной трубки , кожному эпителию . Из мезодермы формируются хрящевой и костный скелет , кровеносные сосуды , почки и мышцы . Из энтодермы — в зависимости от биологического вида — образуются различные органы, ответственные за дыхание и пищеварение . У человека это — слизистая оболочка кишечника, уротелий мочевого пузыря , а также печень , поджелудочная железа и лёгкие .
- Олигопотентные клетки могут дифференцироваться лишь в некоторые, близкие по свойствам, типы клеток. К ним, например, относятся клетки лимфоидного и миелоидного рядов, участвующие в процессе кроветворения .
- Унипотентные клетки (клетки-предшественницы, бластные клетки) — незрелые клетки, которые, строго говоря, уже не являются стволовыми, так как могут производить лишь один тип клеток. Они способны к многократному самовоспроизведению, что делает их долговременным источником клеток одного конкретного типа и отличает от не стволовых. Однако их способность к самовоспроизведению ограничена определённым количеством делений, что также отличает их от истинно стволовых клеток. К клеткам-предшественницам относятся, к примеру, некоторые из миосателлитоцитов , участвующих в образовании скелетной и мышечной тканей.
Классификация

A: Колонии стволовых клеток, которые ещё не дифференцированы.
B: Нервные клетки, пример после дифференциации.
Стволовые клетки можно разделить на три основные группы в зависимости от источника их получения: эмбриональные, фетальные и постнатальные (стволовые клетки взрослого организма).
Эмбриональные стволовые клетки
Эмбриональные стволовые клетки (ЭСК) образуют внутреннюю клеточную массу (ВКМ), или эмбриобласт , на ранней стадии развития эмбриона . Они являются плюрипотентными .
Важный плюс ЭСК состоит в том, что они не экспрессируют HLA (human leucocyte antigens), то есть не вырабатывают антигены тканевой совместимости. Каждый человек обладает уникальным набором этих антигенов , и их несовпадение у донора и реципиента является важнейшей причиной несовместимости при трансплантации . Соответственно, шанс того, что донорские эмбриональные клетки будут отторгнуты организмом реципиента очень невысок.
При пересадке иммунодефицитным животным эмбриональные стволовые клетки способны образовывать опухоли сложного (многотканевого) строения — тератомы , некоторые из них могут стать злокачественными. Достоверных данных, о том как ведут себя эти клетки в иммунокомпетентном организме, например, в организме человека, нет. Вместе с тем, следует отметить, что клинические испытания с применением дифференцированных дериватов (производных клеток) ЭСК уже начаты.
Одним из главных недостатков ЭСК является невозможность использования аутогенного, то есть собственного материала, при трансплантации, поскольку выделение ЭСК из эмбриона несовместимо с его дальнейшим развитием.
Фетальные стволовые клетки
Фетальные стволовые клетки получают из плодного материала после аборта (обычно срок гестации, то есть внутриутробного развития плода, составляет 9—12 недель) . Фетальные стволовые клетки являются смесью мультипотентных и унипотентных стволовых клеток . Естественно, изучение и использование такого биоматериала также порождает этические проблемы. Проблемой является и нелегальный рынок препаратов фетальных стволовых клеток в России . Британская компания ReNeuron исследует возможности использования фетальных стволовых клеток для терапии инсульта . Эти клетки уже начали дифференцировку , и, следовательно, каждая из них, во-первых, может пройти только ограниченное число делений, и, во-вторых, дать начало не любым, а достаточно определённым видам специализированных клеток. Так, из клеток фетальной печени могут развиться специализированные клетки печени и кроветворные клетки. Из фетальной нервной ткани , соответственно, развиваются более специализированные нервные клетки .
Постнатальные стволовые клетки
Несмотря на то, что стволовые клетки зрелого организма обладают меньшей потентностью в сравнении с эмбриональными и фетальными стволовыми клетками, то есть могут порождать меньшее количество различных типов клеток, этический аспект их исследования и применения не вызывает серьёзной полемики . Кроме того, возможность использования аутогенного материала обеспечивает эффективность и безопасность лечения. Стволовые клетки взрослого организма можно подразделить на три основных группы: гемопоэтические (кроветворные), мультипотентные мезенхимальные (стромальные) и тканеспецифичные прогениторные клетки .
Иногда в отдельную группу выделяют клетки пуповинной крови, поскольку они являются наименее дифференцированными из всех клеток зрелого организма [ источник не указан 3721 день ] , то есть обладают наибольшей потентностью. Пуповинная кровь в основном содержит гемопоэтические стволовые клетки, а также мультипотентные мезенхимальные, но в ней присутствуют малые количества других разновидностей стволовых клеток, при определённых условиях способные дифференцироваться в клетки различных органов и тканей.
Гемопоэтические стволовые клетки
Гемопоэтические стволовые клетки (ГСК) — мультипотентные стволовые клетки, дающие начало всем клеткам крови миелоидного ( моноциты , макрофаги , нейтрофилы , базофилы , эозинофилы , эритроциты , мегакариоциты и тромбоциты , дендритные клетки ) и лимфоидного рядов ( Т-лимфоциты , В-лимфоциты и естественные киллеры ). Определение гемопоэтических клеток было основательно пересмотрено в течение последних 20 лет. Гемопоэтическая ткань содержит клетки с долгосрочными и краткосрочными возможностями к регенерации , включая мультипотентные, олигопотентные и клетки-предшественники. Миелоидная ткань содержит одну ГСК на 10 000 клеток. ГСК являются неоднородной популяцией . Различают три субпопуляции ГСК, в соответствии с пропорциональным отношением лимфоидного потомства к миелоидному (Л/M). У миелоидно ориентированных ГСК низкое Л/М соотношение (>0, <3), у лимфоидно ориентированных — высокое (>10). Третья группа состоит из «сбалансированных» ГСК, для которых 3 ≤ Л/M ≤ 10. В настоящее время активно исследуются свойства различных групп ГСК, однако промежуточные результаты показывают, что только миелоидно ориентированные и «сбалансированные» ГСК способны к продолжительному самовоспроизведению. Кроме того, эксперименты по трансплантации показали, что каждая группа ГСК преимущественно воссоздаёт свой тип клеток крови, что позволяет предположить наличие наследуемой эпигенетической программы для каждой субпопуляции.
Популяция ГСК формируется во время эмбриогенеза , то есть эмбрионального развития. Доказано, что у млекопитающих первые ГСК обнаруживаются в областях мезодермы , называемых аорта , гонада и мезонефрос , до формирования костного мозга популяция расширяется в фетальной печени. Такие исследования способствуют пониманию механизмов , ответственных за генезис (формирование) и расширение популяции ГСК, и, соответственно, открытию биологических и химических агентов (действующих веществ), которые в конечном счёте могут быть использованы для культивации ГСК in vitro .
Основным источником ГСК является костный мозг . Этот источник и сегодня наиболее широко используется в трансплантологии (см. Трансплантация гемопоэтических стволовых клеток ). ГСК располагаются в костном мозге у взрослых, включая тазовые кости , рёбра , грудину и другие кости. Клетки могут быть получены непосредственно из тазовых костей при помощи иглы и шприца или из крови, после предварительной обработки цитокинами , включая G-CSF (гранулоцитарный колониестимулирующий фактор), способствующий выходу стволовых клеток из костного мозга.
Мультипотентные мезенхимальные стволовые клетки
Мультипотентные мезенхимальные стромальные клетки (ММСК) — мультипотентные стволовые клетки, способные дифференцироваться в остеобласты (клетки костной ткани), хондроциты (хрящевые клетки) и адипоциты (жировые клетки) .
Предшественниками ММСК в эмбриогенный период развития являются мезенхимальные стволовые клетки (МСК). Они могут быть обнаружены в местах распространения мезенхимы , то есть зародышевой соединительной ткани.
Основным источником ММСК является костный мозг . Кроме того, они обнаружены в жировой ткани и ряде других тканей с хорошим кровоснабжением . Существует ряд доказательств того, что естественная тканевая ниша ММСК расположена периваскулярно — вокруг кровеносных сосудов. Кроме того, ММСК были обнаружены в пульпе молочных зубов, амниотической (околоплодной) жидкости , пуповинной крови и вартоновом студне пупочного канатика. Эти источники исследуются, но редко применяются на практике. Например, выделение молодых ММСК из вартонова студня представляет собой крайне трудоёмкий процесс, поскольку клетки в нём также располагаются периваскулярно. В 2005—2006 годах специалисты по ММСК официально определили ряд параметров, которым должны соответствовать клетки, чтобы отнести их к популяции ММСК. Были опубликованы статьи, в которых представлен иммунофенотип ММСК и направления ортодоксальной дифференцировки. К ним относится дифференцировка в клетки костной, жировой и хрящевой тканей.
Был проведён ряд экспериментов по дифференцировке ММСК в нейроноподобные клетки, но исследователи по-прежнему сомневаются, что полученные нейроны являются функциональными. Эксперименты также проводятся в области дифференцировки ММСК в миоциты — клетки мышечной ткани . Важнейшей и наиболее перспективной областью клинического применения ММСК является котрансплантация совместно с ГСК в целях улучшения приживления образца костного мозга или стволовых клеток пуповинной крови.
Многочисленные исследования показали, что ММСК человека могут избегать отторжения при трансплантации, вступать во взаимодействие с дендритными клетками и Т-лимфоцитами и создавать иммуносупрессивную микросреду посредством выработки цитокинов. Было доказано, что иммуномодулирующие функции ММСК человека повышаются, когда их пересаживают в воспалённую среду с повышенным уровнем гамма-интерферона . Другие исследования противоречат этим выводам, что обусловлено гетерогенной природой изолированных МСК и значительными различиями между ними, в зависимости от способа культивирования, а также может быть обусловлено эффектами клеточной сенесценции .
МСК могут быть активированы в случае необходимости. Однако эффективность их использования относительно низка. Так, к примеру, повреждение мышц даже при трансплантации МСК заживает очень медленно. В настоящее время проводятся исследования по активации МСК. Ранее проведённые исследования по внутривенной трансплантации МСК показали, что этот способ трансплантации часто приводит к кризу отторжения и сепсису . Сегодня признано, что заболевания периферических тканей, например, воспаление кишечника лучше лечить не трансплантацией , а методами, повышающими локальную концентрацию МСК.
Однако, исследования эффективности применения МСК для реэпителизации повреждённых кожных покровов, например, при синдроме диабетической стопы, показали свою результативность в клинических исследованиях .
Тканеспецифичные прогениторные клетки
Тканеспецифичные прогениторные клетки (клетки-предшественницы) — малодифференцированные клетки, которые располагаются в различных тканях и органах и отвечают за обновление их клеточной популяции, то есть замещают погибшие клетки. К ним, например, относятся миосателлитоциты (предшественники мышечных волокон), клетки-предшественницы лимфо- и миелопоэза . Эти клетки являются олиго- и унипотентными и их главное отличие от других стволовых клеток в том, что клетки-предшественницы могут делиться лишь определённое количество раз, в то время как другие стволовые клетки способны к неограниченному самообновлению. Поэтому их принадлежность к истинно стволовым клеткам подвергается сомнению.
Отдельно исследуются нейральные стволовые клетки, которые также относятся к группе тканеспецифичных. Они дифференцируются в процессе развития эмбриона и в плодный период, в результате чего происходит формирование всех нервных структур будущего взрослого организма, включая центральную и периферическую нервные системы. Эти клетки были обнаружены и в ЦНС взрослого организма, в частности, в субэпендимальной зоне, в гиппокампе , обонятельном мозге и т. д. Несмотря на то, что большая часть погибших нейронов не замещается, процесс нейрогенеза во взрослой ЦНС всё-таки возможен за счёт нейральных стволовых клеток, то есть популяция нейронов может «восстанавливаться», однако это происходит в таком объёме, что не сказывается существенно на исходах патологических процессов .
Характеристики эмбриональных стволовых клеток
- Плюрипотентность — способность образовывать любой из примерно 350 типов клеток взрослого организма (у млекопитающих) ;
- Хоуминг — способность стволовых клеток, при введении их в организм, находить зону повреждения и фиксироваться там, исполняя утраченную функцию;
- Тотипотентность — способность дифференцироваться в целостный организм (11 дней после оплодотворения);
- Факторы, которые определяют уникальность стволовых клеток, находятся не в ядре , а в цитоплазме . Это избыток мРНК всех 3 тыс. генов [ источник не указан 4709 дней ] , которые отвечают за раннее развитие зародыша ;
- Теломеразная активность. При каждой репликации часть теломер утрачивается (см. Предел Хейфлика ). В стволовых, половых и опухолевых клетках есть теломеразная активность, концы их хромосом надстраиваются, то есть эти клетки способны проходить потенциально бесконечное количество клеточных делений , они бессмертны.
-
Мышиные эмбриональные стволовые клетки с флуоресцентным маркером
-
Колония эмбриональных стволовых клеток человека на фидерном слое фибробластов мыши
Стволовые клетки раковых опухолей
В 2012 году для глиобластомы , папилломы и карциномы кожи и аденомы кишечника было доказано существование ограниченного пула особых , которые являются предшественниками других клеток, и именно они отвечают за образование и рост опухоли .
Использование в медицине
Предполагается, что в будущем при помощи стволовых клеток удастся восстанавливать ткани организма, повреждённые в результате травмы или дегенеративного заболевания: пересаживать донорские стволовые клетки в повреждённый орган и заставлять их делиться, превращаясь в клетки нужного типа. Однако в нынешнее время эффективно лечить таким образом удаётся лишь пациентов с лейкозами , в других же областях медицины использование стволовых клеток до сих пор не дало надёжных результатов: эффективность этого метода лечения не доказана, и риски, связанные с ним, очевидны: известны случаи возникновения опухолей в результате пересадки донорских стволовых клеток .
Однако, несмотря на это, существует множество клиник, где проводится полуподпольное лечение стволовыми клетками от самых разных заболеваний и в целях омоложения. Как правило, в этих случаях предлагаемое лечение не разрешено и не проверено на эффективность и безопасность. Кроме того, с исследованиями в области лечения стволовыми клетками связано большое количество отозванных из журналов публикаций и скандалов .
Использование стволовых клеток и онкологические заболевания
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
В СМИ активно шли дебаты, привели ли инъекции эмбриональных стволовых клеток к заболеванию раком и последующей преждевременной смерти многих известных людей, в основном артистов — Александра Абдулова , Веры Глаголевой , Ильи Олейникова , Любови Полищук , Дмитрия Хворостовского , Жанны Фриске , Михаила Задорнова , Валентины Толкуновой , Клары Лучко , Анны Самохиной , Олега Янковского и других . [ неавторитетный источник ] Анализы знаменитых пациентов показывали, что в организме актёров происходит обновление, ускорение жизнедеятельности. Однако вскоре появилась страшная статистика: те, кто применял инъекции стволовых клеток, сначала реально молодели, а потом очень быстро «сгорали» от рака, в основном глиобластомы (рака мозга), заболевания во многом загадочного, которое характеризуется множественной генетической поломкой в клетках глии мозга, что приводит к быстрому экспансивному росту злокачественной опухоли.
После инъекций стволовых клеток начинается активное деление не только здоровых, но и патологичных клеток организма, включая злокачественные, которых тем больше, чем старше организм. Временный импульс молодости проходит, и возвращается упадок, а потом проявляются разные последствия. Так, если введённые клетки приживаются, то вследствие противоречия с клетками организма и иммунной системой они сами часто перерождаются в раковые. В любом случае это стрессовое воздействие на иммунитет, на фоне которого способна реализоваться патология.
Законодательное регулирование
В России
Распоряжением Правительства РФ от 23 декабря 2009 г. (п. 6) Минздравосцразвития России, Минпромторгу России и Минобрнауки России было поручено до конца 2010 г. разработать и представить на рассмотрение в Государственную думу РФ проект закона «О применении биомедицинских технологий в медицинской практике», регламентирующего медицинское применение стволовых клеток , как одной из биомедицинских технологий . Поскольку законопроект вызвал возмущение общественности и учёных, он был отправлен на доработку и на тот момент не принят.
1 июля 2010 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала первое [ уточнить ] разрешение на применение новой медицинской технологии ФС № 2010/255 (лечение собственными стволовыми клетками).

3 февраля 2011 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала разрешение на применение новой медицинской технологии ФС № 2011/002 (лечение донорскими стволовыми клетками следующих патологий: возрастные изменения кожи лица второй или третьей степени, наличие раневого дефекта кожи, трофической язвы, лечение аллопеции , атрофическое поражение кожи, в том числе атрофические полосы (striae), ожоги, диабетической стопы).
В 2015 Госдума приняла в первом чтении проект закона «О биомедицинских клеточных продуктах», регламентирующего разработку, испытания, регистрацию, производство, хранение и продажу стволовых и других клеточных продуктов . В 2016 году данный закон, легализующий использование клеточных технологий, включая применение стволовых клеток , был окончательно принят Госдумой, одобрен Советом Федерации и вступил в силу с января 2017 года .
На Украине
С апреля 2013 года Минздрав Украины разрешил проведение клинических испытаний (приказ МЗ Украины № 630 «О проведении клинических испытаний стволовых клеток», 2007 г. ) по лечению следующих патологий с применением стволовых клеток: панкреонекроз, ожоговая болезнь, хроническая ишемия нижних конечностей .
Юридические моменты
18 октября 2011 года верховный Суд Европейского союза «ECJ» признал [ уточнить ] в ходе уточнения статьи 6(2)(c) директивы европарламента 98/44/EC, запрещающей патентование ряда изобретений, что человеческую яйцеклетку надо считать человеческим эмбрионом с точки зрения данной статьи с момента оплодотворения , и запретил любые евгенические эксперименты и манипуляции с эмбриональными стволовыми клетками человека [ уточнить ] . На самом деле решением по делу C-34/10 «Oliver Brüstle v Greenpeace» был произведён запрет патентования процессов, при которых стволовые клетки извлекаются из эмбриона на стадии «blastocyst» с разрушением данного эмбриона .
К 2014 году тот же суд уточнил, что партеногенетически активированная яйцеклетка всё же не составляет собой человеческий эмбрион, и, таким образом, разрешил патентовать стволовые клетки, полученные из неоплодотворённых яйцеклеток и связанные с ними технологии .
См. также
- Эмбриональные стволовые клетки
- Бессмертие
- Нейросфера
- Индуцированные стволовые клетки
- Ниша стволовой клетки
- Репрограммирование клеток
Примечания
-
*
от 29 июня 2009 на
Wayback Machine
. Originally in: Folia Haematologica 8.1909, 125—134. Republished in: Cell Ther Transplant. 2009,1:e.000040.01.
(нем.)
- А. Максимов Folia Haematologica 8.1909, 125—134. (рус.)
- Jonathan Friedberg, Shahrukh Hashmi.
- Appelbaum FR. от 18 мая 2018 на Wayback Machine
- Вайнбойм, П. // Журнал «Партнёр». — Dortmund, Germany: «Partner» MedienHaus GmbH & Co. KG, 2004. — Т. 82 , № 7 . 18 мая 2018 года.
- Prindull G, Prindull B, Meulen N. от 24 июля 2018 на Wayback Machine
- Humes HD, MacKay SM, Funke AJ, Buffington DA. от 18 мая 2018 на Wayback Machine
- Е. В. Шляхто. Трансляционная медицина. Сборник научных трудов, Спб., 2010. — 416 с., ФГУ «ФЦСКЭ им В. А. Алмазова» Министерства здравоохранения и социального развития РФ. [ уточнить ]
- Nikolovski J, Gulari E, Humes HD. от 23 июля 2018 на Wayback Machine
- Humes HD, MacKay SM, Funke AJ, Buffington DA. от 23 июля 2018 на Wayback Machine
- Takahashi K, Yamanaka S. от 17 июня 2018 на Wayback Machine
- от 19 мая 2018 на Wayback Machine The Associated Press, 2007.
- Kazutoshi Takahashi, Koji Tanabe, Mari Ohnuki, Megumi Narita, Tomoko Ichisaka, Kiichiro Tomoda, Shinya Yamanaka. от 29 октября 2013 на Wayback Machine
- Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J, Jonsdottir GA, Ruotti V, Stewart R, Slukvin II, Thomson JA. от 22 сентября 2018 на Wayback Machine
- Chung Y, Klimanskaya I, Becker S, Li T, Maserati M, Lu SJ, Zdravkovic T, Ilic D, Genbacev O, Fisher S, Krtolica A, Lanza R. от 19 мая 2018 на Wayback Machine
- от 8 февраля 2017 на Wayback Machine Nature Reports Stem Cells, 2008.
- Centeno CJ, Busse D, Kisiday J, Keohan C, Freeman M, Karli D. от 11 сентября 2017 на Wayback Machine
- Ben-Nun IF, Montague SC, Houck ML, Tran HT, Garitaonandia I, Leonardo TR, Wang YC, Charter SJ, Laurent LC, Ryder OA, Loring JF. от 19 мая 2018 на Wayback Machine
- от 19 мая 2018 на Wayback Machine Haaretz Daily Newspaper, 2011.
- . Дата обращения: 15 ноября 2012. 16 ноября 2012 года.
- . Дата обращения: 17 января 2013. 17 ноября 2012 года.
- от 7 апреля 2013 на Wayback Machine (Дата обращения: 24 января 2013)
- от 4 марта 2016 на Wayback Machine . Публикация исследовательской лаборатории на сайте Киотского университета, 23 января 2013. (англ.) (Дата обращения: 24 января 2013)
- . Дата обращения: 5 августа 2013. 13 августа 2013 года.
- . Дата обращения: 7 августа 2013. 14 августа 2013 года.
- . РИА Новости (20190218T1905+0300Z). Дата обращения: 19 февраля 2019. 19 февраля 2019 года.
- Sonja Schrepfer, Lewis L. Lanier, Mark M. Davis, Hermann Reichenspurner, J. Victor Garcia. (англ.) // Nature Biotechnology . — Nature Publishing Group , 2019-02-18. — P. 1 . — ISSN . — doi : . 4 апреля 2019 года.
- Александр Марков. . Научно-популярный проект «Элементы большой науки» (8 ноября 2012). Дата обращения: 18 мая 2018. 19 мая 2018 года.
- . Дата обращения: 7 мая 2015. 15 мая 2015 года.
- Васютин И. А., Люндуп А. В., Кузнецов С. Л. // Вестник Российской академии медицинских наук. — 2019. — Т. 74 , вып. 3 , № 3 . — С. 176—184 . — ISSN . — doi : . 2 октября 2019 года.
- . Дата обращения: 18 мая 2018. 17 мая 2018 года.
- Введение в методы культуры клеток, биоинженерии органов и тканей / В. П. Шахов [и др.]. Томск, 2004. 385 с.
- Вермель, А. Е. Стволовые клетки : общая характеристика и перспективы применения в клинической практике / А. Е. Вермель // Клиническая медицина. 2004. № 1. С. 5-11.
- . Дата обращения: 18 мая 2018. 19 мая 2018 года.
- Kulakov A., Kogan E., Brailovskaya T., Vedyaeva A., Zharkov N., Krasilnikova O., Krasheninnikov M., Baranovskii D., Rasulov T., Klabukov I. // Dentistry Journal. — 2021. — Т. 9 , вып. 9 . — С. 101 . — ISSN . — doi : .
- Lyamina S., Baranovskii D., Kozhevnikova E., Ivanova T., Kalish S., Sadekov T., Klabukov I., Maev I., Govorun V. // International Journal of Molecular Sciences. — 2023. — Т. 24 , вып. 7 . — С. 6372 . — ISSN . — doi : .
- Maksimova N., Krasheninnikov M., Zhang Y., Ponomarev E., Pomytkin I., Melnichenko G., Lyundup A. // Cytotherapy. — 2017. — doi : . 21 января 2022 года.
- . Vizlit.ru . Дата обращения: 23 мая 2019. 7 мая 2021 года.
- . Элементы.ру . Дата обращения: 12 ноября 2012. 19 ноября 2012 года.
- ↑ Талантов, Пётр Валентинович . 0,05 : Доказательная медицина от магии до поисков бессмертия. — М. : АСТ : CORPUS, 2019. — 560 с. — (Библиотека фонда «Эволюция»). — ББК 54.1 . — УДК . — ISBN 978-5-17-114111-0 .
- . Дата обращения: 11 мая 2018. 11 мая 2018 года.
- от 18 мая 2018 на Wayback Machine , Батенёва Т., газета «Известия», 2010.
- от 18 мая 2018 на Wayback Machine , журнал «Гены & Клетки», 2010.
- от 22 августа 2016 на Wayback Machine / Ремедиум
- от 18 мая 2018 на Wayback Machine , Шубина Д., журнал «Vademecum», 2015.
- от 18 мая 2018 на Wayback Machine , Добрюха А., газета «Комсомольская правда», 2016.
- . Дата обращения: 18 мая 2018. 18 мая 2018 года.
- от 18 мая 2018 на Wayback Machine , Российская газета — Федеральный выпуск № 7007 (139), 2016.
- . Дата обращения: 11 мая 2011. Архивировано из 12 октября 2014 года.
- . Интерфакс-Украина. 2013-04-05. из оригинала 10 сентября 2014 . Дата обращения: 9 сентября 2014 .
- от 4 ноября 2012 на Wayback Machine // Константин ЩЕГЛОВ, обозреватель «МГ». «Медицинская газета», 13 апреля 2012 года (Демоскоп № 507—508, 16 — 30 апреля 2012); «Медицинская газета», 13 апреля 2012 [ уточнить ]
- от 19 мая 2018 на Wayback Machine // Court of Justice of the European Union. PRESS RELEASE No 112/11. Luxembourg, 18 October 2011
- . Дата обращения: 10 августа 2016. 21 октября 2016 года.
- . Дата обращения: 10 августа 2016. 21 сентября 2016 года.
- от 14 марта 2021 на Wayback Machine : Directive 98/44/EC — Article 6(2)(c) — Legal protection of biotechnological inventions — Extraction of precursor cells from human embryonic stem cells — Patentability — Exclusion of ‘uses of human embryos for industrial or commercial purposes’ — Concepts of ‘human embryo’ and ‘use for industrial or commercial purposes’. от 19 мая 2018 на Wayback Machine Решение по Case C‑34/10: « any human ovum after fertilisation … constitute a ‘human embryo’ within the meaning of Article 6(2)(c) of the Directive; (shall be considered unpatentable: … (c) uses of human embryos for industrial or commercial purposes;)»
-
Ewen Callaway& Alison Abbott (2014-12-18).
.
(англ.)
. Nature News.
из оригинала
10 августа 2016
. Дата обращения:
10 августа 2016
.
In a press release, the European court said: "The mere fact that a parthenogenetically-activated human ovum commences a process of development is not sufficient for it to be regarded as a human embryo."
- от 11 ноября 2020 на Wayback Machine / Court of Justice of the European Union PRESS RELEASE No 181/14 Luxembourg, 18 December 2014, Judgment in Case C-364/13 International Stem Cell Corporation v Comptroller General of Patents, Designs and Trade Marks
Ссылки
- , Корочкин Л. И., журнал «Природа», 2005, № 6.
- Anthony Atala (ed): . Woodhead Publishing 2012
- Биология стволовых клеток и клеточные технологии. Учебник для студентов медицинских вузов, в 2 т. / под ред. акад. РАН и РАМН М. А. Пальцева — 2009
- Борис Попов (2010) Введение в клеточную биологию стволовых клеток. ISBN 978-5-299-00430-4
- Dominici, M. L. B. K., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F. C., Krause, D. S., … & Horwitz, E. M. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8(4), 315—317. PMID doi :
- Myret Ghabriel, Ahmed El Hosseiny, Ahmed Moustafa, Asma Amleh (2021). . bioRxiv 2021.05.25.445659; doi: doi :
- 2020-08-15
- 1