Interested Article - Аноикис

- 2021-02-01
- 2
Аноики́с ( англ. anoikis , от др.-греч. ἀν- "без", οἶκος - "дом") — частный случай клеточной гибели путём апоптоза , которая наступает в ответ на неправильную адгезию клеток (связь с внеклеточным матриксом ) или её утрату. Правильная адгезия клетки ко внеклеточному матриксу ( англ. extracellular matrix, ECM ) необходима для того, чтобы понять, правильное ли место занимает клетка. Удаление клеток, потерявших связь со своим окружением, препятствует их связыванию с неправильным субстратом и дальнейшему росту. Таким образом, аноикис необходим для развития и поддержания гомеостаза тканей , а его неправильная регуляция имеет место при некоторых болезнях. Аноикис был описан у некоторых типов клеток, однако, судя по всему, клетки из различных тканей используют разные молекулярные пути, приводящие к аноикису .
Хотя зависимость клеток от прикрепления к внеклеточному матриксу была известна давно, явление аноикиса в современном понимании было описано в начале 1990-х, когда исследовательские группы Мартина Шварца ( англ. Martin Schwartz ) и Стива Фриша ( англ. Steve Frisch ) практически одновременно опубликовали результаты своих исследований, в которых показали, что клетки, утратившие прикрепление к внеклеточному матриксу, подвергались программируемой гибели по типу апоптоза .
Молекулярные механизмы

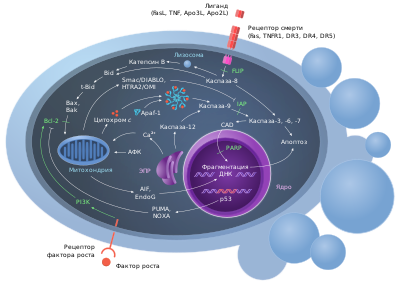
Несмотря на особенное название, аноикис по сути представляет собой апоптоз. Инициация и дальнейший ход аноикиса могут запускаться различными путями, которые в конечном счёте приводят к активации каспаз и (отличительные черты апоптоза). Как и классический апоптоз, аноикис может запускаться внутренним образом, через повреждение митохондрий, и внешним, в ответ на активацию поверхностных рецепторов смерти. Ключевую роль во внешнем и внутреннем пути аноикиса играют белки . Среди них есть и антиапоптотические белки, такие как Bcl-2 , и , и проапоптотические, такие как , и (мульти-ВН3-доменные белки) и , , , , , и (белки, содержащие только домен ВН3, или только-ВН3 белки ( англ. BH3-only proteins )) .
Внутренний путь
При внутреннем пути аноикиса активация каспаз происходит вследствие нарушения целостности митохондриальной мембраны , которая обусловлена формированием олигомеров про-апоптотических белков семейства Bcl-2 на : они формируют каналы в мембране и резко увеличивают её проницаемость. Важную роль в формировании каналов в митохондриальной мембране играют . Разрушение внешней митохондриальной мембраны приводит к высвобождению цитохрома с , который вместе с каспазой 9 и фактором активации апоптотических протеаз ( англ. apoptosis protease activating factor, APAF ) формирует апоптосому. Финальная инициаторная стадия заключается в активации эффекторной каспазы 3 и начале эффекторного этапа апоптоза. За активацию аноикиса по внутреннему пути отвечает в основном белок Bim, хотя, возможно, в этом также участвует Bid. Bim активируется при откреплении клеток от ЕСМ и быстро запускает сборку олигомеров Bax–Bak на внешней митохондриальной мембране. В состоянии покоя Bim связан с динеинами и актиновыми микрофиламентами , пока потеря связи интегринов с ЕСМ не приведёт к его высвобождению и транслокации в митохондрии, где он взаимодействует с Bcl-XL, сводя на нет его активность по стимуляции выживания клетки. Утрата связи интегринов с ЕСМ подавляет фосфорилирование Bim ( англ. extracellular signal-regulated kinase, ERK ), и фосфоинозитид-3-киназой (PI3K)/ Akt . Благодаря этому Bim перестаёт угрожать разрушение в протеасомах , и начинается его накопление в клетке. Таким образом, эти два процесса приводят к накоплению Bim в цитоплазме и повышению его доступности .
Накапливаются доказательства участия в эффекторной фазе аноикиса других только ВН3-белков в различных типах тканей. Например, транскрипция Noxa и Puma регулируется p53 , и было отмечено их участие в аноикисе у фибробластов . Более того, в эпителиальных клетках Bcl-2-модифицирующий фактор (Bmf) выступает как «страж», замечающий нарушения в цитоскелете и преобразующий эту информацию в сигнал смерти. В самом деле, при откреплении клеток от матрикса Bmf высвобождается из моторного комплекса, в котором он находился в связанном с миозином V состоянии, и накапливается в митохондриях, где сводит на нет активность Bcl-2 и приводит к высвобождению цитохрома c , а значит, и дальнейшему развитию аноикиса .
Внешний путь
Внешний путь аноикиса начинается со связывания внеклеточных лигандов смерти, например, (FasL) или фактора некроза опухоли -α (TNF-α) со своими трансмембранными рецепторами ( Fas-рецептором и TNFR соответственно), что приводит к сборке ( англ. death-inducing signalling complex, DISC ). DISC через FADD привлекает и связывает несколько молекул каспазы 8 . Аутоактивированная каспаза 8 затем протеолитически активирует каспазы 3 и 7, которые продолжают расщепление различных внутриклеточных белков и в конце концов приводят к гибели клетки. Каспаза 8 может не только активировать эффекторные каспазы (внешний аноикис I типа), но и разрезать только-ВН3-белок Bid (внешний аноикис II типа). Обрезанная форма Bid (tBid) способствует выходу цитохрома с из митохондрий и сборке апоптосомы .
Утрата связи с ЕСМ приводит к повышению экспрессии Fas и FasL и понижению экспрессии — эндогенного ингибитора сигнальных путей Fas. Кроме того, изменения формы клетки, которые происходят при её откреплении (округление клетки), могут запускать внешний путь аноикиса, в основном через Fas. Наконец, активация рецепторов смерти может в конечном счёте привести к повреждению митохондрий, так что внешний и внутренний пути аноикиса пересекаются .
Активация каспазы 3 — событие, общее для внутреннего и внешнего путей аноикиса. Она запускает каскад протеолитических реакций, разрушающих такие сигнальные молекулы, как (FAK), Cas и . Разрушение FAK сводит на нет её способствование выживанию и разрушает фокальные контакты . Разрезание p130Cas даёт С-концевой фрагмент, который регулирует транскрипцию ингибитора циклин-зависимых киназ p21 ; таким образом, он обеспечивает дальнейший ход аноикиса, блокируя клеточный цикл . Открепившиеся клетки, у которых каспаза 3 разрезала FAK и p130Cas, могут далее претерпеть последующие стадии аноикиса .
Физиологические функции и защита от аноикиса
Аноикис не даёт возможности эпителиальным клеткам, по какой-либо причине покинувшим своё изначальное место, обосноваться где-либо ещё. Нормальные же эпителиальные клетки защищены от аноикиса несколькими механизмами, в частности, они неподвижны и имеют непрерывные контакты с ЕСМ. Более серьёзная защита от аноикиса необходима высоко подвижным и делящимся клеткам, например, мезенхимным клеткам; в самом деле, они, как правило, оказываются более устойчивыми к аноикису, чем эпителиальные клетки. Кроме того, мощную защиту от аноикиса имеют постоянно неприкреплённые клетки, например, зрелые гематопоэтические клетки и лейкоциты .
Вообще, клетки защищены от аноикиса прежде всего тогда, когда связаны с белками ЕСМ. Представление о роли ЕСМ как о мощном ингибиторе аноикиса широко распространено, и некоторые интегрины (α1β1, α2β1, α3β1, α5β1, α6β1, α6β4, αvβ3) оказывают значительный эффект на выживание как нормальных, так и претерпевших перерождение клеток. Ключевые белки, обеспечивающие интегрин-опосредованную передачу сигналов, приводящую к защите от аноикиса — FAK, ( англ. integrin-linked kinase, ILK ), тирозинкиназа Src , PI3K, ERK и адаптерный белок Shc . Когда интегрины связаны с правильными белками ЕСМ, FAK и ILK рекрутируют и активируют сигнальные пути PI3K/Akt, ERK и Jun-киназы ( ). PKB/Akt — необходимый элемент клеточных сигнальных путей выживания, поскольку получает соответствующие сигналы выживания от интегринов, факторов роста и межклеточных контактов. Активация PKB/Akt делает невозможными ряд этапов аноикиса, например, она вызывает инактивацию каспазы 9 и фосфорилирование проапоптотического белка Bad, активацию фактора NF-κB и ингибирование транскрипционных факторов . ILK получает интегрин-опосредованные сигналы выживания независимо от FAK, кроме того, адаптерный белок Shc тоже может независимо передавать на ERK сигналы адгезии. ERKs и PI3K могут отрицательно регулировать Bim через его фосфорилирование, что направляет его на деградацию. Это предотвращает подавление работы Bcl-2 посредством Bim и активацию Bax, что обеспечивает защиту от аноикиса .
В исследованиях 2008 и 2010 годов была выявлена связь между устойчивостью эпителиальных клеток к аноикису и аутофагии . Действительно, киназа облегчает выживание открепившихся от ЕСМ клеток, стимулируя аутофагию и образование АТР . Потеря связи с ЕСМ активирует канонический путь аутофагии, поддерживает постоянный уровень АТР в клетке и вызывает задержку аноикиса. Аутофагия позволяет выживать эпителиальным клеткам тогда, когда они временно утрачивают связь с ЕСМ и потом вновь прикрепляется к нему. Возможно, этот же механизм используют и опухолевые клетки для защиты от аноикиса .
Роль в патогенезе
Устойчивость к аноикису имеет огромное значение для развития рака . В отличие от нормальных эпителиальных клеток, раковые клетки не нуждаются в связи с ЕСМ для того, чтобы выживать и пролиферировать . Благодаря устойчивости к аноикису раковые клетки могут мигрировать по организму в отсутствие правильных контактов с ЕСМ и образовывать метастазы . В настоящее время разрабатываются противораковые препараты , увеличивающие чувствительность опухолевых клеток к аноикису .
Предложено несколько механизмов, обеспечивающих устойчивость к аноикису у раковых клеток :
- Изменение паттернов экспрессии интегринов . Многие раковые клетки настраивают экспрессию интегринов таким образом, чтобы выживать в различных микросредах.
- Раковые клетки создают свой собственный ЕСМ, отличный от нормального . Например, у мышей клетки карциномы лёгкого демонстрируют сверхэкспрессию , который постоянно стимулирует сигнальный путь α2-интегрин–FAK–PI3K и обеспечивает защиту от аноикиса.
- Использование активных форм кислорода (АФК) . Образование АФК защищает опухолевые клетки от аноикиса через окисление /активацию тирозинкиназы Src и запуск сигнальных путей выживания клетки.
- Использование эпителиально-мезенхимального перехода (ЭМП) . В частности, при эпителиально-мезенхимальном переходе , сопровождающемся развитием рака, происходит утрата экспрессии E-кадгерина — белка межклеточных контактов. Прекращение экспрессии этого белка предотвращает аноикис у опухолевых клеток и стимулирует ангиогенез .
- Использование мезенхимально-амебоидного перехода (МАП) . Сверхэкспрессия — важного индуктора МАП — наблюдается при некоторых видах рака и обеспечивает устойчивость к аноикису.
- Постоянная активация сигнальных путей клеточного выживания , например, сигнальных путей киназ семейства Src, а также путей PKB–Akt и ERK.
- Сверхэкспрессия TrkB . Сверхэкспрессия родственной тропомиозину киназы В ( англ. tropomyosin-related kinase B, TrkB ) наблюдается при некоторых видах рака и является сильным и специфичным ингибитором аноикиса.
- Гипоксия . Гипоксия может вызывать устойчивость к аноикису у опухолевых клеток посредством описанных выше механизмов.
- Вирус . В случае раковых заболеваний, вызванных вирусом , вирус может запускать экспрессию генов, обеспечивающих устойчивость клеток к аноикису. Например, при вирусном раке поджелудочной железы вирус индуцирует экспрессию белка , который активирует киназу Akt и подавляет аноикис .
Известны некоторые другие механизмы возникновения и обеспечения устойчивости к аноикису. Например, , ключевой белок кавеол , обеспечивает устойчивость к аноикису клеток гепатоцеллюлярной карциномы , активируя сигнальный путь IGF-1 . Важную роль в развитии устойчивости к аноикису в клетках рака яичника играет белок CD24 . Белок стимулирует устойчивость к аноикису в клетках рака желудка , регулируя сигнальный путь NF-κB . Аналогичное действие на клетки рака толстой кишки оказывает интерлейкин 8 .
Усиление аноикиса, не компенсируемое клеточными делениями или компенсируемое неправильно, возможно, лежит в основе многих сердечно-сосудистых дегенеративных патологий . Примерами может служить открепление кардиомиоцитов при сердечном приступе , разрушение бляшек при атеросклерозе , исчезновение гладких мышечных клеток при аневризмах и варикозном расширении вен , усиленная утрата сосудистых клеток при сердечно-сосудистых инфекциях .
Хронические заболевания сосудов являются главными причинами смерти при диабете . Эти заболевания связаны с увеличенным откреплением и смертью аноикисом эндотелиальных клеток, поэтому аноикис играет важную роль в диабете .
Аноикис может вызываться патогенами . Например, Pseudomonas aeruginosa вызывает атипичный аноикис в эпителиальных клетках хозяина .
В настоящее время трансплантация клеток является привлекательным способом для лечения некоторых заболеваний, например, нейродегенеративных нарушений , сердечного приступа и миопатий . Однако главная проблема, с которой сталкиваются разработчики таких методов лечения, — крайне низкая жизнеспособность пересаженных клеток. Пересаженные клетки, как правило, не могут создать правильные контакты с новым ЕСМ и умирают аноикисом. По этой причине разработка методов, которые усиливают приживаемость клеток при трансплантации, обеспечивая защищённость клеток от аноикиса при циркуляции по кровотоку до попадания в орган-мишень, является важной задачей клеточной терапии . Интересно отметить что приобретение устойчивости клетки к аноикису связано с морфологическими изменениями - клетка принимает округлую морфологию и образует небольшие полусферические выпячивания плазматической мембраны, так называемый . Изменение контура плазматической мембраны, задействует чувствительные к кривизне белки , что в итоге вызывает активацию путей выживания . Более того, фибробласты, созданные так чтобы они поддерживали блеббинг, приобретают такую же устойчивость к аноикису, что и раковые клетки, даже без онкогенных мутаций .
Примечания
- ↑ Taddei M. L. , Giannoni E. , Fiaschi T. , Chiarugi P. (англ.) // The Journal of pathology. — 2012. — Vol. 226, no. 2 . — P. 380—393. — doi : . — .
- Gilmore A. P. (англ.) // Cell death and differentiation. — 2005. — Vol. 12 Suppl 2. — P. 1473—1477. — doi : . — .
- Hong K. P. , Shin M. H. , Yoon S. , Ji G. Y. , Moon Y. R. , Lee O. J. , Choi S. Y. , Lee Y. M. , Koo J. H. , Lee H. C. , Lee G. K. , Kim S. R. , Lee K. H. , Han H. S. , Choe K. H. , Lee K. M. , Hong J. M. , Kim S. W. , Yi J. H. , Ji H. J. , Kim Y. B. , Song H. G. (англ.) // Biomaterials. — 2015. — Vol. 67. — P. 32—41. — doi : . — .
- Wu J. , Pan T. H. , Xu S. , Jia L. T. , Zhu L. L. , Mao J. S. , Zhu Y. L. , Cai J. T. (англ.) // Scientific reports. — 2015. — Vol. 5. — P. 12230. — doi : . — .
- Tang W. , Feng X. , Zhang S. , Ren Z. , Liu Y. , Yang B. , lv B , Cai Y. , Xia J. , Ge N. (англ.) // Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology. — 2015. — Vol. 36, no. 3 . — P. 1223—1236. — doi : . — .
- Li Y. H. , Sun X. , Wang H. B. (англ.) // Journal of Huazhong University of Science and Technology. Medical sciences = Hua zhong ke ji da xue xue bao. Yi xue Ying De wen ban = Huazhong keji daxue xuebao. Yixue Yingdewen ban. — 2015. — Vol. 35, no. 3 . — P. 390—396. — doi : . — .
- Huan Y. , Wu D. , Zhou D. , Sun B. , Li G. (англ.) // Oncology reports. — 2015. — Vol. 34, no. 2 . — P. 843—849. — doi : . — .
- Xiao Y. C. , Yang Z. B. , Cheng X. S. , Fang X. B. , Shen T. , Xia C. F. , Liu P. , Qian H. H. , Sun B. , Yin Z. F. , Li Y. F. (англ.) // Cancer letters. — 2015. — Vol. 361, no. 1 . — P. 22—32. — doi : . — .
- Wood S. , Goldufsky J. , Shafikhani S. H. (англ.) // PLoS pathogens. — 2015. — Vol. 11, no. 5 . — P. e1004934. — doi : . — .
- Neubauer, K., & Zieger, B. (2017). The mammalian septin interactome. Frontiers in cell and developmental biology, 5, 3. PMID PMC doi :
- ↑ Weems, A. D., Welf, E. S., Driscoll, M. K., Zhou, F., Mazloom-Farsibaf, H., Chang, B. J., ... & Danuser, G. (2023). . Nature; also bioRxiv, 2022 doi :
Литература
- Valentijn A. J. , Zouq N. , Gilmore A. P. (англ.) // Biochemical Society transactions. — 2004. — Vol. 32, no. Pt3 . — P. 421—425. — doi : . — .
- Wazir U. , Orakzai M. M. , Khanzada Z. S. , Jiang W. G. , Sharma A. K. , Kasem A. , Mokbel K. (англ.) // Cancer cell international. — 2015. — Vol. 15. — P. 39. — doi : . — .
- 2021-02-01
- 2