Interested Article - МикроРНК

- 2020-12-31
- 1

Ми́кроРНК ( англ. microRNA, miRNA ) — малые некодирующие молекулы РНК длиной 18—25 нуклеотидов (в среднем 22), обнаруженные у растений , животных и некоторых вирусов , принимающие участие в транскрипционной и посттранскрипционной регуляции экспрессии генов путём РНК-интерференции . Помимо внутриклеточной обнаружена внеклеточная (циркулирующая) микроРНК .
МикроРНК кодируются ядерной ДНК растений и животных и вирусной ДНК у некоторых ДНК-содержащих вирусов. МикроРНК участвуют в подавлении активности генов: они комплементарно спариваются с участками мРНК и ингибируют их трансляцию . Кроме того, комплексы микроРНК с мРНК часто быстро расщепляются клеткой . Это один из примеров направленной деградации, так как в основе формирования этих комплексов лежит комплементарность двух молекул РНК . Также имеются данные, указывающие на возможность взаимодействия микроРНК непосредственно с ДНК в процессе РНК-зависимого метилирования ДНК , которое является одним из ключевых механизмов репрессии генов , аллельного исключения и предотвращения активности транспозонов .
К 2014 году известно более 1800 микроРНК человека . Однако эта цифра может существенно возрасти с улучшением методов поиска. Разные клетки и ткани синтезируют разные наборы микроРНК, поэтому их исследование может привести к открытию новых молекул . По разным оценкам, мишенями микроРНК являются от 30 до 60 % генов человека, кодирующих белок .
МикроРНК высококонсервативны среди эукариот , и считается, что микроРНК представляют собой жизненно необходимый и эволюционно древний компонент системы регуляции экспрессии генов . Хотя основные компоненты жизненного цикла микроРНК одинаковы у растений и животных, набор микроРНК у представителей этих двух царств развился независимо, с различными моделями функционирования . Для растительных микроРНК характерно полное или почти полное комплементарное соответствие своим мРНК-мишеням, и они вызывают репрессию генов, запуская деградацию транскриптов-мишеней . Связывание микроРНК с транскриптами может осуществляться как в кодирующей, так и некодирующей области . МикроРНК животных, напротив, способны распознавать нужную мРНК по как минимум 6—8 нуклеотидам на её 5’-конце . Между микроРНК и её мРНК-мишенью может не быть взаимно однозначного соответствия: микроРНК может иметь несколько мРНК-мишеней, и мРНК может иметь несколько соответствующих ей микроРНК .
Первые микроРНК были описаны в начале 1990-х годов , однако как отдельный класс биологических регуляторных молекул с определёнными функциями, их стали рассматривать только в начале 2000-х. С этого момента были установлены многочисленные функции микроРНК в негативной регуляции (транскрипционная деградация или изоляция, подавление трансляции) и возможная вовлечённость в механизмы позитивной регуляции (активация транскрипции и трансляции). Так как микроРНК принимают участие в регуляции экспрессии генов, они оказываются вовлечёнными в большую часть биологических процессов . В различных клетках и тканях имеются различные наборы микроРНК .
Отклонения в экспрессии микроРНК были показаны при многих болезненных состояниях. Исследуются также возможности микроРНК-терапии .
Оценка общего числа уникальных мРНК, являющихся мишенями типичной микроРНК, варьирует в зависимости от использованного для оценки метода . По оценкам 2004 года, мишенями типичной микроРНК могут быть лишь 7 мРНК, более поздние оценки были выше . Установлено, что каждая микроРНК позвоночных в среднем имеет приблизительно 200 транскриптов-мишеней . Известно также, что одна микроРНК может подавлять образование сотен белков , однако такая репрессия носит относительно умеренный характер (понижение экспрессии менее чем в 2 раза).
История
МикроРНК были открыты в 1993 году Виктором Эмбросом , Розалинд Ли и Родой Фейнбраум при изучении гена lin-14 , задействованного в развитии у нематоды Caenorhabditis elegans . Они обнаружили, что количество белка LIN-14 регулировалось коротким РНК-продуктом гена lin-4 . Предшественник из 61 нуклеотида, транскрибируемый с гена lin-4 , созревал в 22-нуклеотидную молекулу РНК. Эта короткая молекула РНК содержала последовательности, частично комплементарные некоторым последовательностям 3'-нетранслируемой области (3'-UTR) мРНК, транскрибированной с lin-14 . Комплементарность оказалась необходимым и достаточным условием для подавления трансляции мРНК lin-14 в белок LIN-14. Таким образом, малая РНК lin-4 была первой обнаруженной микроРНК, хотя в то время считали, что наличие таких РНК является особенностью нематоды. Только в 2000 году была описана вторая микроРНК — let-7, подавлявшая экспрессию lin-41 , lin-14 , lin-28 , lin-42 и daf-12 во время переходных этапов в развитии Caenorhabditis elegans . Впоследствии была показана консервативность let-7 у многих видов , что свидетельствовало о более широком распространении этого феномена.
После открытия let-7 последовало бурное исследование нового класса некодирующих малых РНК — микроРНК. К настоящему моменту описаны тысячи микроРНК человека и других видов, разработаны различные методы их изучения, созданы онлайн-базы данных последовательностей микроРНК (например, ) .
Номенклатура
Согласно общепринятым правилам номенклатуры, названия присваиваются экспериментально выявленным и подтверждённым микроРНК до публикации сообщения об их открытии . Приставка «mir» отделяется дефисом, вслед за ней следует номер, говорящий о порядке именования. Например, mir-122 была открыта и названа раньше, чем mir-456. Приставка «mir-» используется для обозначения пре-микроРНК, «MIR-» гена, кодирующего микроРНК, а «miR-» — для обозначения зрелой формы. К названию микроРНК с последовательностями, отличающимися на один или два нуклеотида, приписывается дополнительная строчная буква. Так, miR-123a находится в близком родстве с miR-123b. Пре-микроРНК, дающие начало на 100 % идентичным микроРНК, но локализованные в разных местах генома, имеют в названии дополнительную цифру, отделенную дефисом. Например, пре-микроРНК hsa-mir-194-1 и hsa-mir-194-2 дают начало идентичным микроРНК (hsa-miR-194), однако они располагаются в разных участках генома. Вид, из которого была выделена микроРНК, обозначается в названии трёхбуквенной приставкой, например, hsa-miR-123 человека ( Homo sapiens ) и oar-miR-123 овцы ( Ovis aries ). Для вирусных микроРНК часто используют приставку «v-», а для микроРНК дрозофилы — «d». Когда две зрелые микроРНК образуются из двух различных концов исходной пре-микроРНК, к ним добавляется суффикс −3p или −5p. В прошлом также использовали обозначения «s» (смысловая) и «as» ( антисмысловая ). Когда известен относительный уровень экспрессии для двух микроРНК, имеющих общего предшественника, тогда микроРНК, которая экспрессируется на более низком уровне, чем микроРНК с противоположного конца шпильки, помечают звёздочкой. Так, miR-123 и miR-123* имеют общую исходную шпилечную пре-микроРНК, но в клетке обнаруживается больше miR-123, то есть её уровень экспрессии выше .
Образование

Большинство описанных генов микроРНК являются межгенными или ориентированными в антисмысловом направлении по отношению к соседним генам, в связи с чем предполагается, что они транскрибируются как независимые единицы . Однако в некоторых случаях микроРНК транскрибируется вместе с её геном-мишенью, что даёт возможность для их совместной регуляции . Около 40 % микроРНК кодируются генами, лежащими в интронах и небелоккодирующих генах, а в некоторых случаях даже в экзонах длинных небелоккодирующих генов . В этом случае как правило, но не всегда гены микроРНК располагаются в смысловой ориентации и потому регулируются вместе с генами-мишенями . Другие гены микроРНК имеют общий промотор , причём 42-48 % всех микроРНК образуются из поли цистронных единиц, содержащих множество отдельных петель, из которых в дальнейшем процессируется зрелая микроРНК . Впрочем, получившиеся микроРНК необязательно будут гомологичны по структуре и функциям.
В промоторах генов микроРНК было показано наличие мотивов , схожих с мотивами в промоторах других генов, считываемых РНК-полимеразой II , а именно белоккодирующих генов . ДНК-шаблон не является единственным фактором, определяющим первичную структуру получившейся микроРНК: для 6 % микроРНК показано редактирование РНК ( ), то есть сайт-специфическая модификация РНК, позволяющая получать различные РНК-продукты с одной и той же матрицы ДНК. Это позволяет увеличить разнообразие и возможности микроРНК, получаемых с одного гена.
Транскрипция
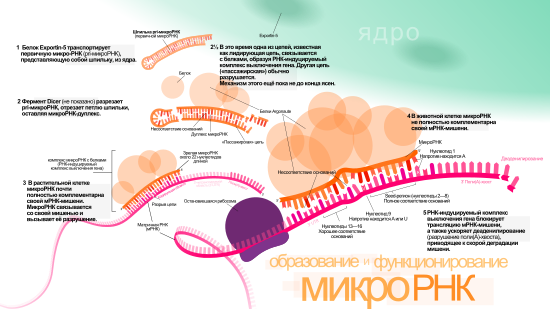
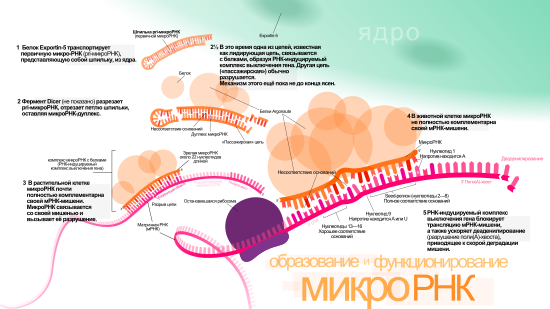
Гены микроРНК, как правило, транскрибируются РНК-полимеразой II . Полимераза часто связывается с промотором, располагающимся рядом с кодирующей последовательностью ДНК (фрагмент РНК, считываемый с этой последовательности, станет шпилькой в пре-микроРНК). Получающийся транскрипт кэпируется , полиаденилируется и сплайсируется . Транскрипция микроРНК животных начинается с образования фрагмента ~80 нуклеотидов длиной, входящего в одну из ветвей шпильки, которая, в свою очередь, входит в состав предшественника микроРНК длиной в несколько сотен нуклеотидов, называемого первичной микроРНК (pri-микроРНК) . Если первоначально образовавшаяся шпилька находится в 3’-UTR, то получающийся транскрипт может выступать и как пре-микроРНК, и как мРНК . Некоторые микроРНК транскрибируются РНК-полимеразой III . Особенно это касается тех микроРНК, гены которых находятся под Alu-повторами , генами тРНК и диспергированными повторами у млекопитающих ( англ. mammalian wide interspersed repeat (MWIR) ) .
Ядерный процессинг

Одна pri-микроРНК может содержать от одного до шести предшественников микроРНК (пре-микроРНК). Эти шпилечные структуры состоят из 70 нуклеотидов каждая. Двуцепочечная РНК в шпильках распознаётся ядерными белками: DiGeorge Syndrome Critical Region 8 у позвоночных (DGCR8, назван в связи с синдромом Ди Джорджи ) или у беспозвоночных . DGCR8 функционирует в комплексе с — белком, разрезающим РНК, образуя так называемый «микропроцессор» . В этом комплексе DGCR8 таким образом ориентирует каталитический домен РНКазы III , входящий в состав Drosha, что он «вырезает» шпильки из pri-микроРНК, разрезая РНК на расстоянии 11 нуклеотидов от основания шпильки. Получающийся продукт имеет 2 выступающих нуклеотида на 3’-конце, он имеет 3’- гидроксильную и 5’- фосфатную группы. Этот продукт часто называют пре-микроРНК (предшественник микроРНК).
Пре-микроРНК, сплайсирующиеся из интронов и не проходящие через «микропроцессор», называются . Раньше считалось, что миртроны имеются только у дрозофилы и Caenorhabditis elegans , однако в настоящее время они обнаружены и у млекопитающих .
Предположительно 16 % пре-микроРНК подвергаются ядерному редактированию РНК . В наиболее распространённом случае фермент , известный как , действующий на РНК (ADARs) катализирует гидролитическое дезаминирование аденозина (А) в инозин (I). Редактирование РНК может останавливать ядерный процессинг (так, например, происходит в случае pri-miR-142, которая после редактирования разрушается РНКазой Tudor-SN) и повлиять на последующие события, в том числе цитоплазматический процессинг микроРНК, а также изменить мРНК-мишень процессируемой микроРНК (например, в случае miR-376, функционирующей в центральной нервной системе ) .
Ядерный экспорт
Пре-микроРНК экспортируются из ядра при помощи нуклеоцитоплазматического переносчика — белка . Этот белок, входящий в семейство , распознаёт два «свешивающихся» нуклеотида на 3’-конце пре-микроРНК, которые появились, как писалось ранее, при разрезании pri-микроРНК. Транспорт в цитоплазму , опосредованный Exportin-5, происходит с затратой энергии ГТФ , при участии ГТФ-связывающего белка .
Цитоплазматический процессинг
В цитоплазме пре-микроРНК разрезается ферментом Dicer , содержащим каталитический центр РНКазы III . Эта эндорибонуклеаза взаимодействует с 3’-концом шпильки и вырезает петлю, соединяющую 3’- и 5’-концы шпильки. В результате образуется дуплекс (микроРНК:микроРНК*), состоящий из двух цепей микроРНК по 22 нуклеотида длиной каждая . На процессивность Dicer влияет длина шпильки и петли, а несовершенность связывания цепей в дуплексе микроРНК:микроРНК* способствует их разъединению . Хотя каждая из цепей дуплекса потенциально может выступать как функциональная микроРНК, лишь одна из них впоследствии войдёт в РНК-индуцируемый комплекс выключения гена ( англ. RNA-induced silencing complex (RISC) ), в котором осуществляется взаимодействие микроРНК и её мРНК-мишени.
Образование у растений
Биогенез микроРНК у растений отличается от такового у животных, в основном, в этапах ядерного процессинга и экспорта. Если у животных разрезание осуществляется двумя различными ферментами и в разных местах клетки — внутри ядра и вне его, то у растений оба разрезания осуществляет один и тот же фермент, гомологичный Dicer животных — Dicer-like1 (DL1). DL1 функционирует лишь внутри ядра растительной клетки , что говорит о том, что обе реакции происходят в ядре. У растений до того как дуплексы микроРНК:микроРНК* транспортируются из ядра, их «свешивающиеся» нуклеотиды на 3’-конце метилируются при помощи РНК- , называемой (HEN1). Дуплекс далее транспортируется из ядра в цитоплазму при помощи белка Hasty (HST), гомолога Exportin-5, где дуплекс распадается и зрелая микроРНК включается в состав RISC .
РНК-индуцируемый комплекс выключения гена

Зрелая микроРНК является частью активного РНК-индуцируемого комплекса выключения гена (RISC), куда также входят Dicer и многие другие белки . RISC также известен как микроРНК-рибонуклеопротеиновый комплекс (микроРНП, microRNP) , а RISC, содержащий микроРНК, иногда обозначают как miRISC.
Процессинг пре-микроРНК, осуществляемый Dicer, вероятно, связан с распадом дуплекса. В miRISC включается только одна цепь дуплекса, выбранная на основании её термодинамической нестабильности и более слабому, по сравнению с другой цепью, спариванию оснований . На выбор цепи также может повлиять наличие шпильки . Вошедшая в miRISC цепь называется «направляющей». Другая цепь, называемая «пассажирской», обладает меньшей энергией в стабильном состоянии (её обозначают *) и в норме деградирует. В некоторых случаях обе цепи дуплекса становятся функциональными микроРНК и действуют на различные виды мРНК . Вошедшая в состав RISC микроРНК играет роль матрицы, распознающей определённую последовательность на мРНК-мишени.
Центральную роль в функционировании RISC играют белки семейства Argonaute (Ago). Эти белки необходимы для микроРНК-индуцированного выключения мРНК и имеют два консервативных центра, связывающих микроРНК: домен PAZ, взаимодействующий с участком на 3’-конце микроРНК, и домен PIWI, структурно напоминающий рибонуклеазу Н и связывающий 5’-конец микроРНК. Вместе они связывают зрелую микроРНК и ориентируют её подходящим образом для взаимодействия с мРНК-мишенью. Некоторые белки семейства Argonaute, например, Ago2 человека, непосредственно разрезают транскрипт-мишень. Белки этого семейства также могут привлекать дополнительные белки для осуществления репрессии трансляции . Человеческий геном кодирует 8 белков семейства Argonaute, классифицируемые по последовательностям аминокислот на 2 группы: AGO (4 белка, экспрессируемые во всех клетках млекопитающих, у человека они называются E1F2C/hAgo) и PIWI (найдены в клетках зародышевого пути и кроветворных клетках) .
Дополнительными компонентами RISC являются следующие белки: TRBP (белок, связывающий трансактивирующую РНК TAR вируса ВИЧ ) , PACT (белковый активатор интерферона , индуцируемый протеинкиназой ), комплекс SMN, FMRP, Tudor-SN, предполагаемая ДНК- хеликаза MOV10, TNRC6B .
Выключение гена может осуществляться путём деградации мРНК или предотвращения её трансляции. Так, miR16 содержит последовательность, комплементарную AU-богатому элементу, имеющемуся в 3’-UTR многих нестабильных мРНК, например, TNF-α или GM-CSF. Если микроРНК полностью комплементарна мРНК-мишени, то Ago2 может разрезать мРНК и привести к её непосредственной деградации. Если же полной комплементарности нет, то выключение достигается через предотвращение трансляции .
Стабильность микроРНК
Регуляция стабильности микроРНК необходима для быстрых изменений в экспрессии генов, кодирующих микроРНК. В ходе созревания микроРНК в цитоплазме белки Argonaute стабилизируют направляющую цепь, а «пассажирская» цепь в большинстве случаев разрушается. При этом Argonaute дольше стабилизируют микроРНК, имеющие большее число мишеней, способствуя таким образом деградации микроРНК, не имеющих мишеней .
Разрушение микроРНК у Caenorhabditis elegans опосредовано 5’→3’- экзорибонуклеазой , также известной как Rat1p . У растений белки SDN ( англ. small RNA degrading nuclease — малые РНК-деградирующие нуклеазы) разрушают микроРНК в противоположном (3’→5’) направлении. Гены, гомологичные SDN генам растений, были выявлены и в геномах животных, но их функции ещё пока не были описаны .
Некоторые модификации микроРНК оказывают влияние на их стабильность. Как было показано у растения Arabidopsis thaliana , у растений зрелые микроРНК стабилизируются добавлением метильных групп к 3’-концу. Метильные группы, присоединённые к микроРНК 2’-O-связью, препятствуют присоединению остатков (U) уридилтрансферазой, а эта модификация связана с деградацией микроРНК. Однако уридинилирование может, напротив, защищать некоторые микроРНК; последствия таких модификаций к настоящему моменту не вполне ясны. Известно также уридинилирование микроРНК у животных. И растительные, и животные микроРНК могут быть изменены добавлением аденозиновых нуклеотидных звеньев (А) к 3’-концу микроРНК. Дополнительный аденозинфосфат, присоединяемый к концу miR-122 млекопитающих (микроРНК, многочисленная в печени , играет важную роль при развитии гепатита C ), стабилизирует молекулу; кроме того, известно, что растительные микроРНК с дополнительным аденозиновым нуклеотидом на конце менее подвержены разрушению .
Функции
Как говорилось выше, микроРНК играют важную роль в регуляции экспрессии генов. МикроРНК комплементарны определённому фрагменту одной или нескольких мРНК, при этом микроРНК животных обычно комплементарны 3’-UTR, в то время как микроРНК растений, как правило, комплементарны кодирующей части мРНК . Полное или почти полное спаривание оснований между микроРНК и мРНК-мишенью запускает разрушение мишени . Так происходит у растений ; у животных микроРНК комплементарно взаимодействует не со всей мРНК, как у растений, а лишь с её частью, вместо этого точное соответствие необходимо лишь на небольшом участке со 2-го по 7-й нуклеотид (так называемый «seed region» микроРНК ) . МикроРНК животных, помимо активации разрезания транскрипта-мишени, во многих случаях блокируют трансляцию (такое явление известно и у растений, но у них оно значительно меньше распространено ). МикроРНК, частично комплементарные своим мишеням, могут также активизировать деаденилирование мРНК, что сокращает время жизни мишени . В настоящее время установлено, что микроРНК вызывает деградацию мРНК-мишени, но механизм трансляционной репрессии (осуществляется ли она только через разрушение мРНК, только через подавление трансляции специальными факторами или комбинацией обоих механизмов) активно обсуждается. Недавние исследования miR-430 у данио-рерио , а также bantam-miRNA и у культуры клеток дрозофилы показали, что трансляционная репрессия обусловлена разрушением комплекса инициации трансляции и не связана с деаденилированием .

Показано 7 из 9 известных механизмов репрессии трансляции: M1) в ходе инициации предотвращение сборки инициаторного белкового комплекса или связывания с мРНК 40S рибосомной субъединицы; M2) в сборке рибосомы; M3) в ходе элонгации; M7, M8) деградация мРНК. Существуют и другие механизмы действия микроРНК на трансляцию белка (транскрипционные, транспорт к , диссоциация рибосомы, котрансляционная деградация белка и другие), здесь не показанные . Здесь рибосомные субъединицы 40S и 60S окрашены в более светлый и более тёмный цвета соответственно, 80S — собранная рибосома, связанная с мРНК, — фактор инициации трансляции, PABC1 — поли(А)-связывающий белок, кэп — особая структура на 5'-конце мРНК. Инициация трансляции мРНК может осуществляться без кэпа, путём присоединения 40S-субъединицы к сайту IRES ( англ. Internal Ribosome Entry Site ), находящегося в 5'-нетранслируемой области (5'-UTR). Собственно выключение мРНК осуществляет РНК-индуцируемый комплекс выключения гена (RISC), главной каталитической субъединицей которого является один из белков группы Argonaute (AGO), а микроРНК служит матрицей для распознавания специфических последовательностей на мРНК
Иногда микроРНК вызывают также модификацию гистонов и метилирование ДНК в области промоторов , что влияет на экспрессию генов -мишеней .
С помощью обобщённой математической модели описано и охарактеризовано 9 механизмов действия микроРНК :
- ингибирование присоединения 40S-субъединицы рибосомы в области кэп;
- подавление присоединения рибосомной 60S-субъединицы;
- подавление элонгации;
- диссоциация рибосомного комплекса (преждевременная терминация);
- деградация котрансляционных вспомогательных белков;
- отделение ;
- распад мРНК (дестабилизация);
- разрезание мРНК;
- подавление транскрипции через микроРНК-опосредованную реорганизацию.
Эти механизмы зачастую бывает невозможно разделить, используя экспериментальные данные о константах скоростей реакций, хотя они различаются в термодинамическом отношении .
В отличие от микроРНК растений, микроРНК животных действуют на различные наборы генов . Однако гены, вовлечённые в процессы, общие для всех клеток, относительно редко бывают мишенями микроРНК и, судя по всему, находятся под влиянием отбора, препятствующего их взаимодействию с микроРНК .
Известно, что двуцепочечные молекулы РНК (дцРНК) могут активировать гены. Мишенями дцРНК являются промоторы генов, которые потенциально могут увеличить транскрипцию связанных генов. Это явление было продемонстрировано на клетках человека с использованием искусственных дцРНК, называемых (small activating RNA, saRNA) , а также в случае эндогенных микроРНК .
Взаимодействия между микроРНК и комплементарными последовательностями в генах и даже псевдогенах , имеющих гомологичные последовательности, считаются обратным каналом связи, регулирующими экспрессию генов, между генами- паралогами . Эти микроРНК, названные , связываются со специфическими регуляторными элементами генов и псевдогенов, что может служить ещё одним объяснением присутствия большого количества некодирующих последовательностей в геноме эукариот .
Эволюция
МикроРНК являются важными филогенетическими маркерами из-за их поразительно низкой скорости эволюции . Считается, что микроРНК как регуляторные элементы развились из интерферирующих РНК , ранее использовавшихся для защиты от экзогенного генетического материала , например, вирусов . Впрочем, некоторые микроРНК, например, человеческие микроРНК семейства hsa-mir-548, могли появиться из миниатюрных транспозонов . Их появление открыло возможности для развития морфологического разнообразия, поскольку регуляция экспрессии гена смогла стать более тонкой и направленной, что особенно важно в процессе индивидуального развития отдельных органов и, возможно, целых организмов . Действительно, быстрые темпы морфологических изменений, как правило, коррелируют с накоплением микроРНК .
Новые виды микроРНК появляются многими способами. Они могут возникать из случайно возникающих шпилек в некодирующей области ДНК (то есть интронах или межгенных элементах), а также путём дупликации или модификации существующих микроРНК . Они также могут появляться из инвертированных дупликаций белоккодирующих последовательностей, так как из них могут образовываться шпильки . Скорость эволюции (то есть замены нуклеотидов) в недавно появившихся микроРНК сопоставима с таковой в некодирующей ДНК, что подразумевает эволюцию посредством нейтрального дрейфа . Впрочем, в древних микроРНК скорость эволюции значительно ниже и может составлять менее одной замены на сто миллионов лет . Это подтверждает то, что, когда микроРНК приобретает определённую функцию, она подвергается чрезвычайно жёсткому отбору и в дальнейшем почти не меняется. Кроме того, различные регионы в пределах гена микроРНК находятся под влиянием различных эволюционных процессов, причём участки, необходимые для процессинга и функционирования, имеют значительно большую консервативность . Изредка микроРНК исчезают из генома животного , хотя недавно появившиеся микроРНК (и, следовательно, нередко нефункциональные) теряются часто . У Arabidopsis thaliana рассчитанная скорость утраты генов микроРНК составляет 1,2 — 3,3 гена на миллион лет . Это делает гены микроРНК удобными филогенетическими маркерами, и, возможно, в них кроется объяснение такой сложности филогенетических взаимоотношений членистоногих .
МикроРНК кодируются в геномах большинства эукариот , от бурых водорослей до животных. Впрочем, различия в функциях микроРНК и их процессинге указывают на то, что они появились независимо у животных и растений . Кроме многоклеточных растений и животных, микроРНК известны и у некоторых одноклеточных организмов, например, они найдены у водоросли Chlamydomonas reinhardtii . У грибов микроРНК пока выделены не были, однако различные особенности их развития указывают на то, что микроРНК, возможно, также кодируются и их геномами . По состоянию на март 2010, микроРНК были описаны у 5000 видов . Хотя у бактерий широко распространены короткие фрагменты РНК длиной от 50 до нескольких сотен нуклеотидов, настоящие микроРНК у бактерий отсутствуют .
МикроРНК вирусов
С 2004 года было выделено более 200 микроРНК из двуцепочечных ДНК-содержащих вирусов , в основном герпесвирусов и полиомавирусов . МикроРНК вирусов имеют длину 22±3 нуклеотида, связываются с мРНК в 3'-UTR , вызывая разрушение транскрипта или блокируют трансляцию, при этом связывание микроРНК с мишенью, как и у животных, лишь частичное. К настоящему моменту мишени были определены лишь для относительно небольшого числа вирусных микроРНК, причём они могут подавлять экспрессию как вирусного гена, так и гена клетки-хозяина. Например, SV40 и родственные полиомавирусы кодируют микроРНК, которые подавляют экспрессию большого вирусного Т- антигена , а у α-, β- и γ-герпесвирусов была показана роль микроРНК при переходе из латентной в литическую стадию. У вируса герпеса человека 6 типа экспрессия транскрипционных факторов предположительно находится под контролем вирусных микроРНК. Хотя роль вирусных микроРНК в жизни клетки-хозяина ещё только начинает изучаться, многочисленные экспериментальные данные уверенно подтверждают участие вирусных микроРНК в таких фундаментальных биологических процессах, как иммунные реакции распознавания, выживание клетки, регенерация тканей, пролиферация и дифференцировка клеток .
Методы исследования
В то время как исследователи интенсивно изучали роль микроРНК в физиологических и патологических процессах, было разработано несколько техник для выделения микроРНК. Впрочем, стабильность выделенных микроРНК часто вызывала сомнения . МикроРНК разрушаются гораздо легче, чем мРНК, отчасти из-за их длины, но также из-за постоянного наличия РНКаз. В связи с этим образцы необходимо охлаждать во льду и использовать только оборудование, лишённое РНКаз, для работы с микроРНК .
Экспрессия микроРНК может быть количественно определена в двухшаговой полимеразной цепной реакции (ПЦР): первым этапом является ПЦР с обратной транскрипцией , а далее используется ПЦР в реальном времени . Существуют вариации этого метода для определения абсолютного или относительного количества микроРНК . МикроРНК также можно гибридизовать с микрочипами с пробами сотен или тысяч мишеней микроРНК и таким образом определить относительное содержание микроРНК в различных образцах . Новые микроРНК можно открыть и описать их последовательность с помощью методов высокопроизводительного секвенирования ( ) . Активность микроРНК можно экспериментально подавить с помощью олигонуклеотидов ( англ. Locked nucleic acid, LNA ), морфолино , а также олигорибонуклеотида с 2’-O-метильной группой . Кроме того, микроРНК можно выключить с помощью комплементарного олигонуклеотида — . Созревание микроРНК может быть остановлено в нескольких точках при помощи пространственно-блокирующих олигонуклеотидов . С помощью них можно также блокировать сайт мРНК для связывания с микроРНК . Для определения микроРНК in situ можно использовать пробы LNA или морфолино . Поскольку LNA имеет закрытую конформацию, она обладает усиленной способностью к гибридизации, чувствительностью и специфичностью, что делает её идеальной пробой для обнаружения микроРНК .
Высокопроизводительное определение количества микроРНК зачастую очень сложно и, кроме того, нередко приводит к ошибкам, что объясняется большими отклонениями (по сравнению с мРНК) вкупе с методологическими проблемами. В связи с этим важность приобретают исследования уровня экспрессии микроРНК, а также изучение эффектов микроРНК на данном уровне экспрессии . Для сопоставления данных по мРНК и микроРНК используются специальные базы данных , которые предсказывают мРНК-мишень для данной микроРНК, основываясь на данных по её последовательности . Разработан также ряд методов для определения мишени для данной микроРНК . Хотя эта технология применяется после того, как интересующая микроРНК была выделена (в частности, из-за высокого уровня экспрессии), был предложен ряд идей для анализирующих инструментов, способных объединять данные по мРНК и микроРНК .
Клиническое значение
Поскольку микроРНК участвуют в нормальном функционировании эукариотической клетки, нарушения в их работе могут приводить к болезненным состояниям . В публично доступной базе данных собрана информация о связи между нарушениями в работе микроРНК и различными заболеваниями .
Наследственные заболевания
Мутация в seed-регионе (то есть связывающемся с мРНК) miR-96 вызывает наследственную прогрессирующую потерю слуха . Мутация, затрагивающая seed-регион miR-184, приводит к развитию наследственного кератоконуса , которому предшествует полярная катаракта . Делеция miR-17 вызывает дефекты роста и развития скелета .
Рак

Первым заболеванием человека, для которого была установлена связь с нарушениями функционирования микроРНК, стал хронический лимфолейкоз . Впоследствии для многих микроРНК была установлена связь с некоторыми типами рака (иногда такие микроРНК называют ). Одной из первых микроРНК, определённых как онкомир, стала miRNA21, вызывающие несколько типов рака, например, глиобластому и астроцитому .
Изучение мышей, вырабатывающих избыток с-Myc — белка, мутантные формы которого задействованы в развитии нескольких видов рака — показали, что микроРНК действительно оказывают влияние на развитие рака. У мутантных мышей, вырабатывающих избыток микроРНК, найденных в клетках лимфомы , болезнь развивалась через 50 дней, а смерть наступала ещё через 2 недели. Для сравнения, мыши без избытка микроРНК жили более 100 дней . Показано, что лейкемия может быть вызвана внедрением вирусного генома перед генами микроРНК, поскольку это увеличивает экспрессию генов соответствующих микроРНК .
В другом исследовании было установлено, что два типа микроРНК подавляют белок E2F1, регулирующий пролиферацию клеток. МикроРНК может связаться с мРНК до того, как она будет транслирована в белки, включающие или выключающие определённые гены .
Путём измерения активности 217 генов, кодирующих микроРНК, были установлены определённые специфические комбинации генной активности, характерные для той или иной формы рака. На основании микроРНК можно классифицировать виды рака. Благодаря этому врачи смогут определять, из какой ткани развилась опухоль, и подобрать подходящий курс лечения на основании информации о типе ткани . Установлено, что микроРНК определяют, будет ли хронический лимфолейкоз развиваться медленно или же приобретёт агрессивную форму .
На основании опытов с трансгенными мышами с избыточной или недостаточной экспрессией специфических микроРНК удалось понять роль малых РНК в развитии различных злокачественных образований . Большая работа была проделана по установлению роли микроРНК в , особенно устойчивых к химиотерапии и способных к рецидиву .
В настоящее время разработан и проходит клинические испытания тест на определение на ранних стадиях, основанный на микроРНК. В ходе недавних исследований было установлено, что образцы плазмы крови пациентов с ранней, операбельной стадией рака толстой и прямой кишки (II стадия) отличаются от таковых у здоровых людей различного пола и возраста. Достаточную специфичность и селективность можно получить с малыми (менее 1 мл) объёмами крови. Этот тест сможет стать эффективным и удобным методом для выявления пациентов из группы риска, которым необходимо пройти колоноскопию .
Другое применение микроРНК в диагностике и лечении раковых заболеваний может заключаться в их использовании для составления прогноза. Так, при форме рака лёгких низкая концентрация miR-324a может служить индикатором плохой выживаемости , а высокая концентрация miR-185 или низкая — miR-133b свидетельствуют о наличии метастазов и, следовательно, плохой выживаемости при раке толстой и прямой кишки .
Для оптимального лечения рака необходимо точное разделение пациентов по степени риска. Пациенты с быстрым ответом на первоначальное лечение выздоравливают при неполном варианте лечения, поэтому необходимо правильно оценивать степень заболевания. Внеклеточные микроРНК сохраняют большую стабильность в плазме крови и при раке экспрессируются в избыточном количестве, и их количество можно измерить в лаборатории. При классической лимфоме Ходжкина содержащиеся в плазме крови miR-21, miR-494 и miR-1973 служат надёжными маркерами, свидетельствующими о наличии болезни . Циркулирующие микроРНК имеют важное значение при вынесении диагноза наряду с позитронно-эмиссионной томографией и компьютеризованной томографией. Дополнительным достоинством метода является возможность постоянно оценивать степень развития болезни и на ранних этапах отслеживать появление рецидива.
Недавние исследования показали, что miR-205 подавляют развитие метастазов при раке молочной железы . 5 членов семейства microRNA-200 (miR-200a, miR-200b, miR-200c, miR-141 и miR-429) отрицательно регулируются при развитии злокачественных новообразований в молочной железе .
Болезни сердца
Глобальная роль микроРНК в сердце была установлена путём условного ингибирования микроРНК в сердце крысы. Оказалось, что микроРНК необходимо для развития сердца . Показано, что уровни экспрессии определённых микроРНК меняются при различных заболеваниях сердца, свидетельствуя тем самым об их вовлечённости в развитие кардиомиопатий . Кроме того, исследования микроРНК на животных моделях показали различную роль микроРНК в развитии сердца и при патологических состояниях. МикроРНК служат важнейшими факторами , гипертрофированного роста и сердечной проводимости .
МикроРНК-712
МикроРНК-712 крысы является потенциальным биомаркером атеросклероза . Атеросклероз — сердечно-сосудистое заболевание, сопровождающееся обрастанием внутренних стенок сосудов липидным слоем, из-за чего просвет сосуда меняет форму, и воспалительным процессом . Наблюдающийся при этом из-за изменения формы просвета сосуда неламинарный ( турбулентный ) ток жидкости (d-ток) распознаётся механорецепторами клеток эндотелия . d-ток запускает также экспрессию ряда про-атерогенных генов, в том числе металлопротеиназ матрикса (MMP) , что служит про-воспалительным и про-ангиогенным сигналом. Эти факты были установлены при искусственном пережатии сонных артерий мыши, чтобы тем самым воспроизвести эффекты d-тока. В течение 24 часов пре-микроРНК-712 переходит в зрелую форму в ответ на d-ток. Эти данные подтверждаются также тем, что экспрессия miR-712 положительно регулируется в эндотелиальных клетках, выстилающих дугу аорты в области наибольшего изгиба, то есть там, где в норме наблюдается d-ток .
Предшественник микроРНК-712 в норме транскрибируется с внутреннего спейсера 2 ( англ. internal space region 2, ITS2 ) гена рРНК RN45s крысы. В ходе процессинга RN45s участок ITS2 обычно деградирует при участии экзонуклеазы . В условиях d-тока количество XRN1 сокращается, и происходит дополнительное накопление miR-712, помимо описанного выше механизма .
Мишенью miR-712 является тканевый 3 ( англ. tissue inhibitor of metalloproteinases 3, TIMP3 ) . Белки группы TIMP в норме регулируют активность металлопротеиназ матрикса (MMP), разрушающих внеклеточный матрикс ( англ. extracellular matrix, ECM ). Артериальный ECM состоит в основном из коллагеновых и эластиновых волокон, обеспечивающих структурную поддержку и упругость стенок артерий . Эти волокна также играют важнейшую роль в регуляции воспалительных процессов в стенках сосудов и их проницаемости — факторов, важных для развития атеросклероза . TIMP3 , экспрессируемый клетками эндотелия, является единственным представителем группы, способным связываться с ECM . В присутствии d-тока снижение экспрессии TIMP3 приводит к разрушению ECM. Так, подавление пре-miR-712 увеличивает экспрессию TIMP3 в клетках, даже при условии наличия d-тока .
TIMP3 также уменьшает экспрессию TNFα (про-воспалительный регулятор) при d-токе. Содержание TNFα при d-токе было измерено по активности в крови фермента , конвертирующего TNFα — TACE ( англ. TNFα converting enzyme ). Концентрация TNFα уменьшалась, если miR-712 подавлялась или TIMP3 экспрессировался в избытке. Этим подтверждается, что miR-712 и TIMP3 регулируют активность TACE в условиях d-тока .
Анти-miR-712 эффективно подавляет d-ток, индуцированный miR-712, и увеличивает экспрессию TIMP3 . Анти-miR-712 также подавляет гиперпроницаемость сосудов, тем самым уменьшая их повреждения при атеросклерозе и проникновение иммунных клеток наружу сосуда, а значит, уменьшая воспалительный процесс .
Человеческий гомолог miR-712 был найден в гене, гомологичном RN45s , обеспечивающем образование микроРНК, сходной с таковой у крысы. Эта микроРНК (miR-205) человека имеет последовательность, сходную с последовательностью miR-172 крысы; более того, эта последовательность консервативна у большинства позвоночных . У miR-205 и miR-712 также совпадает более 50 % сигнальных мишеней, в том числе TIMP3 .
Выяснилось, что d-ток уменьшает экспрессию гена XRN1 у человека, подобно тому, как это происходит у мыши, что указывает на схожую роль XRN1 у человека . Пока человеческий гомолог ещё не полностью изучен, открытие и функции miR-712 может дать основу для дальнейших исследований по её использованию в качестве биомаркера для модели атеросклероза на крысах.
Нервная система
МикроРНК играют регуляторную роль и в нервной системе . Нейронные микроРНК вовлечены в различные этапы формирования нейронных связей, включая дендритогенез (miR-132, miR-134 и miR-124), образование синапса и его созревание (в эти процессы, судя по всему, вовлечены miR-134 и miR-138) . Показана роль микроРНК в формировании памяти . Некоторые исследования указывают на изменения в экспрессии микроРНК при шизофрении .
Другие заболевания
МикроРНК играют ключевую роль в дифференциации стволовых клеток в адипоциты (клетки жировой ткани ) . Изучение роли плюрипотентных стволовых клеток в адипогенезе проводилось на культуре бессмертных клеток-производных клеток костного мозга из линии hMSC-Tert20 . У бессмертных клеток, проходящих стадию дифференциации в адипоциты, была обнаружена сниженная экспрессия miR-155, miR-221 и miR-222, что свидетельствует о том, что эти микроРНК выступают как негативные регуляторы дифференциации. В то же время этих микроРНК значительно подавляла адипогенез и репрессировала включение основного регулятора и ССААТ/ энхансер -связывающего белка альфа ( ) . Это даёт возможности для лечения ожирения на генетическом уровне.
Другой группой микроРНК, регулирующих инсулинорезистентность и вовлечённых в развитие ожирения и диабета, является семейство let-7. Let-7 накапливается в тканях по мере старения. Когда let-7 эктопически экспрессировались для искусственного ускорения старения, мыши становились инсулинорезистентными и поедание высокопитательной пищи приводило к развитию ожирения и диабета . Если же let-7 подавлялись специфическим антагомиром, мыши, напротив, становились более инсулиночувствительными, и высокопитательная пища не вызывала у них ожирения и диабета. Подавление let-7 может не только предотвращать развитие диабета и ожирения, но и использоваться для лечения этих заболеваний . Поэтому подавление let-7 может стать новым средством лечения ожирения и диабета 2 типа.
МикроРНК miR-140 участвует в патогенезе остеоартрита , регулируя экспрессию гена ADAMTS5 . У мышей, не экспрессирующих miR-140, нарушена пролиферация хондроцитов , они имеют карликовый фенотип .
Примечания
- Chen K., Rajewsky N. (англ.) // Nature Reviews Genetics. — 2007. — Vol. 8 , no. 2 . — P. 93—103 . 27 марта 2014 года.
- Finch M. L., Marquardt J. U., Yeoh G. C., Callus B. A. Regulation of microRNAs and their role in liver development, regeneration and disease // Int J Biochem Cell Biol. — 2014. — doi : . — .
- Нуклеиновые кислоты: от А до Я / Б. Аппель [и др.]. — М. : Бином: Лаборатория знаний, 2013. — 413 с. — 700 экз. — ISBN 978-5-9963-0376-2 .
- . Дата обращения: 30 ноября 2016. 23 августа 2020 года.
- Bartel D. P. MicroRNAs: target recognition and regulatory functions (англ.) // Cell : journal. — Cell Press , 2009. — January ( vol. 136 , no. 2 ). — P. 215—233 . — doi : . — . — PMC .
- Kusenda B., Mraz M., Mayer J., Pospisilova S. MicroRNA biogenesis, functionality and cancer relevance (англ.) // Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub : journal. — 2006. — November ( vol. 150 , no. 2 ). — P. 205—215 . — doi : . — .
- Галицкий В. А. // Цитология : журнал. — 2008. — Т. 50 , № 4 . — С. 277—286 . 15 июня 2013 года.
- от 27 марта 2014 на Wayback Machine at
- Peterson S. M., Thompson J. A., Ufkin M. L., Sathyanarayana P., Liaw L., Congdon C. B. // Front Genet. — 2014. — Т. 5 . — С. 23 . — doi : . — . 16 декабря 2022 года.
- Friedländer MR., Lizano E., Houben A. J., Bezdan D., Báñez-Coronel M., Kudla G., Mateu-Huertas E., Kagerbauer B., González J., Chen K. C., Leproust E. M., Martí E., Estivill X. Evidence for the biogenesis of more than 1,000 novel human microRNAs // Genome Biol. — 2014. — Т. 15 , вып. 4 . — С. R57 . — .
- ↑ Lewis B. P., Burge C. B., Bartel D. P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets (англ.) // Cell : journal. — Cell Press , 2005. — Vol. 120 , no. 1 . — P. 15—20 . — doi : . — .
- Friedman R. C., Farh K. K., Burge C. B., Bartel D. P. Most mammalian mRNAs are conserved targets of microRNAs (англ.) // : journal. — 2009. — January ( vol. 19 , no. 1 ). — P. 92—105 . — doi : . — . — PMC .
- Tanzer A., Stadler P. F. Molecular evolution of a microRNA cluster (англ.) // : journal. — 2004. — May ( vol. 339 , no. 2 ). — P. 327—335 . — doi : . — .
- Molnár A., Schwach F., Studholme D. J., Thuenemann E. C., Baulcombe D. C. miRNAs control gene expression in the single-cell alga Chlamydomonas reinhardtii (англ.) // Nature : journal. — 2007. — June ( vol. 447 , no. 7148 ). — P. 1126—1129 . — doi : . — . — .
- Kren B. T., Wong P. Y., Sarver A., Zhang X., Zeng Y., Steer C. J. MicroRNAs identified in highly purified liver-derived mitochondria may play a role in apoptosis (англ.) // : journal. — 2009. — Vol. 6 , no. 1 . — P. 65—72 . — doi : . — .
- Lee C. T., Risom T., Strauss W. M. Evolutionary conservation of microRNA regulatory circuits: an examination of microRNA gene complexity and conserved microRNA-target interactions through metazoan phylogeny (англ.) // : journal. — 2007. — April ( vol. 26 , no. 4 ). — P. 209—218 . — doi : . — .
- Lim L. P., Lau N. C., Weinstein E. G., Abdelhakim A., Yekta S., Rhoades M. W., Burge C. B., Bartel D. P. The microRNAs of Caenorhabditis elegans (англ.) // Genes Dev. : journal. — 2003. — April ( vol. 17 , no. 8 ). — P. 991—1008 . — doi : . — . — PMC .
- Shabalina S. A., Koonin E. V. Origins and evolution of eukaryotic RNA interference (англ.) // Trends in Ecology and Evolution. : journal. — 2008. — October ( vol. 10 , no. 10 ). — P. 578—587 . — doi : . — . — PMC .
- Brodersen P., Sakvarelidze-Achard L., Bruun-Rasmussen M., Dunoyer P., Yamamoto Y. Y., Sieburth L., Voinnet O. Widespread translational inhibition by plant miRNAs and siRNAs (англ.) // Science : journal. — 2008. — May ( vol. 320 , no. 5880 ). — P. 1185—1190 . — doi : . — . — .
- ↑ He L., Hannon G. J. MicroRNAs: small RNAs with a big role in gene regulation (англ.) // Nature : journal. — 2004. — July ( vol. 5 , no. 7 ). — P. 522—531 . — doi : . — .
- ↑ Lewis B. P., Shih I. H., Jones-Rhoades M., Bartel D. P., Burge C. B. Prediction of Mammalian MicroRNA Targets (англ.) // Cell . — Cell Press , 2003. — Vol. 115 , no. 7 . — P. 787—798 . — doi : . — .
- Rajewsky, Nikolaus. microRNA target predictions in animals (англ.) // Nature Genetics : journal. — Vol. 38 , no. 6s . — P. S8—S13 . — doi : .
- Krek, Azra; Grün, Dominic; Poy, Matthew N; Wolf, Rachel; Rosenberg, Lauren; Epstein, Eric J; MacMenamin, Philip; da Piedade, Isabelle; Gunsalus, Kristin C; Stoffel, Markus; Rajewsky, Nikolaus. Combinatorial microRNA target predictions (англ.) // Nature Genetics : journal. — Vol. 37 , no. 5 . — P. 495—500 . — doi : . — .
- ↑ Lee R. C., Feinbaum R. L., Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14 (англ.) // Cell : journal. — Cell Press , 1993. — December ( vol. 75 , no. 5 ). — P. 843—854 . — doi : . — .
- ↑ Lim L. P., Lau N. C., Garrett-Engele P., Grimson A., Schelter J. M., Castle J., Bartel D. P., Linsley P. S., Johnson J. M. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs (англ.) // Nature : journal. — 2005. — February ( vol. 433 , no. 7027 ). — P. 769—773 . — doi : . — . — .
- Brennecke J., Hipfner D. R., Stark A., Russell R. B., Cohen S. M. bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila (англ.) // Cell : journal. — Cell Press , 2003. — April ( vol. 113 , no. 1 ). — P. 25—36 . — doi : . — .
- Cuellar T. L., McManus M. T. MicroRNAs and endocrine biology (англ.) // : journal. — 2005. — December ( vol. 187 , no. 3 ). — P. 327—332 . — doi : . — .
- Poy M. N., Eliasson L., Krutzfeldt J., Kuwajima S., Ma X., Macdonald P. E., Pfeffer S., Tuschl T., Rajewsky N., Rorsman P., Stoffel M. A pancreatic islet-specific microRNA regulates insulin secretion (англ.) // Nature : journal. — 2004. — November ( vol. 432 , no. 7014 ). — P. 226—230 . — doi : . — . — .
- Chen C. Z., Li L., Lodish H. F., Bartel D. P. MicroRNAs modulate hematopoietic lineage differentiation (англ.) // Science : journal. — 2004. — January ( vol. 303 , no. 5654 ). — P. 83—6 . — doi : . — . — .
- Wilfred B. R., Wang W. X., Nelson P. T. Energizing miRNA research: a review of the role of miRNAs in lipid metabolism, with a prediction that miR-103/107 regulates human metabolic pathways (англ.) // : journal. — 2007. — July ( vol. 91 , no. 3 ). — P. 209—217 . — doi : . — . — PMC .
- Harfe B. D., McManus M. T., Mansfield J. H., Hornstein E., Tabin C. J. The RNaseIII enzyme Dicer is required for morphogenesis but not patterning of the vertebrate limb (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — August ( vol. 102 , no. 31 ). — P. 10898—10903 . — doi : . — . — . — PMC .
- Lagos-Quintana M., Rauhut R., Yalcin A., Meyer J., Lendeckel W., Tuschl T. Identification of tissue-specific microRNAs from mouse (англ.) // Curr. Biol. : journal. — 2002. — April ( vol. 12 , no. 9 ). — P. 735—739 . — doi : . — .
- Trang P., Weidhaas J. B., Slack F. J. MicroRNAs as potential cancer therapeutics (англ.) // . — 2008. — December ( vol. 27 Suppl 2 ). — P. S52—7 . — doi : . — .
- Li C., Feng Y., Coukos G., Zhang L. Therapeutic microRNA strategies in human cancer (англ.) // : journal. — 2009. — December ( vol. 11 , no. 4 ). — P. 747—757 . — doi : . — . — PMC .
- Fasanaro P., Greco S., Ivan M., Capogrossi M. C., Martelli F. microRNA: emerging therapeutic targets in acute ischemic diseases (англ.) // Pharmacol. Ther. : journal. — 2010. — January ( vol. 125 , no. 1 ). — P. 92—104 . — doi : . — .
- Hydbring, Per; Badalian-Very, Gayane. Clinical applications of microRNAs (неопр.) // F1000Research. — 2013. — August ( т. 2 ). — doi : .
- Thomson D. W., Bracken C. P., Goodall G. J. Experimental strategies for microRNA target identification (англ.) // : journal. — 2011. — September ( vol. 39 , no. 16 ). — P. 6845—6853 . — doi : . — . — PMC .
- John B., Enright A. J., Aravin A., Tuschl T., Sander C., Marks D. S. Human MicroRNA targets (англ.) // PLoS Biol. : journal. — 2004. — November ( vol. 2 , no. 11 ). — P. e363 . — doi : . — . — PMC .
- Krek A., Grün D., Poy M. N., Wolf R., Rosenberg L., Epstein E. J., MacMenamin P., da Piedade I., Gunsalus K. C., Stoffel M., Rajewsky N. Combinatorial microRNA target predictions (англ.) // Nat. Genet. : journal. — 2005. — May ( vol. 37 , no. 5 ). — P. 495—500 . — doi : . — .
- Selbach M., Schwanhäusser B., Thierfelder N., Fang Z., Khanin R., Rajewsky N. Widespread changes in protein synthesis induced by microRNAs (англ.) // Nature : journal. — 2008. — September ( vol. 455 , no. 7209 ). — P. 58—63 . — doi : . — .
- Baek D., Villén J., Shin C., Camargo F. D., Gygi S. P., Bartel D. P. The impact of microRNAs on protein output (англ.) // Nature. — 2008. — September ( vol. 455 , no. 7209 ). — P. 64—71 . — doi : . — . — PMC .
- Reinhart B. J., Slack F. J., Basson M., Pasquinelli A. E., Bettinger J. C., Rougvie A. E., Horvitz H. R., Ruvkun G. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans (англ.) // Nature : journal. — 2000. — February ( vol. 403 , no. 6772 ). — P. 901—906 . — doi : . — . — .
- Pasquinelli A. E., Reinhart B. J., Slack F., Martindale M. Q., Kuroda M. I., Maller B., Hayward D. C., Ball E. E., Degnan B., Müller P., Spring J., Srinivasan A., Fishman M., Finnerty J., Corbo J., Levine M., Leahy P., Davidson E., Ruvkun G. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA (англ.) // Nature : journal. — 2000. — November ( vol. 408 , no. 6808 ). — P. 86—9 . — doi : . — .
- Almeida M. I., Reis R. M., Calin G. A. MicroRNA history: discovery, recent applications, and next frontiers // Mutat Res.. — 2011. — Т. 717 . — С. 1—8 . — doi : .
- Ambros V., Bartel B., Bartel D. P., Burge C. B., Carrington J. C., Chen X., Dreyfuss G., Eddy S. R., Griffiths-Jones S., Marshall M., Matzke M., Ruvkun G., Tuschl T. A uniform system for microRNA annotation (неопр.) // RNA. — 2003. — March ( т. 9 , № 3 ). — С. 277—279 . — doi : . — . — PMC .
- Griffiths-Jones S., Grocock R. J., van Dongen S., Bateman A., Enright A. J. miRBase: microRNA sequences, targets and gene nomenclature (англ.) // : journal. — 2006. — January ( vol. 34 , no. Database issue ). — P. D140—4 . — doi : . — . — PMC .
- Дата обращения: 7 мая 2014. 7 октября 2014 года.
- ↑ Lau N. C., Lim L. P., Weinstein E. G., Bartel D. P. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans (англ.) // Science : journal. — 2001. — October ( vol. 294 , no. 5543 ). — P. 858—862 . — doi : . — . — .
- ↑ Lee Y., Kim M., Han J., Yeom K. H., Lee S., Baek S. H., Kim V. N. MicroRNA genes are transcribed by RNA polymerase II (англ.) // : journal. — 2004. — October ( vol. 23 , no. 20 ). — P. 4051—4060 . — doi : . — . — PMC .
- Lagos-Quintana M., Rauhut R., Lendeckel W., Tuschl T. Identification of novel genes coding for small expressed RNAs (англ.) // Science : journal. — 2001. — October ( vol. 294 , no. 5543 ). — P. 853—858 . — doi : . — . — .
- Lee R. C., Ambros V. An extensive class of small RNAs in Caenorhabditis elegans (англ.) // Science : journal. — 2001. — October ( vol. 294 , no. 5543 ). — P. 862—864 . — doi : . — . — .
- Mraz M., Dolezalova D., Plevova K., Stano Kozubik K., Mayerova V., Cerna K., Musilova K., Tichy B., Pavlova S., Borsky M., Verner J., Doubek M., Brychtova Y., Trbusek M., Hampl A., Mayer J., Pospisilova S. MicroRNA-650 expression is influenced by immunoglobulin gene rearrangement and affects the biology of chronic lymphocytic leukemia (англ.) // : journal. — , 2012. — March ( vol. 119 , no. 9 ). — P. 2110—2113 . — doi : . — .
- ↑ Rodriguez A., Griffiths-Jones S., Ashurst J. L., Bradley A. Identification of mammalian microRNA host genes and transcription units (англ.) // : journal. — 2004. — October ( vol. 14 , no. 10A ). — P. 1902—1910 . — doi : . — . — PMC .
- ↑ Cai X., Hagedorn C. H., Cullen B. R. Human microRNAs are processed from capped, polyadenylated transcripts that can also function as mRNAs (англ.) // RNA : journal. — 2004. — December ( vol. 10 , no. 12 ). — P. 1957—1966 . — doi : . — . — PMC .
- Weber M. J. New human and mouse microRNA genes found by homology search (англ.) // : journal. — 2005. — January ( vol. 272 , no. 1 ). — P. 59—73 . — doi : . — .
- Kim Y. K., Kim V. N. Processing of intronic microRNAs (англ.) // : journal. — 2007. — February ( vol. 26 , no. 3 ). — P. 775—783 . — doi : . — . — PMC .
- Baskerville S., Bartel D. P. Microarray profiling of microRNAs reveals frequent coexpression with neighboring miRNAs and host genes (англ.) // RNA : journal. — 2005. — March ( vol. 11 , no. 3 ). — P. 241—247 . — doi : . — . — PMC .
- Altuvia Y., Landgraf P., Lithwick G., Elefant N., Pfeffer S., Aravin A., Brownstein M. J., Tuschl T., Margalit H. Clustering and conservation patterns of human microRNAs (англ.) // : journal. — 2005. — Vol. 33 , no. 8 . — P. 2697—2706 . — doi : . — . — PMC .
- ↑ Zhou X., Ruan J., Wang G., Zhang W. Characterization and identification of microRNA core promoters in four model species (англ.) // PLoS Comput. Biol. : journal. — 2007. — March ( vol. 3 , no. 3 ). — P. e37 . — doi : . — . — . — PMC .
- Faller M., Guo F. MicroRNA biogenesis: there's more than one way to skin a cat (англ.) // : journal. — 2008. — November ( vol. 1779 , no. 11 ). — P. 663—667 . — doi : . — . — PMC .
- Gregory R. I., Chendrimada T. P., Shiekhattar R. MicroRNA biogenesis: isolation and characterization of the microprocessor complex (англ.) // : journal. — 2006. — Vol. 342 . — P. 33—47 . — ISBN 1-59745-123-1 . — doi : . — .
- Berezikov E., Chung W. J., Willis J., Cuppen E., Lai E. C. Mammalian mirtron genes (англ.) // : journal. — 2007. — October ( vol. 28 , no. 2 ). — P. 328—336 . — doi : . — . — PMC .
- ↑ Kawahara Y., Megraw M., Kreider E., Iizasa H., Valente L., Hatzigeorgiou A. G., Nishikura K. Frequency and fate of microRNA editing in human brain (англ.) // : journal. — 2008. — September ( vol. 36 , no. 16 ). — P. 5270—5280 . — doi : . — . — PMC .
- Winter J., Jung S., Keller S., Gregory R. I., Diederichs S. Many roads to maturity: microRNA biogenesis pathways and their regulation (англ.) // Nat. Cell Biol. : journal. — 2009. — March ( vol. 11 , no. 3 ). — P. 228—234 . — doi : . — .
- Ohman M. A-to-I editing challenger or ally to the microRNA process (англ.) // : journal. — 2007. — October ( vol. 89 , no. 10 ). — P. 1171—1176 . — doi : . — .
- ↑ Murchison E. P., Hannon G. J. miRNAs on the move: miRNA biogenesis and the RNAi machinery (англ.) // : journal. — Elsevier , 2004. — June ( vol. 16 , no. 3 ). — P. 223—229 . — doi : . — .
- ↑ Lund E., Dahlberg J. E. Substrate selectivity of exportin 5 and Dicer in the biogenesis of microRNAs (англ.) // Cold Spring Harb. Symp. Quant. Biol. : journal. — 2006. — Vol. 71 . — P. 59—66 . — doi : . — .
- Ji X. The mechanism of RNase III action: how dicer dices (неопр.) // Curr. Top. Microbiol. Immunol.. — 2008. — Т. Current Topics in Microbiology and Immunology . — С. 99—116 . — ISBN 978-3-540-75156-4 . — doi : . — .
- Lelandais-Brière C., Sorin C., Declerck M., Benslimane A., Crespi M., Hartmann C. Small RNA diversity in plants and its impact in development (англ.) // : journal. — 2010. — March ( vol. 11 , no. 1 ). — P. 14—23 . — doi : . — . — PMC .
- Rana T. M. Illuminating the silence: understanding the structure and function of small RNAs (англ.) // Nat. Rev. Mol. Cell Biol. : journal. — 2007. — January ( vol. 8 , no. 1 ). — P. 23—36 . — doi : . — .
- ↑ Schwarz D. S., Zamore P. D. Why do miRNAs live in the miRNP? (англ.) // Genes Dev. : journal. — 2002. — May ( vol. 16 , no. 9 ). — P. 1025—1031 . — doi : . — .
- Krol J., Sobczak K., Wilczynska U., Drath M., Jasinska A., Kaczynska D., Krzyzosiak W. J. Structural features of microRNA (miRNA) precursors and their relevance to miRNA biogenesis and small interfering RNA/short hairpin RNA design (англ.) // J Biol Chem : journal. — 2004. — Vol. 279 , no. 40 . — P. 42230—42239 . — doi : . — .
- Khvorova A., Reynolds A., Jayasena S. D. Functional siRNAs and miRNAs exhibit strand bias (англ.) // Cell . — Cell Press , 2003. — Vol. 115 , no. 2 . — P. 209—216 . — doi : . — .
- Schwarz D. S., Hutvágner G., Du T., Xu Z., Aronin N., Zamore P. D. Asymmetry in the assembly of the RNAi enzyme complex (англ.) // Cell : journal. — Cell Press , 2003. — Vol. 115 , no. 2 . — P. 199—208 . — doi : . — .
- Lin S. L., Chang D., Ying S. Y. Asymmetry of intronic pre-miRNA structures in functional RISC assembly (англ.) // : journal. — Elsevier , 2005. — Vol. 356 . — P. 32—8 . — doi : . — . — PMC .
- Okamura K., Chung W. J., Lai E. C. The long and short of inverted repeat genes in animals: microRNAs, mirtrons and hairpin RNAs (англ.) // : journal. — 2008. — Vol. 7 , no. 18 . — P. 2840—2845 . — doi : . — . — PMC .
- ↑ Pratt A. J., MacRae I. J. The RNA-induced silencing complex: a versatile gene-silencing machine (англ.) // J. Biol. Chem. : journal. — 2009. — July ( vol. 284 , no. 27 ). — P. 17897—17901 . — doi : . — . — PMC .
- MacRae I. J., Ma E., Zhou M., Robinson C. V., Doudna J. A. In vitro reconstitution of the human RISC-loading complex (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — January ( vol. 105 , no. 2 ). — P. 512—517 . — doi : . — . — . — PMC .
- Mourelatos Z., Dostie J., Paushkin S., Sharma A., Charroux B., Abel L., Rappsilber J., Mann M., Dreyfuss G. miRNPs: a novel class of ribonucleoproteins containing numerous microRNAs (англ.) // Genes Dev. : journal. — 2002. — March ( vol. 16 , no. 6 ). — P. 720—728 . — doi : . — . — PMC .
- Meister G., Landthaler M., Peters L., Chen P., Urlaub H., Lurhmann R., Tuschl T. Identification of Novel Argonaute-Associated Proteins (англ.) // Current Biology : journal. — Cell Press , 2005. — December ( vol. 15 , no. 23 ). — P. 2149—2155 . — doi : . — .
- ↑ Kai Z. S., Pasquinelli A. E. MicroRNA assassins: factors that regulate the disappearance of miRNAs (англ.) // Nat. Struct. Mol. Biol. : journal. — 2010. — January ( vol. 17 , no. 1 ). — P. 5—10 . — doi : . — .
- Chatterjee S., Großhans H. Active turnover modulates mature microRNA activity in Caenorhabditis elegans (англ.) // Nature : journal. — 2009. — September ( vol. 461 , no. 7263 ). — P. 546—459 . — doi : . — . — .
- Wang X. J., Reyes J. L., Chua N. H., Gaasterland T. (англ.) // : journal. — 2004. — Vol. 5 , no. 9 . — P. R65 . — doi : . — . — PMC . 6 сентября 2008 года.
- Kawasaki H., Taira K. MicroRNA-196 inhibits HOXB8 expression in myeloid differentiation of HL60 cells (англ.) // Nucleic Acids Symp Ser : journal. — 2004. — Vol. 48 , no. 48 . — P. 211—212 . — doi : . — .
- ↑ Moxon S., Jing R., Szittya G., Schwach F., Rusholme Pilcher R. L., Moulton V., Dalmay T. Deep sequencing of tomato short RNAs identifies microRNAs targeting genes involved in fruit ripening (англ.) // : journal. — 2008. — October ( vol. 18 , no. 10 ). — P. 1602—1609 . — doi : . — . — PMC .
- Mazière P., Enright A. J. Prediction of microRNA targets (англ.) // : journal. — 2007. — June ( vol. 12 , no. 11—12 ). — P. 452—458 . — doi : . — .
- Williams A. E. (англ.) // Cell. Mol. Life Sci. : journal. — 2008. — February ( vol. 65 , no. 4 ). — P. 545—562 . — doi : . — .
- Eulalio A., Huntzinger E., Nishihara T., Rehwinkel J., Fauser M., Izaurralde E. Deadenylation is a widespread effect of miRNA regulation (англ.) // RNA : journal. — 2009. — January ( vol. 15 , no. 1 ). — P. 21—32 . — doi : . — . — PMC .
- Bazzini A. A., Lee M. T., Giraldez A. J. Ribosome profiling shows that miR-430 reduces translation before causing mRNA decay in zebrafish (англ.) // Science : journal. — 2012. — April ( vol. 336 , no. 6078 ). — P. 233—237 . — doi : . — . — .
- Djuranovic S., Nahvi A., Green R. miRNA-mediated gene silencing by translational repression followed by mRNA deadenylation and decay (англ.) // Science : journal. — 2012. — April ( vol. 336 , no. 6078 ). — P. 237—240 . — doi : . — . — .
- ↑ Morozova N., Zinovyev A., Nonne N., Pritchard L. L., Gorban A. N., Harel-Bellan A. Kinetic signatures of microRNA modes of action (неопр.) // RNA. — 2012. — September ( т. 18 , № 9 ). — С. 1635—1655 . — doi : . — . — PMC .
- Tan Y., Zhang B., Wu T., Skogerbø G., Zhu X., Guo X., He S., Chen R. Transcriptional inhibiton of Hoxd4 expression by miRNA-10a in human breast cancer cells (англ.) // BMC Mol. Biol. : journal. — 2009. — Vol. 10 . — P. 12 . — doi : . — . — PMC .
- Hawkins P. G., Morris K. V. RNA and transcriptional modulation of gene expression (англ.) // : journal. — 2008. — March ( vol. 7 , no. 5 ). — P. 602—607 . — doi : . — . — PMC .
- Stark A., Brennecke J., Bushati N., Russell R. B., Cohen S. M. Animal MicroRNAs confer robustness to gene expression and have a significant impact on 3'UTR evolution (англ.) // Cell : journal. — Cell Press , 2005. — Vol. 123 , no. 6 . — P. 1133—1146 . — doi : . — .
- Li L. C. // RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity (англ.) . — , 2008. — ISBN 978-1-904455-25-7 ].
- Place R. F., Li L. C., Pookot D., Noonan E. J., Dahiya R. MicroRNA-373 induces expression of genes with complementary promoter sequences (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — Vol. 105 , no. 5 . — P. 1608—1613 . — doi : . — . — . — PMC .
- Salmena L., Poliseno L., Tay Y., Kats L., Pandolfi P. P. A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language? (англ.) // Cell : journal. — Cell Press , 2011. — August ( vol. 146 , no. 3 ). — P. 353—358 . — doi : . — . — PMC .
- ↑ Wheeler B. M., Heimberg A. M., Moy V. N., Sperling E. A., Holstein T. W., Heber S., Peterson K. J. The deep evolution of metazoan microRNAs (англ.) // : journal. — 2009. — Vol. 11 , no. 1 . — P. 50—68 . — doi : . — .
- Pashkovskiy, P. P.; Ryazansky, S. S. (англ.) // Biochemistry-Moscow : journal. — 2013. — Vol. 78 . — P. 627—637 . — doi : . — . 12 сентября 2017 года.
- Piriyapongsa J, Jordan IK. A family of human microRNA genes from miniature inverted-repeat transposable elements (англ.) // PLOS One . — Public Library of Science , 2007. — Vol. 2 , no. 2 .
- ↑ Heimberg A. M., Sempere L. F., Moy V. N., Donoghue P. C., Peterson K. J. MicroRNAs and the advent of vertebrate morphological complexity (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — February ( vol. 105 , no. 8 ). — P. 2946—2950 . — doi : . — . — . — PMC .
- ↑ Peterson K. J., Dietrich M. R., McPeek M. A. MicroRNAs and metazoan macroevolution: insights into canalization, complexity, and the Cambrian explosion (англ.) // : journal. — 2009. — July ( vol. 31 , no. 7 ). — P. 736—747 . — doi : . — .
- ↑ Nozawa M., Miura S., Nei M. Origins and evolution of microRNA genes in Drosophila species (англ.) // : journal. — 2010. — Vol. 2 . — P. 180—189 . — doi : . — . — PMC .
- Allen, E.; Z. X. Xie, A. M. Gustafson, G. H. Sung, J. W. Spatafora, and J. C. Carrington. (англ.) // Nature Genetics : journal. — 2004. — Vol. 36 , no. 12 . — P. 1282—1290 . — doi : . — . 4 декабря 2013 года.
- Warthmann, N.; S. Das, C. Lanz, and D. Weigel. (англ.) // : journal. — Oxford University Press , 2008. — Vol. 25 , no. 5 . — P. 892—902 . — doi : . — . 12 сентября 2017 года.
- Fahlgren, N.; S. Jogdeo, K. D. Kasschau, C. M. Sullivan, E. J. Chapman, S. Laubinger, L. M. Smith, M. Dasenko, S. A. Givan, D. Weigel, and J. C. Carrington. (англ.) // Plant Cell : journal. — 2010. — Vol. 22 , no. 4 . — P. 1074—1089 . — doi : . 27 февраля 2014 года.
- Caravas J., Friedrich M. Of mites and millipedes: recent progress in resolving the base of the arthropod tree (англ.) // : journal. — 2010. — June ( vol. 32 , no. 6 ). — P. 488—495 . — doi : . — .
- Cock J. M., Sterck L., Rouzé P., Scornet D., Allen A. E., Amoutzias G., Anthouard V., Artiguenave F., Aury J. M., Badger J. H., et al . The Ectocarpus genome and the independent evolution of multicellularity in brown algae (англ.) // Nature : journal. — 2010. — June ( vol. 465 , no. 7298 ). — P. 617—621 . — doi : . — . — .
- Cuperus, J. T.; N. Fahlgren, and J. C. Carrington. (англ.) // Plant Cell : journal. — 2011. — Vol. 23 , no. 2 . — P. 431—442 . — doi : . — . 20 мая 2016 года.
- Attila Molnar, Andrew Basset, Frank Schwach et al. // The Plant Journal. — 2009. — doi : . 9 июля 2009 года.
- Kanika Jain, B.B. Chattoo. . 26 апреля 2014 года.
- Dimond PF (2010-03-15). . Genetic Engineering & Biotechnology News . Vol. 30, no. 6. p. 1. из оригинала 10 июля 2010 . Дата обращения: 10 июля 2010 .
- Tjaden B., Goodwin S. S., Opdyke J. A., Guillier M., Fu D. X., Gottesman S., Storz G. Target prediction for small, noncoding RNAs in bacteria (англ.) // : journal. — 2006. — Vol. 34 , no. 9 . — P. 2791—2802 . — doi : . — . — PMC .
- Plaisance-Bonstaff K., Renne R. Viral miRNAs // Methods Mol Biol.. — 2011. — Т. 721 . — С. 43—66 . — doi : .
- Mraz M., Malinova K., Mayer J., Pospisilova S. MicroRNA isolation and stability in stored RNA samples (англ.) // : journal. — 2009. — December ( vol. 390 , no. 1 ). — P. 1—4 . — doi : . — .
- Liu C. G., Calin G. A., Volinia S., Croce C. M. MicroRNA expression profiling using microarrays (англ.) // : journal. — 2008. — Vol. 3 , no. 4 . — P. 563—578 . — doi : . — .
- Chen C., Ridzon D. A., Broomer A. J., Zhou Z., Lee D. H., Nguyen J. T., Barbisin M., Xu N. L., Mahuvakar V. R., Andersen M. R., Lao K. Q., Livak K. J., Guegler K. J. Real-time quantification of microRNAs by stem-loop RT-PCR (англ.) // : journal. — 2005. — Vol. 33 , no. 20 . — P. e179 . — doi : . — . — PMC .
- Shingara J., Keiger K., Shelton J., Laosinchai-Wolf W., Powers P., Conrad R., Brown D., Labourier E. An optimized isolation and labeling platform for accurate microRNA expression profiling (англ.) // RNA : journal. — 2005. — September ( vol. 11 , no. 9 ). — P. 1461—1470 . — doi : . — . — PMC .
- Buermans H. P., Ariyurek Y., van Ommen G., den Dunnen J. T., 't Hoen PA. New methods for next generation sequencing based microRNA expression profiling (англ.) // : journal. — 2010. — December ( vol. 11 ). — P. 716 . — doi : . — . — PMC .
- Kloosterman W. P., Wienholds E., Ketting R. F., Plasterk R. H. Substrate requirements for let-7 function in the developing zebrafish embryo (англ.) // : journal. — 2004. — Vol. 32 , no. 21 . — P. 6284—6291 . — doi : . — . — PMC .
- Flynt A. S., Li N., Thatcher E. J., Solnica-Krezel L., Patton J. G. Zebrafish miR-214 modulates Hedgehog signaling to specify muscle cell fate (англ.) // Nat. Genet. : journal. — 2007. — February ( vol. 39 , no. 2 ). — P. 259—263 . — doi : . — .
- Meister G., Landthaler M., Dorsett Y., Tuschl T. Sequence-specific inhibition of microRNA- and siRNA-induced RNA silencing (англ.) // RNA : journal. — 2004. — March ( vol. 10 , no. 3 ). — P. 544—550 . — doi : . — . — PMC .
- Kloosterman W. P., Lagendijk A. K., Ketting R. F., Moulton J. D., Plasterk R. H. Targeted inhibition of miRNA maturation with morpholinos reveals a role for miR-375 in pancreatic islet development (англ.) // PLoS Biol. : journal. — 2007. — August ( vol. 5 , no. 8 ). — P. e203 . — doi : . — . — PMC .
- Choi W. Y., Giraldez A. J., Schier A. F. Target protectors reveal dampening and balancing of Nodal agonist and antagonist by miR-430 (англ.) // Science : journal. — 2007. — October ( vol. 318 , no. 5848 ). — P. 271—274 . — doi : . — . — .
- You Y., Moreira B. G., Behlke M. A., Owczarzy R. Design of LNA probes that improve mismatch discrimination (англ.) // : journal. — 2006. — Vol. 34 , no. 8 . — P. e60 . — doi : . — . — PMC .
- Lagendijk A. K., Moulton J. D., Bakkers J. Revealing details: whole mount microRNA in situ hybridization protocol for zebrafish embryos and adult tissues (англ.) // Bio Open : journal. — 2012. — Vol. 1 , no. 6 . — P. 566 . — doi : .
- Kaur H., Arora A., Wengel J., Maiti S., Arora A., Wengel J., Maiti S. Thermodynamic, Counterion, and Hydration Effects for the Incorporation of Locked Nucleic Acid Nucleotides into DNA Duplexes (англ.) // Biochemistry : journal. — 2006. — Vol. 45 , no. 23 . — P. 7347—7355 . — doi : . — .
- Nielsen J. A., Lau P., Maric D., Barker J. L., Hudson L. D. Integrating microRNA and mRNA expression profiles of neuronal progenitors to identify regulatory networks underlying the onset of cortical neurogenesis (англ.) // BMC Neurosci : journal. — 2009. — Vol. 10 . — P. 98 . — doi : . — . — PMC .
- Gupta A., Nagilla P., Le H. S., Bunney C., Zych C., Thalamuthu A., Bar-Joseph Z., Mathavan S., Ayyavoo V. Comparative expression profile of miRNA and mRNA in primary peripheral blood mononuclear cells infected with human immunodeficiency virus (HIV-1) (англ.) // PLoS ONE : journal / Mammano, Fabrizio. — 2011. — Vol. 6 , no. 7 . — P. e22730 . — doi : . — . — PMC .
- Grimson A., Farh K. K., Johnston W. K., Garrett-Engele P., Lim L. P., Bartel D. P. MicroRNA targeting specificity in mammals: determinants beyond seed pairing (англ.) // : journal. — 2007. — July ( vol. 27 , no. 1 ). — P. 91—105 . — doi : . — .
- Griffiths-Jones S., Saini H. K., van Dongen S., Enright A. J. miRBase: tools for microRNA genomics (англ.) // : journal. — 2008. — January ( vol. 36 , no. Database issue ). — P. D154—8 . — doi : . — . — PMC .
- Zheng H., Fu R., Wang J. T., Liu Q., Chen H., Jiang S. W. Advances in the Techniques for the Prediction of microRNA Targets (англ.) // Int J Mol Sci. : journal. — 2013. — April ( vol. 14 , no. 4 ). — P. 8179—8187 . — doi : . — . — PMC .
- Nam S., Li M., Choi K., Balch C., Kim S., Nephew K. P. MicroRNA and mRNA integrated analysis (MMIA): a web tool for examining biological functions of microRNA expression (англ.) // : journal. — 2009. — July ( vol. 37 , no. Web Server issue ). — P. W356—62 . — doi : . — . — PMC .
- Artmann S., Jung K., Bleckmann A., Beissbarth T. Detection of simultaneous group effects in microRNA expression and related target gene sets (англ.) // PLoS ONE : journal / Provero, Paolo. — 2012. — Vol. 7 , no. 6 . — P. e38365 . — doi : . — . — . — PMC .
- ↑ Mraz M. , Pospisilova S. (англ.) // Expert review of hematology. — 2012. — Vol. 5, no. 6 . — P. 579—581. — doi : . — .
- Jiang Q., Wang Y., Hao Y., Juan L., Teng M., Zhang X., Li M., Wang G., Liu Y. miR2Disease: a manually curated database for microRNA deregulation in human disease (англ.) // : journal. — 2009. — January ( vol. (Database issue) , no. Database issue ). — P. D98—104 . — doi : . — . — PMC .
- Mencía A., Modamio-Høybjør S., Redshaw N., Morín M., Mayo-Merino F., Olavarrieta L., Aguirre L. A., del Castillo I., Steel K. P., Dalmay T., Moreno F., Moreno-Pelayo M. A. Mutations in the seed region of human miR-96 are responsible for nonsyndromic progressive hearing loss (англ.) // Nat. Genet. : journal. — 2009. — May ( vol. 41 , no. 5 ). — P. 609—613 . — doi : . — .
- Hughes A. E., Bradley D. T., Campbell M., Lechner J., Dash D. P., Simpson D. A., Willoughby C. E. (англ.) // : journal. — 2011. — Vol. 89 , no. 5 . — P. 628—633 . — doi : . — . — PMC . 8 ноября 2011 года.
- de Pontual L., Yao E., Callier P., Faivre L., Drouin V., Cariou S., Van Haeringen A., Geneviève D., Goldenberg A., Oufadem M., Manouvrier S., Munnich A., Vidigal J. A., Vekemans M., Lyonnet S., Henrion-Caude A., Ventura A., Amiel J. Germline deletion of the miR-17∼92 cluster causes skeletal and growth defects in humans (англ.) // Nat. Genet. : journal. — 2011. — October ( vol. 43 , no. 10 ). — P. 1026—1030 . — doi : . — . — PMC .
- ↑ He L., Thomson J. M., Hemann M. T., Hernando-Monge E., Mu D., Goodson S., Powers S., Cordon-Cardo C., Lowe S. W., Hannon G. J., Hammond S. M. A microRNA polycistron as a potential human oncogene (англ.) // Nature : journal. — 2005. — June ( vol. 435 , no. 7043 ). — P. 828—833 . — doi : . — . — .
- ↑ Mraz M., Pospisilova S., Malinova K., Slapak I., Mayer J. MicroRNAs in chronic lymphocytic leukemia pathogenesis and disease subtypes (англ.) // : journal. — 2009. — March ( vol. 50 , no. 3 ). — P. 506—509 . — doi : . — .
- Heidi G. Møller, Andreas P. Rasmussen, Hjalte H. Andersen, Kasper B. Johnsen, Michael Henriksen, Meg Duroux. // Mol Neurobiol. — 2013. — Т. 47 , № 1 . — С. 131—144 . — doi : . 18 февраля 2015 года.
- Cui J. W., Li Y. J., Sarkar A., Brown J., Tan Y. H., Premyslova M., Michaud C., Iscove N., Wang G. J., Ben-David Y. Retroviral insertional activation of the Fli-3 locus in erythroleukemias encoding a cluster of microRNAs that convert Epo-induced differentiation to proliferation (англ.) // : journal. — , 2007. — June ( vol. 110 , no. 7 ). — P. 2631—2640 . — doi : . — .
- O'Donnell K. A., Wentzel E. A., Zeller K. I., Dang C. V., . c-Myc-regulated microRNAs modulate E2F1 expression (англ.) // Nature. — 2005. — June ( vol. 435 , no. 7043 ). — P. 839—843 . — doi : . — . — .
- Lu J., Getz G., Miska E. A., Alvarez-Saavedra E., Lamb J., Peck D., Sweet-Cordero A., Ebert B. L., Mak R. H., Ferrando A. A., Downing J. R., Jacks T., Horvitz H. R., Golub T. R. MicroRNA expression profiles classify human cancers (англ.) // Nature : journal. — 2005. — June ( vol. 435 , no. 7043 ). — P. 834—838 . — doi : . — . — .
- Zanesi N., Pekarsky Y., Trapasso F., Calin G., Croce C. M. MicroRNAs in mouse models of lymphoid malignancies (неопр.) // J Nucleic Acids Investig. — 2010. — Т. 1 , № 1 . — С. 36—40 . — doi : . — . — PMC .
- Jun Qian, Vinayakumar Siragam, Jiang Lin, Jichun Ma, Zhaoqun Deng. (англ.) // Hypothesis : journal. — 2011. — Vol. 9 , no. 1 . — P. e10 . 6 октября 2015 года.
- (Press release). American Association for Cancer Research. 2010-09-29. Архивировано из 14 мая 2011 . Дата обращения: 29 ноября 2010 .
- Nielsen B. S., Jørgensen S., Fog J. U., Søkilde R., Christensen I. J., Hansen U., Brünner N., Baker A., Møller S., Nielsen H. J. High levels of microRNA-21 in the stroma of colorectal cancers predict short disease-free survival in stage II colon cancer patients (англ.) // Clin Exp Metastasis : journal. — 2010. — October ( vol. 28 , no. 1 ). — P. 27—38 . — doi : . — . — PMC .
- Võsa U., Vooder T., Kolde R., Fischer K., Välk K., Tõnisson N., Roosipuu R., Vilo J., Metspalu A., Annilo T. Identification of miR-374a as a prognostic marker for survival in patients with early-stage nonsmall cell lung cancer (англ.) // : journal. — 2011. — October ( vol. 50 , no. 10 ). — P. 812—822 . — doi : . — .
- Akçakaya P., Ekelund S., Kolosenko I., Caramuta S., Ozata D. M., Xie H., Lindforss U., Olivecrona H., Lui W. O. miR-185 and miR-133b deregulation is associated with overall survival and metastasis in colorectal cancer (англ.) // : journal. — 2011. — August ( vol. 39 , no. 2 ). — P. 311—318 . — doi : . — .
- Jones, K; Nourse J. P., Keane C., Bhatnagar A., Gandhi MK. Plasma MicroRNA Are Disease Response Biomarkers in Classical Hodgkin Lymphoma (англ.) // Clin Can Res : journal. — 2014. — January ( vol. 20 , no. 1 ). — P. 253—264 . — doi : . — .
- Wu H., Mo Y. Y. Targeting miR-205 in breast cancer (англ.) // : journal. — 2009. — December ( vol. 13 , no. 12 ). — P. 1439—1448 . — doi : . — .
- Gregory P. A., Bert A. G., Paterson E. L., Barry S. C., Tsykin A., Farshid G., Vadas M. A., Khew-Goodall Y., Goodall G. J. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1 (англ.) // Nat. Cell Biol. : journal. — 2008. — May ( vol. 10 , no. 5 ). — P. 593—601 . — doi : . — .
- Chen J. F., Murchison E. P., Tang R., Callis T. E., Tatsuguchi M., Deng Z., Rojas M., Hammond S. M., Schneider M. D., Selzman C. H., Meissner G., Patterson C., Hannon G. J., Wang D. Z. Targeted deletion of Dicer in the heart leads to dilated cardiomyopathy and heart failure (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — February ( vol. 105 , no. 6 ). — P. 2111—2116 . — doi : . — . — . — PMC .
- ↑ Zhao Y., Ransom J. F., Li A., Vedantham V., von Drehle M., Muth A. N., Tsuchihashi T., McManus M. T., Schwartz R. J., Srivastava D. Dysregulation of cardiogenesis, cardiac conduction, and cell cycle in mice lacking miRNA-1-2 (англ.) // Cell : journal. — Cell Press , 2007. — April ( vol. 129 , no. 2 ). — P. 303—317 . — doi : . — .
- Thum T., Galuppo P., Wolf C., Fiedler J., Kneitz S., van Laake L. W., Doevendans P. A., Mummery C. L., Borlak J., Haverich A., Gross C., Engelhardt S., Ertl G., Bauersachs J. MicroRNAs in the human heart: a clue to fetal gene reprogramming in heart failure (англ.) // : journal. — , 2007. — July ( vol. 116 , no. 3 ). — P. 258—267 . — doi : . — .
- van Rooij E., Sutherland L. B., Liu N., Williams A. H., McAnally J., Gerard R. D., Richardson J. A., Olson E. N. A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — November ( vol. 103 , no. 48 ). — P. 18255—18260 . — doi : . — . — . — PMC .
- Tatsuguchi M., Seok H. Y., Callis T. E., Thomson J. M., Chen J. F., Newman M., Rojas M., Hammond S. M., Wang D. Z. Expression of microRNAs is dynamically regulated during cardiomyocyte hypertrophy (англ.) // : journal. — 2007. — June ( vol. 42 , no. 6 ). — P. 1137—1141 . — doi : . — . — PMC .
- Zhao Y., Samal E., Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis (англ.) // Nature : journal. — 2005. — July ( vol. 436 , no. 7048 ). — P. 214—220 . — doi : . — . — .
- Xiao J., Luo X., Lin H., Zhang Y., Lu Y., Wang N., Zhang Y., Yang B., Wang Z. MicroRNA miR-133 represses HERG K+ channel expression contributing to QT prolongation in diabetic hearts (англ.) // J. Biol. Chem. : journal. — 2007. — April ( vol. 282 , no. 17 ). — P. 12363—12367 . — doi : . — .
- Yang B., Lin H., Xiao J., Lu Y., Luo X., Li B., Zhang Y., Xu C., Bai Y., Wang H., Chen G., Wang Z. The muscle-specific microRNA miR-1 regulates cardiac arrhythmogenic potential by targeting GJA1 and KCNJ2 (англ.) // Nat. Med. : journal. — 2007. — April ( vol. 13 , no. 4 ). — P. 486—491 . — doi : . — .
- Carè A., Catalucci D., Felicetti F., Bonci D., Addario A., Gallo P., Bang M. L., Segnalini P., Gu Y., Dalton N. D., Elia L., Latronico M. V., Høydal M., Autore C., Russo M. A., Dorn G. W., Ellingsen O., Ruiz-Lozano P., Peterson K. L., Croce C. M., Peschle C., Condorelli G. MicroRNA-133 controls cardiac hypertrophy (англ.) // Nat. Med. : journal. — 2007. — May ( vol. 13 , no. 5 ). — P. 613—618 . — doi : . — .
- van Rooij E., Sutherland L. B., Qi X., Richardson J. A., Hill J., Olson E. N. Control of stress-dependent cardiac growth and gene expression by a microRNA (англ.) // Science : journal. — 2007. — April ( vol. 316 , no. 5824 ). — P. 575—579 . — doi : . — . — .
- Insull W. The Pathology of Atherosclerosis: Plaque Development and Plaque Responses to Medical Treatment // The American Journal of Medicine. — 2009. — Т. 122 . — С. S3—S14 .
- ↑ Son D.j., Kumar S., Takabe W., Kim C.W., Ni C.W., Alberts-Grill N., Jang I.H., Kim S., Kim W., Kang S.W., Baker A.H., Seo J.W., Ferrara K.W., and Jo H. The atypical mechnosenstitive microRNA-712 derived from pre-ribosomal RNA induces endothelial inflammation and atherosclerosis (англ.) // Nature Communications . — Nature Publishing Group , 2013. — Vol. 4 . — P. 3000 .
- ↑ Basu R., Fan D., Kandalam V., Lee J., Das S.S., Wang X., Baldwin T.A., Oudit G.Y., and Kassiri Z. Timp3 Gene Leads to Abdominal Aortic Aneurysm Formation in Response to Angiotensin II // The Journal of Biological Chemistry. — 2012. — Т. 287 . — С. 44083—44096 .
- Libby P. Inflammation in atherosclerosis (англ.) // Nature. — 2002. — Vol. 402 . — P. 868—874 .
- Maes O. C., Chertkow H. M., Wang E., Schipper H. M. MicroRNA: Implications for Alzheimer Disease and other Human CNS Disorders (англ.) // : journal. — 2009. — May ( vol. 10 , no. 3 ). — P. 154—168 . — doi : . — . — PMC .
- Schratt G. microRNAs at the synapse (англ.) // Nat. Rev. Neurosci. : journal. — 2009. — December ( vol. 10 , no. 12 ). — P. 842—849 . — doi : . — .
- Eloïse A. Kremer, Niharika Gaur, Melissa A. Lee, Olivia Engmann, Johannes Bohacek & Isabelle M. Mansuy. . 7 июля 2022 года.
- Yu-Wen A. Huang, Claudia R. Ruiz, Elizabeth C. H. Eyler, Kathie Lin, Mollie K. Meffertemail. Dual Regulation of miRNA Biogenesis Generates Target Specificity in Neurotrophin-Induced Protein Synthesis. — 2012. — Т. 148 , № 5 . — С. 933—946 . — doi : .
- Feng J., Sun G., Yan J., Noltner K., Li W., Buzin C. H., Longmate J., Heston L. L., Rossi J., Sommer S. S. Evidence for X-chromosomal schizophrenia associated with microRNA alterations (англ.) // PLoS ONE : journal / Reif, Andreas. — 2009. — Vol. 4 , no. 7 . — P. e6121 . — doi : . — . — . — PMC .
- Beveridge N. J., Gardiner E., Carroll A. P., Tooney P. A., Cairns M. J. Schizophrenia is associated with an increase in cortical microRNA biogenesis (англ.) // : journal. — 2009. — September ( vol. 15 , no. 12 ). — P. 1176—1189 . — doi : . — . — PMC .
- Romao J. M., Jin W., Dodson M. V., Hausman G. J., Moore S. S., Guan L. L. MicroRNA regulation in mammalian adipogenesis (англ.) // : journal. — 2011. — September ( vol. 236 , no. 9 ). — P. 997—1004 . — doi : . — .
- Skårn M., Namløs H. M., Noordhuis P., Wang M. Y., Meza-Zepeda L. A., Myklebost O. Adipocyte differentiation of human bone marrow-derived stromal cells is modulated by microRNA-155, microRNA-221, and microRNA-222 (англ.) // : journal. — 2012. — April ( vol. 21 , no. 6 ). — P. 873—883 . — doi : . — .
- Zuo Y., Qiang L., Farmer S. R. Activation of CCAAT/enhancer-binding protein (C/EBP) alpha expression by C/EBP beta during adipogenesis requires a peroxisome proliferator-activated receptor-gamma-associated repression of HDAC1 at the C/ebp alpha gene promoter (англ.) // J. Biol. Chem. : journal. — 2006. — March ( vol. 281 , no. 12 ). — P. 7960—7967 . — doi : . — .
- Zhu H., Shyh-Chang N., Segrè A. V., Shinoda G., Shah S. P., Einhorn W. S., Takeuchi A., Engreitz J. M., Hagan J. P., Kharas M. G., Urbach A., Thornton J. E., Triboulet R., Gregory RI; DIAGRAM Consortium; MAGIC Investigators, Altshuler D., Daley G. Q. The Lin28/let-7 axis regulates glucose metabolism (англ.) // Cell . — Cell Press , 2011. — September ( vol. 147 , no. 1 ). — P. 81—94 . — doi : . — . — PMC .
- Frost R. J., Olson EN. Control of glucose homeostasis and insulin sensitivity by the Let-7 family of microRNAs (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2011. — December ( vol. 108 , no. 52 ). — P. 21075—21080 . — doi : . — . — . — PMC .
- Shigeru Miyaki, Tomoyuki Nakasa, Shuhei Otsuki, Shawn P. Grogan, Reiji Higashiyama, Atsushi Inoue, Yoshio Kato, Tempei Sato, Martin K. Lotz, Hiroshi Asahara. // Arthritis Rheum.. — 2009. — Т. 60 , № 9 . — С. 2723—2730 . — doi : . 9 июля 2022 года.
Литература
- Charles H. Lawrie (Editor) December 2013, Wiley-Blackwell
Ссылки
- .
- Старокадомский, Пётр. . // Сайт Biomolecula.ru (9 июня 2010). Дата обращения: 22 марта 2018.
- Кондратенко, Юлия. . // Сайт Biomolecula.ru (2 июня 2015). Дата обращения: 22 марта 2018.
- Натальин, Павел. . // Сайт Biomolecula.ru (31 мая 2007). Дата обращения: 22 марта 2018.
- Стефанов, Юрий. . // Сайт Biomolecula.ru (5 октября 2007). Дата обращения: 22 марта 2018.
- Старокадомский, Пётр; Натальин, Павел. . // Сайт Biomolecula.ru (7 февраля 2008). Дата обращения: 22 марта 2018.
- Татосян, Карина. . // Сайт Biomolecula.ru (12 августа 2013). Дата обращения: 22 марта 2018.
- Керманов, Антон. . // Сайт Biomolecula.ru (3 октября 2013). Дата обращения: 22 марта 2018.
- Еникеев, Александр. . // Сайт Biomolecula.ru (25 ноября 2014). Дата обращения: 22 марта 2018.
- Ясный, Илья. // Сайт Biomolecula.ru (3 октября 2017). Дата обращения: 22 марта 2018.
- 2020-12-31
- 1