Interested Article - Стратегии достижения пренебрежимого старения инженерными методами

- 2020-08-29
- 1
Стратегии достижения пренебрежимого старения инженерными методами ( англ. Strategies for Engineered Negligible Senescence , сокр. SENS) — термин, введённый геронтологом Обри ди Греем для обозначения концепта для разработки медицинских регенеративных терапий , предназначенных для периодического исправления ущерба , наносимого возрастными изменениями . Основной целью комплекса терапий является достижение пренебрежимого старения за счёт ремонта происходящих в теле со временем повреждений, пока терапии повторяются пациентами.
Конечной задачей SENS является устранение заболеваний связанных со старением и старческой слабостью путём неоднократного уменьшения старческих изменений организма. Достичь этого предлагается путем осуществления серии периодических медицинских вмешательств направленных на восстановление, предотвращение или устранение всех типов молекулярных или клеточных повреждений которые ведут к развитию возрастных патологий и дегенерации.
Пока многие геронтологи находят это достойным обсуждения , а конференции SENS показывают важные исследования в этой области, некоторые утверждают, что конечные цели программы Грея слишком спекулятивны для текущего уровня технологий, ссылаясь на программу как на «фантазию, а не науку» . При этом сам Грей в 2006 году давал личную оценку шанса достижения целей SENS при достаточном финансировании на ближайшие 25 лет лишь в 50 % . В геронтологии стратегии SENS воспринимаются как маргинальные .
Предлагаемые стратегии лечения
Стратегии основаны на уже известных причинах старения клеток и тканей человека и включают в себя 7 основных направлений . При этом стратегии основаны на предположении о том, что старение является лишь набором повреждений, накапливаемых с годами, и не учитывает гипотетически возможные генетически (и эпигенетически) обусловленные факторы старения, которые могут в себя включать фенотипические изменения, происходящие в организме с возрастом.
Обзор
| Тип повреждения (англ.) | Перевод | Предлагаемый подход к решению |
|---|---|---|
| Cell loss and cell atrophy | Потеря клеток и клеточная атрофия | Замена с использованием стволовых клеток |
| Division-obsessed cells | Клетки, одержимые делением | Контроль посредством воздействия на теломеры |
| Death-resistant cells | Клетки, устойчивые к сигналам самоликвидации | Удаление посредством и т. п. |
| Mitochondrial mutations | Митохондриальные мутации | Укрепить пул митохондрий, используя их резервные копии |
| Intracellular waste products | Накопление внутриклеточного мусора | Удаление посредством введения внешних ферментов |
| Extracellular waste products | Накопление межклеточного мусора | Удаление посредством инструментов иммунной системы |
| Extracellular matrix stiffening | Ужесточение внежклеточного матрикса | Удаление посредством разрушителей |
Источник: выступление Обри де Грея на научной конференции
Обезвреживание раковых мутаций
Мутации ядерной ДНК и эпигенетические мутации в клетке могут включать или выключать отдельные гены , менять их экспрессию , а также приводить к изменениям синтезируемых белков. Всё это нарушает работоспособность клеток, а в худших случаях может приводить к возникновению злокачественных опухолей . Также мутации способны порождать клетки , не способные к делению. Такие клетки могут приносить вред окружающим клеткам. Уничтожение подобных клеток может устранить наносимый окружающим клеткам вред .
Нераковые мутации клеток накапливаются с возрастом и теоретически могут оказывать влияние на возрастные заболевания. Но есть основания полагать, что влияние на организм таких мутаций в итоге может оказаться крайне низким. Риск рака даже из-за единичной мутации вынуждает организм вырабатывать защиту даже от незначительных мутаций в клетках, что значительно снижает вред наносимый такими мутациями .
Мало того, мутации накапливается тем быстрее, чем чаще клетки делятся . Поэтому наибольшее количество мутаций накапливается в эмбриональном периоде развития и в детстве . За всю остальную жизнь мутации накапливаются намного медленнее, поэтому подобные мутации не могут внести значительный вклад в состояние здоровья с возрастом за исключением случаев возникновения раковых опухолей .
Раковые клетки , которые начинают бесконечно делиться имеют ограниченный запас теломер и рано или поздно израсходуют их. Но в ходе частых мутаций может активироваться как механизм работы теломеразы , так и альтернативный механизм удлинения теломер. В качестве промежуточного решения для борьбы с раком предлагается разработать препараты, сдерживающие теломеразу в раковых клетках. Однако такие препараты не будут работать с альтернативным механизмом удлинения теломер, который может также появиться в ходе мутаций во время лечения подобными препаратами .
В качестве радикального решения проблемы неконтролируемого деления раковых клеток в рамках SENS предлагается удалить гены теломеразы и гены, отвечающие за альтернативное удлинение теломер, из всех клеток тела. Большая часть клеток организма не использует подобные гены, а запаса теломер стволовых клеток может хватить примерно на 10 лет. Если пересаживать новые стволовые клетки с полным запасом теломер раз в 10 лет, то можно полностью исключить возможность возникновения неконтролируемого деления раковых клеток. Стратегия обезвреживания раковых мутаций описанным способом известна под названием OncoSENS . Данное решение считается самым сложным из числа предлагаемых SENS стратегий. Мало того, может оказаться, что механизм, отвечающий за удлинение теломер, может быть связан и с другими физиологическими функциями .
Предотвращение повреждений из-за мутаций в митохондриях
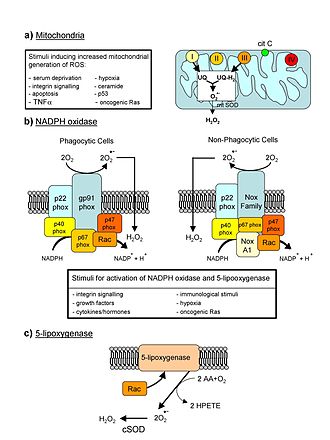
В качестве побочного эффекта клеточного дыхания деятельность митохондрий приводит к появлению свободных радикалов и, в частности, активных форм кислорода , которые способны повредить клеточные структуры. Митохондриальная ДНК особенно уязвима для этих молекул, так как находится близко к их производству. Под действием свободных радикалов в ДНК митохондрии могут возникать делеции . В результате такой мутации митохондрия не способна синтезировать белки , необходимые для окислительного фосфорилирования . Это приводит к недостаточному снабжению клетки АТФ и избытку электронов . Также в качестве побочного явления подобная делеция всего лишь в нескольких клетках может вызывать окислительный стресс по всему организму . Окислительный стресс, в свою очередь, ускоряет сокращение теломер . Постулировано , что окислительный стресс может являться основной причиной старения, а продолжительность жизни может зависеть от уровня окислительного стресса в тканях организма .
Текущее состояние науки не может предотвращать делеции в митохондриальном ДНК или исправлять их сразу после появления, но позволяет разработать систему, которая позволит предотвращать вред, наносимый клетке . Решением проблемы может быть 13 генов, кодирующих белки дыхательной цепи переноса электронов , то есть перенос генов из митохондриальной ДНК в ядро клетки с последующим транспортом синтезируемых белков в митохондрии . Но создание необходимых белков вдали от митохондрии создаёт сложность или даже невозможность транспорта белков внутрь митохондрий через поры в её мембране. Вероятно, этим может объясняться причина, почему эволюционно эти гены так и не перешли в ядерную ДНК .
Поэтому учёные изучают модифицированные гены, найденные в других организмах, кодирующие очень похожие белки. Есть шанс, что модифицированные версии этих генов смогут работать и для человека тоже. Также возможна вставка в белки , которые будут делать молекулу белка достаточно прямой для прохождения через поры мембраны митохондрии. После прохождения через мембрану интеины могли бы самовырезаться с помощью белкового сплайсинга .
Подход, который наиболее активно изучается в SENS Research Foundation был предложен профессором Марисолом Корралом-Дебрински в Институте философии Университета Пьера и Мари Кюри в Париже. Белок синтезируется из матричной РНК очень близко к самой митохондрии, что уменьшает шансы на то, что он успеет слишком сильно закрутиться до попадания в митохондрию . Стратегия предотвращения повреждений в митохондриях также известна под названием MitoSENS . Другим решением проблемы, не связанным с SENS Research Foundation, может быть создание копий «нормальной» митохондриальной ДНК с последующим их транспортом в митохондрии для замены мутировавшей ДНК .
Чистка клеток от накапливаемых отходов
Белки и прочие составляющие клеток тела в конечном итоге повреждаются в результате биохимических реакций либо перестают быть полезными. Клетки имеют множество механизмов для расщепления и переработки подобных нежелательных материалов, позволяющих переиспользовать их или выводить наружу. Одним из таких механизмов является лизосома , переваривающая с помощью ферментов большие молекулы. Но иногда могут появляться молекулы, которые не могут быть переварены лизосомами. Такие молекулы накапливаются как мусор внутри клеток, уменьшая их рабочий объём, и могут быть обнаружены в форме липофусциновых гранул . Липофусцин , как и митохондрии, способен вызывать окислительный стресс в клетках при включении в свой состав железа . Также существует отдельный вид содержащего преимущественно железо липофусцина — гемосидерин , который может накапливаться из-за избытка железа, вызывая гемосидероз .
С возрастанием количества неперевариваемых молекул нарушается функционирование лизосом. Наиболее критичной данная проблема становится для клеток, которые необходимы телу на протяжении всей жизни: клеток сердца, клеток задней части глаза, клеток мозга и нервных клеток. По мере увеличения количества отходов нарушается функция клеток, а с течением времени ухудшается функционирование тканей, приводя к различным возрастным заболеваниям .
В качестве примера подобных заболеваний можно привести атеросклероз . Макрофаги , являясь частью иммунной системы, окружают и захватывают токсичные побочные продукты холестерина , защищая сосуды, и доставляют эти продукты в свои лизосомы для переработки. Чем больше макрофаги доставляют к лизосомам таких продуктов, тем больше накапливается неперевариваемых отходов, что приводит либо к дисфункции макрофагов, либо к их смерти на стенках артерий. В конечном итоге на стенках артерий образуются наслаивания погибших макрофагов, которые забивают артерии, приводя к различным сердечно-сосудистым заболеваниям .
Неспособность клеток переварить остающиеся специфичные отходы деятельности также связана и с другими заболеваниями: макулодистрофия , болезнь Альцгеймера и большинство остальных нейродегенеративных заболеваний .
Одним из возможных решений проблемы накопления липофусцина и других, не поддающихся расщеплению, молекул может быть внедрение новых ферментов в лизосомы . Такой подход схож с лечением лизосомных болезней накопления . Подобные ферменты присутствуют у других организмов, например у почвенных бактерий и грибов, которые участвуют в разложении трупов. Необходимо определить эти ферменты, адаптировать под среду клеток человека и доставить в нуждающиеся в них клетки . Стратегия чистки клеток от накапливаемых отходов известна под названием LysoSENS .
Удаление межклеточных отходов
Межклеточные отходы представляют из себя скопления липких видоизменённых белков, которые перестали выполнять свои функции и нарушают работу клетки или ткани в целом. Большую часть межклеточных отходов составляют амилоиды разных типов .
Самым известным типом амилоида является присущий для болезни Альцгеймера бета-амилоид , представляющий из себя паутинообразный материал, из которого формируются амилоидные бляшки в мозгу, снижая когнитивные способности человека .
Существуют и другие ассоциируемые с возрастом виды амилоидоза . Например, может вызывать сахарный диабет 2-го типа . Также существует , поражающий мужчин старше 70-ти лет и являющийся возможной причиной смерти людей, доживающих до 110 лет .
Ученые разрабатывают методы разложения амилоидных накоплений с помощью иммунотерапии . Могут быть разработаны как активная вакцинация, стимулирующая иммунитет для борьбы с амилоидами, — так и пассивная, представляющая из себя инъекции антител .
Другой обнаруженный вариант решения использует каталитические антитела , в частности, против бета-амилоидов . Часть антител обладает каталитической активностью против определённых антигенов , разрушая их на более мелкие и менее опасные фрагменты. Данный подход имеет преимущества по сравнению с иммунотерапией. При иммунотерапии антитела переносят по одной молекуле. Каталитический подход позволяет одному антителу разрушать сразу много молекул .
Стратегия удаления межклеточных отходов также известна под названием AmyloSENS .
Замена потерянных клеток
Клетки тела постоянно повреждаются как на молекулярном уровне, так и из-за травм. Внутри клеток есть механизмы, позволяющие исправлять некоторые виды повреждений, но другие виды повреждений приводят к уничтожению клетки или к её переходу в особое состояние, при котором клетки не могут делиться, но и не могут подвергнуть себя апоптозу . Некоторые клетки заменяются новыми из резерва тканеспецифичных прогениторных клеток . Но со временем эти клетки тоже становятся менее эффективные в исправлении собственных повреждений .
Некоторые клетки в организме человека не могут быть заменены или с возрастом заменяются медленней, чем они отмирают. Уменьшение количества клеток затрагивает некоторые из наиболее важных тканей организма. Сокращение количества постмитотических кардиоциоцитов в сердце ведёт к его ослаблению. По мере старения к ослаблению организма ведёт сокращение клеток в скелетных мышцах. Потеря нейронов в чёрной субстанции является причиной развития болезни Паркинсона . Потеря клеток иммунной системы делает организм более уязвимым для заболеваний .
Упражнения и введение факторов роста могут лишь частично помочь в восстановлении потерянных клеток. С возрастом эффективность этих методов будет падать. В качестве решения предлагается осуществлять как пересадку клеток , так и пересадку выращенных органов . Органы предлагается выращивать вне тела из клеток пациента, чтобы минимизировать риск иммунного ответа организма . Стратегия замены потерянных клеток в рамках SENS называется RepleniSENS .
Одним из подходов к получению клеток для органов может быть перепрограммирование произвольных клеток той же самой ткани, взятых у пациента в индуцированные плюрипотентные стволовые клетки с дальнейших перепрограммированием этих клеток в требуемый тип .
Удаление неправильно функционирующих клеток
Клеточное старение — это явление, при котором клетки больше не в состоянии делиться по тем или иным причинам, но не подвергаются процессу апоптоза . Клетки могут перестать делиться в результате :
- слишком сильного сокращения длины теломер ,
- повреждения ДНК ,
- нарушений в хроматине ,
- экспрессии онкогенов ,
- химических или механических повреждений (например, из-за химиотерапии или рентгеновского облучения , соответственно),
- повышенного количества митогенов ,
- эндогенных процессов.
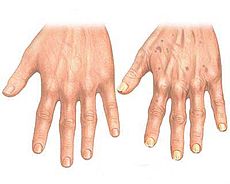
Такие клетки синтезируют повышенное количество различных белков, которые могут возбуждать иммунную систему и приносить вред тканям организма. В небольшом количестве наличие этих клеток в организме практически безвредно, но со временем их число растёт. Старые клетки вызывают дегенерацию суставов, старение иммунной системы, накопление брюшного жира и сахарный диабет 2-го типа .
В качестве решения предлагается разработать синолитики , токсичные для старых клеток, либо активирующие у них механизм апоптоза, но не причиняющие вреда здоровым клеткам. После гибели старых клеток их заменят здоровые клетки путем митоза . Альтернативным вариантом может быть иммунотерания , направленная на старые клетки, и разработка соответствующих вакцин .
Стратегия удаления переставших делиться клеток известна под названием ApoptoSENS .
Удаление межклеточных полимерных связей
Клетки удерживаются вместе с помощью структурных белков . Часть из этих белков, сформировавшись однажды, может сохраняться до конца жизни без замены или переработки, либо данные процессы могут протекать медленно. Например, коллаген отвечает за эластичность артерий и сосудов , а также за прочность связок , а кристаллин — за прозрачность хрусталика глаза. Чаще других в организме человека встречается молекула глюкозепана , которая является результатом сшивки производной от D-глюкозы и молекул коллагена или кристаллина. Когда между структурными белками образуется слишком много , ткань может потерять эластичность, вызывая такие проблемы как атеросклероз , пресбиопию и атрофию кожи .
Решением этой проблемы могут быть лекарства, которые разрывают связи белковых молекул и триглицеридов с углеводами , известные как конечные продукты гликирования . В частности предлагается разработать препараты, расщепляющие глюкозепан .
Стратегия удаления межклеточных сшивок между белками также известна под названием GlycoSENS .
Незатронутые проблемы
Сокращение теломер
Клетки могут переставать делиться в том числе из-за сокращения теломер до критического уровня . Наиболее интенсивно сокращение теломер происходит во время деления клеток в период роста организма . Обри ди Грей считает, что сокращение теломер после периода роста может быть незначительным, а современные исследования не позволяют сказать, могут ли клетки переставать делиться при достижении какого-либо определённого среднего количества теломер . Однако, ускоренное укорочение теломер может наблюдаться при таких заболеваниях, как рассеянный склероз или болезнь Альцгеймера . К укорочению теломер в иммунных клетках могут приводить различные типы вируса герпеса .
Сокращение теломер также может изменять пространственную структуру ДНК, что может сказываться на изменении экспрессии различных генов и приводить к фенотипическим изменениям. Эта проблема ещё недостаточно исследована и не рассматривается в рамках SENS.
Научная дискуссия
Некоторые области, входящие в стратегии SENS, активно исследуются в рамках медицины, например: стволовые клетки , болезнь Альцгеймера и . Но программа SENS в целом является спорным предложением. Многие критики утверждают, что сложные биомедицинские явления, связанные с процессом старения , содержат слишком много неизвестных факторов, чтобы программа SENS могла быть полностью реализована в обозримом будущем, поясняя, что отдельные лекарства могут разрабатываться десятилетиями . Рак может заслуживать особого внимания как связанное со старением заболевание, но SENS заявляет, что ядерное повреждение ДНК имеет значение только для старения из-за рака; данное заявление было оспорено в научной литературе, а также материалом в статье о повреждениях ДНК .
В ноябре 2005 года в отчетах EMBO 28 биогерологов опубликовали заявление о критике «Научные факты и повестка дня SENS: что мы можем разумно ожидать от исследований старения?» , в которых утверждается, что «каждое из конкретных предложений, которые составляют программу SENS на нашем нынешнем этапе невежества исключительно оптимистично», и что «некоторые из конкретных предложений потребуют десятилетия упорной работы для внедрения в медицине, если они когда-либо окажутся полезными». Исследователи утверждают, что хотя и существует «обоснование для размышлений о том, что мы в конечном итоге научимся откладывать человеческие болезни в значительной степени», нужно увеличивать фундаментальные исследования, а не целенаправленный подход SENS.
Биогеролог Мариос Кириазис резко критиковал клиническую применимость SENS, утверждая, что такая терапия, если она и будет разработана в лаборатории, практически непригодна для использования широкой общественностью .
Дебаты в журнале MIT Technology Review
В феврале 2005 года журнал « », принадлежащий Массачусетскому технологическому институту , опубликовал статью , Клинического профессора хирургии Йельского университета , автора книги «Как мы умираем» и отца известного американского политика Виктории Нуланд , которая сделала скептический портрет SENS.
В июне 2005 года Дэвид Гобель , генеральный директор и соучредитель Фонда Мафусаила , предложил журналу «Technology Review» сумму в размере 20 000 долларов США для финансирования конкурса, победитель которого сможет публично разъяснить нежизнеспособность подхода SENS. В июле 2005 года была объявлена премия в размере 20 000 долларов США, финансируемую напополам Фондом Мафусалила и журналом «Technology Review», для любого молекулярного биолога, который сможет доказать, что предполагаемые SENS решения были «настолько неправильными, что это недостойно изученных дебатов ». В 2006 году в качестве судей выбрали , , , Викрама Шила Кумара и Крейга Вентера .
В итоге никто из 50 участников премию не выиграл . Судьи посчитали, что никому не удалось дискредитировать программу SENS, но все согласились с тем, что один из контраргументов и его коллег был самым красноречивым. Крейг Вентер указал, что Эстеп с коллегами не продемонстрировали, что программа SENS не достойна обсуждения, но сторонники SENS не предоставили полного решения . Подводя итоги решения судей , редактор журнала «Technology Review», писал, что программа SENS является спекулятивной и не может быть реализована в рамках технологиях, доступных на тот момент . Мирвольд указал, что для реализации программы SENS необходимо ожидать развития технологий и науки до той степени, пока идеи SENS не смогут быть проверены .
Общественные мероприятия SENS
В рамках SENS проводятся конференции и круглые столы. Первый круглый стол был организован в 2000 году . Всего было проведено уже более 10 мероприятий .
Результаты некоторых мероприятий публиковались в журналах или выкладывались в общий доступ. Первая конференция была проведена в сентябре 2003 под названием «10-й Конгресс Международной ассоциации биомедицинской геронтологии»; результаты были опубликованы в журнале « » . Вторая конференция проходила в сентябре 2005 года с публикацией результатов в журнале « Rejuvenation Research » .
Исследовательский фонд SENS
Исследовательский фонд SENS — это некоммерческая организация, финансирующая исследования стратегий достижения пренебрежимого старения с использованием регенеративной медицины в университетах по всему миру, а также в собственном исследовательском центре, расположенном в Калифорнии , США . Одним из основателей является автор концепции SENS Обри ди Грей . Деятельность организации включает научно-исследовательские программы, основанные на стратегиях SENS, и работу с общественностью для повышения интереса к геронтологическим исследованиям.
По состоянию на 2013 год бюджет Фонда, составлял приблизительно 4 миллиона долларов в год. В 2017 году поступления составили более 7 миллионов долларов, 25,5 % из которых — гранты , а остальное — пожертвования. Около половины расходов организации идёт на исследования .
См. также
Примечания
- . SENS Research Foundation (англ.) . 2012-11-18. из оригинала 8 августа 2018 . Дата обращения: 11 августа 2018 .
- Aubrey D. N. J. de Grey . : [ англ. ] / Aubrey D. N. J. de Grey, Michael Rae // Encyclopedia of Gerontology and Population Aging / Ed.: Danan Gu, Matthew E. Dupre. — Springer Cham, 2020. — WD .
- ↑ Technology Review Web Development Team. www2.technologyreview.com. Дата обращения: 12 августа 2018. 2 апреля 2020 года.
- Huber Warner, Julie Anderson, Steven Austad, Ettore Bergamini, Dale Bredesen. // EMBO Reports. — 2005-11. — Т. 6 , вып. 11 . — С. 1006—1008 . — ISSN . — doi : . 12 января 2019 года.
- Aubrey de Grey. (англ.) // MIT Technology Review : сайт. — 2006. 2 апреля 2020 года.
- ↑ Vincent Morelli, Mohamed Sidani. . — Elsevier Health Sciences, 2012-01-09. — 225 с. — ISBN 1455709336 . 15 сентября 2018 года.
- (англ.) . Life Extension Advocacy Foundation . www.leafscience.org (5 сентября 2018). Дата обращения: 15 сентября 2018. 15 сентября 2018 года.
- . SENS Research Foundation (англ.) . 2012-11-18. из оригинала 8 августа 2018 . Дата обращения: 12 августа 2018 .
- International Longevity Alliance. (video). YouTube (26 марта 2023). Дата обращения: 11 апреля 2023. 26 апреля 2023 года.
- ↑ . SENS Research Foundation (англ.) . 2012-11-27. из оригинала 3 августа 2018 . Дата обращения: 12 августа 2018 .
- . — Springer Science & Business Media, 2010-08-17. — С. 820. — ISBN 978-90-481-3998-9 . 22 января 2023 года.
- Скулачёв В. П. // Соросовский образовательный журнал : журнал. — 1999. — № 9 . 30 августа 2018 года.
- A. D. de Grey. // BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology. — 1997-02-01. — Т. 19 , вып. 2 . — С. 161—166 . — ISSN . — doi : . 17 апреля 2017 года.
- ↑ . SENS Research Foundation (англ.) . 2012-11-27. из оригинала 12 августа 2018 . Дата обращения: 12 августа 2018 .
- ↑ Stella Victorelli, João F. Passos. // EBioMedicine. — 2017-03-21. — Т. 21 . — С. 14—20 . — ISSN . — doi : . 11 апреля 2019 года.
- Amutha Boominathan, Shon Vanhoozer, Nathan Basisty, Kathleen Powers, Alexandra L. Crampton. // Nucleic Acids Research. — 2016-11-02. — Т. 44 , вып. 19 . — С. 9342—9357 . — ISSN . — doi : . 17 апреля 2017 года.
- Shaharyar M. Khan, James P. Bennett. (англ.) // Journal of Bioenergetics and Biomembranes. — 2004-08-01. — Vol. 36 , iss. 4 . — P. 387—393 . — ISSN . — doi : . 8 апреля 2017 года.
- Jeannette König, Christiane Ott, Martín Hugo, Tobias Jung, Anne-Laure Bulteau. // Redox Biology. — 2017-01-25. — Т. 11 . — С. 673—681 . — ISSN . — doi : .
- Azhaar Ashraf, Maryam Clark, Po-Wah So. (англ.) // Frontiers in Aging Neuroscience. — 2018. — Vol. 10 . — ISSN . — doi : . 2 сентября 2018 года.
- ↑ . SENS Research Foundation (англ.) . 2012-11-27. из оригинала 8 августа 2018 . Дата обращения: 12 августа 2018 .
- ↑ . SENS Research Foundation (англ.) . 2012-11-26. из оригинала 12 августа 2018 . Дата обращения: 12 августа 2018 .
- Stephanie A. Planque, Yasuhiro Nishiyama, Sari Sonoda, Yan Lin, Hiroaki Taguchi. // The Journal of Biological Chemistry. — 2015-04-17. — Т. 290 , вып. 16 . — С. 10229—10241 . — ISSN . — doi : . 18 августа 2018 года.
- ↑ . SENS Research Foundation (англ.) . 2012-11-26. из оригинала 12 августа 2018 . Дата обращения: 12 августа 2018 .
- Jean-Philippe Coppé, Pierre-Yves Desprez, Ana Krtolica, Judith Campisi. // Annual review of pathology. — 2010. — Т. 5 . — С. 99—118 . — ISSN . — doi : . 15 ноября 2018 года.
- ↑ . SENS Research Foundation (англ.) . 2012-11-26. из оригинала 3 августа 2018 . Дата обращения: 12 августа 2018 .
- ↑ . SENS Research Foundation (англ.) . 2012-11-26. из оригинала 12 августа 2018 . Дата обращения: 12 августа 2018 .
- Rodrigo Calado, Neal Young. // F1000 Medicine Reports. — 2012-04-02. — Т. 4 . — ISSN . — doi : . 18 июня 2019 года.
- Обри Ди Грей . . sens.org . Department of Genetics, University of Cambridge, UK. Дата обращения: 15 сентября 2018. Архивировано из 23 декабря 2010 года.
- Jing-Zhi Guan, Wei-Ping Guan, Toyoki Maeda, Xie Guoqing, Wan GuangZhi. // Molecular and Cellular Biochemistry. — 2015-2. — Т. 400 , вып. 1—2 . — С. 183—187 . — ISSN . — doi : . 15 сентября 2018 года.
- Zhiyou Cai, Liang-Jun Yan, Anna Ratka. // Neuromolecular Medicine. — 2013-3. — Т. 15 , вып. 1 . — С. 25—48 . — ISSN . — doi : . 15 сентября 2018 года.
- Philipp J. Hohensinner, Jörg J. Goronzy, Cornelia M. Weyand. // Aging and Disease. — 2011-12-02. — Т. 2 , вып. 6 . — С. 524—537 . — ISSN . 16 февраля 2019 года.
- ↑ Kyriazis M., Apostolides A. (англ.) // Current Aging Science : journal. — 2015. — Vol. 8 , no. 3 . — P. 227—234 . — doi : . — . 11 июня 2018 года.
- Бенджамин П. Бест. (англ.) // Rejuvenation Research : журнал. — 2009. — 3 November ( no. 12 ). — P. 199—208 . — doi : . — . 15 ноября 2017 года.
- Warner H. , Anderson J. , Austad S. , Bergamini E. , Bredesen D. , Butler R. , Carnes B. A. , Clark B. F. , Cristofalo V. , Faulkner J. , Guarente L. , Harrison D. E. , Kirkwood T. , Lithgow G. , Martin G. , Masoro E. , Melov S. , Miller R. A. , Olshansky S. J. , Partridge L. , Pereira-Smith O. , Perls T. , Richardson A. , Smith J. , von Zglinicki T. , Wang E. , Wei J. Y. , Williams T. F. (англ.) // EMBO Reports. — 2005. — November ( vol. 6 , no. 11 ). — P. 1006—1008 . — doi : . — . .
- Pontin, Jason. . MIT Technology Review (англ.) . из оригинала 9 ноября 2018 . Дата обращения: 18 сентября 2018 .
- Pontin, Jason (July 28, 2005). « от 16 марта 2012 на Wayback Machine ». Technology Review .
- Garreau, Joel (2007-10-31). (англ.) . из оригинала 7 октября 2018 . Дата обращения: 18 сентября 2018 .
- . SENS Research Foundation (англ.) . 2016-02-08. из оригинала 5 июля 2017 . Дата обращения: 20 сентября 2018 .
- . SENS Research Foundation (англ.) . 2016-02-08. из оригинала 6 октября 2018 . Дата обращения: 20 сентября 2018 .
- . SENS Research Foundation (англ.) . 2016-02-08. из оригинала 4 октября 2018 . Дата обращения: 20 сентября 2018 .
- // Annals of the New York Academy of Sciences. — 2004-6. — Т. 1019 . — С. xv—xvi; 1—592 . — ISSN . 20 сентября 2018 года.
- . SENS Research Foundation (англ.) . 2016-02-08. из оригинала 24 сентября 2018 . Дата обращения: 20 сентября 2018 .
- . SENS Research Foundation (англ.) . 2012-11-12. из оригинала 29 августа 2018 . Дата обращения: 28 августа 2018 .
- . SENS Research Foundation (англ.) . 2012-11-12. из оригинала 29 августа 2018 . Дата обращения: 28 августа 2018 .
- . sens.org . SENS Research Foundation (2018). Дата обращения: 15 сентября 2018. Архивировано из 31 мая 2018 года.
Ссылки
- 2020-08-29
- 1