Interested Article - Андрогеновый рецептор

- 2021-04-18
- 1
Андроге́новый реце́птор , или андроге́нный рецептор ( англ. androgen receptor, AR ), или NR3C4 — один из рецепторов стероидных гормонов , активируемый андрогенами — тестостероном или дигидротестостероном . Относится к подсемейству 3, группе С (ген 4) семейства ядерных рецепторов , способных непосредственно взаимодействовать с ядерной ДНК . Андрогеновый рецептор активируется при связывании с андрогенами в цитоплазме , а затем переносится в ядро .
Андрогеновый рецептор — фактор транскрипции , который регулирует экспрессию генов путём взаимодействия с ДНК , а также выполняет другие функции, не связанные с взаимодействием с ДНК . Гены , регулируемые андрогенами посредством AR, имеют важное значение для развития и поддержания мужского фенотипа .
У человека андрогеновый рецептор кодируется геном AR , расположенным на Х-хромосоме в локусе Xq11.2-12 .
В 1953 году Джон Моррис ( англ. John Morris ), акушер из Йельского университета , сообщил о 82 индивидуумах, имевших женский фенотип , несмотря на наличие яичек . Проведённые после этого эндокринологические , патофизиологические , биохимические и молекулярно-биологические исследования позволили установить, что такой фенотип обусловлен синдромом нечувствительности к андрогенам . Эти исследования пролили свет на роль андрогенов в определении мужского пола , механизмы действия андрогенов, а также строение и функционирование андрогеновых рецепторов .
Ген

Ген андрогенового рецептора ( AR ) человека располагается на длинном плече Х-хромосомы в локусе Xq11.2-12, причём 5′-конец гена обращён к центромере . Нуклеотидная последовательность гена содержит 90 тысяч пар оснований и включает 8 экзонов . Их структурная организация аналогична генам других рецепторов стероидных гормонов. Экзон 1 кодирует N-концевой домен (NTD) белка, экзоны 2 и 3 — центральный ДНК -связывающий домен (DBD), а экзоны 4—8 — С-концевой домен. В различных клеточных линиях были выявлены 2 альтернативные формы мРНК AR длиной 8,5 и 11 тысяч оснований соответственно; они являются результатом альтернативного сплайсинга 3′-нетранслируемой области . Никаких структурных и функциональных различий между продуктами трансляции этих мРНК не было обнаружено, однако возможно, что наличие в определённой ткани той или иной формы мРНК определяется специфическими тканевыми регуляторами. В предстательной железе и фибробластах кожи, покрывающей половые органы, преимущественно экспрессируется более длинная мРНК . Ген AR содержит 2 полиморфных участка, состоящих из тринуклеотидных повторов , кодирующих полиглутаминовый и полиглициновый участки N-концевого трансактивационного домена рецептора (подробнее см. раздел ) .
Строение гена AR консервативно среди млекопитающих — от грызунов до человека. Ген локализован на Х-хромосоме и у других млекопитающих, таких как сумчатые и однопроходные , что может отражать связь между AR и другими синтеническими генами .
CAG-повторы
Первый экзон AR содержит несколько участков с повторяющимися последовательностями. Наиболее примечательный из таких повторов начинается с кодона 58 и состоит из 21 ± 2 повтора триплета CAG, поскольку при именно в нём чаще происходит увеличение количества CAG-повторов . Повторы CAG эволюционно консервативны : у крыс и мышей имеются короткие участки CAG-повторов, соответствующие аналогичному участку гена AR человека, который кодирует полиглутаминовый участок андрогенового рецептора, начинающийся с позиции 57. Регион с повторами CAG имеется и в генах AR приматов, причём его длина тем меньше, чем вид более далёк от человека. Как и у других генов, имеющих участки CAG-повторов, длина этого участка у AR широко варьирует из-за ДНК-полимеразы на матрице, поэтому общее число реплицированных триплетов CAG может различаться. Число CAG-повторов варьирует от 14 до 35 и может быть связано с этнической и расовой принадлежностью. Длина полиглутаминового участка AR, кодируемого CAG-повторами, может влиять на активность рецептора и оказывать влияние на риск развития рака предстательной железы .
Регуляция экспрессии
Транскрипция гена AR зависит от типа клеток , а в некоторых тканях — и от возраста. Более того, уровень мРНК AR регулируется андрогенами и другими стероидными гормонами. Промотор гена AR не имеет типичных ТАТА- и СААТ-боксов . В отличие от большинства генов, лишённых ТАТА-бокса, 5'-нетранслируемая область AR содержит GC-обогащённые последовательности, которые связываются с транскрипционным фактором Sp1 . Кроме Sp1, положительно экспрессию AR регулируют такие белки, как CREB и C-myc , а отрицательно — транскрипционный фактор NF-κB и конститутивно активный фактор . Ген AR может транскрибироваться по крайней мере с двух разных промоторов, активность которых зависит от типа клеток. Исследования промотора AR крысы показали наличие множества сайтов связывания с различными коактиваторами транскрипции. AR экспрессируется в самых различных тканях, не имеющих отношения к первичным и вторичным половым органам, что согласуется с его многогранными эффектами. Действительно, сложно найти ткань, в которой не экспрессировалось хотя бы небольшое количество AR (исключение составляет селезёнка ). В печени крысы была выявлена также зависимость уровня экспрессии AR от возраста, что обусловлено связыванием различных транскрипционных факторами со специфическими последовательностями-мишенями в промоторе AR .
У крысы промотор AR содержит ДНК, служащие сайтами связывания для андрогенового рецептора, глюкокортикоидного рецептора и прогестеронового рецептора. В связи с этим существует отрицательная обратная связь , регулирующая транскрипцию AR посредством самого AR. Кастрация приводит к увеличению уровня мРНК AR , однако этот эффект устраняется при приёме андрогенов. Экспрессия AR у крысы отрицательно регулируется андрогенами и гонадотропином фолликулостимулирующим гормоном , причём эта регуляция может быть опосредована циклическим АМФ , для которого в промоторе AR имеется элемент отклика .
Эволюционная консервативность
Консервативность некоторых сегментов гена AR в ходе эволюции отражает критическое значение этих сегментов для функционирования молекулы рецептора. Наиболее консервативный участок — DBD, который практически неизменен в ряду от лягушки Xenopus до человека; кроме того, высокую консервативность демонстрируют лиганд -связывающий домен (LBD) и шарнир ( англ. hinge ) участок. Поскольку AR у различных организмов связываются с очень близкими по строению лигандами, консервативные кодоны 12—43 LBD соответствуют лиганд-связывающему участку. Мутации, затрагивающие LBD, приводят к синдрому нечувствительности к андрогенам, проявляющемуся у широкого ряда видов позвоночных, от лягушек до человека. Кроме того, шарнирный участок, в частности, его N-концевой домен, также высококонсервативен — от лягушек до грызунов. В NTD, кодируемым первым экзоном, начиная с 539 кодона, не наблюдается практически никакой консервативности от грызунов до человека. Однако, анализ последовательностей на участках от кодона 1 до 53 и от кодона 360 до 429 показал, что они кодируют участок белка, консервативный среди различных организмов. Эти участки важны для димеризации AR, и их консервативность отражает функциональное сходство AR у всех приматов .
Структура
Изоформы

Две различные изоформы андрогенового рецептора — AR-A и AR-B — впервые были описаны у человека в фибробластах кожи половых органов. AR-A имеет массу 87 кДа и имеет укороченный, по сравнению с изоформой AR-B (110 кДа), N-концевой домен. В остальном эти изоформы идентичны. Предполагается, что трансляция AR-A начинается с первого внутреннего остатка метионина (Met-188) на том же транскрипте, с которого транслируется полная форма AR-B. Обе изоформы экспрессируются в различных тканей как зародышей, так и взрослых людей (и мужчин, и женщин), однако наиболее обильная экспрессия наблюдается в репродуктивных тканей. Соотношение AR-B:AR-A варьирует в разных тканях и различно на разных стадиях развития. В теменной кости развивающегося плода уровень AR-B относительно низок, в то время как AR-A там не было обнаружено вообще. В человеческих остеобластах были обнаружены обе изоформы. Неизвестно, могут ли эти изоформы участвовать в различных сигнальных путях у людей, но, по-видимому, их функции всё же различаются .
У других позвоночных также было обнаружено несколько изоформ AR. В гортани лягушки Xenopus laevis были описаны две различные изоформы AR, различающиеся N-концевым доменом (AR α и AR β). Экспрессия AR β связана с пролиферацией и дифференцировкой гортанных мышц у молодых особей и хрящей у самцов, в то время как экспрессия AR α сохраняется на протяжении последующих стадий развития. Две различные формы AR (AR1 и AR2) были также обнаружены у рыбы . У этой рыбы две изоформы AR различаются сродством связывания с агонистами, физическими свойствами и распределением по тканям. AR1 экспрессируется в основном в мозге , AR2 — в мозге, яичниках и семенниках . AR2 имеет высокое сродство к большому спектру андрогенов, в то время как AR2 может связываться лишь с тестостероном. Эти данные указывают на то, что у X. laevis и M. undulatus две различные формы андрогеновых рецепторов выполняют различные функции в тканях-мишенях .
Домены

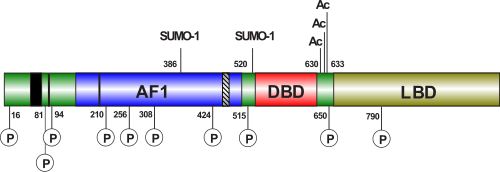
Как и другие ядерные рецепторы, андрогеновый рецептор состоит из С-концевого α-спирального глобулярного домена, отвечающего за связывание с лигандом и димеризацию, который через шарнирный участок связан со вторым α-спиральным глобулярным доменом, отвечающим за специфичное связывание с ДНК и димеризацию, и пластичного N-концевого домена с вариабельной структурой, который в некоторых случаях участвует в регуляции транскрипции . N-концевой домен, который содержит функциональный участок активации 1 (AF-1) между остатками 101—370, необходимый для полной лиганд -активируемой транскрипционной активности, функциональный участок активации 5 (AF-5) между остатками 360—485, ответственный за конститутивную активность (активность без связанного лиганда) и поверхность димеризации, включающую остатки 1—36 (содержащие мотив FXXLF, где F — фенилаланин , L — лейцин , а Х — любой аминокислотный остаток) и 370—494 (обе эти поверхности взаимодействуют с LBD во внутримолекулярном взаимодействии типа «голова к хвосту» ). Шарнирный участок содержит лиганд-зависимый сигнал ядерной локализации . Лиганд-связывающий домен (LBD) содержит функциональный участок активации 2 (AF-2), ответственный за агонист-индуцированную активность (активность в присутствии связанного агониста). AF-2 связывается либо внутримолекулярно с N-концевым мотивом FXXFL, либо с белками- коактиваторами (содержащими мотивы LXXLL или, предпочтительнее, FXXFL) . Кроме того, в LBD находится лиганд-зависимый .
N-Концевой домен
N-Концевой домен андрогенового рецептора (NTD) кодируется экзоном 1 и содержит два основных функциональных участка активации транскрипции и несколько структурных субдоменов. Как и у других рецепторов стероидных гормонов, NTD AR от природы не имеет упорядоченной структуры и существует в виде множества различных конформационных вариантов. Его структура представляет собой , которая способная формировать спиральные участки. Среди его 539 аминокислот находятся два независимых функциональных активационных участка: AF-1 (расположенный между остатками 103—372), который необходим для трансактивации полной формы AR, и AF-5 (расположенный между остатками 362—486), который нужен для трансактивации конститутивно активный AR, лишённых лиганд-связывающего домена (LBD). В настоящее время известно, что AF-5 взаимодействует с обогащёнными глутамином доменами кофакторов семейства р160, например, SRC-1 и / (подробнее о взаимодействиях AR с другими белками ) .
Другой функцией NTD AR является его связывание с LBD, расположенном на C-конце (N/C-взаимодействие). Для связывания с LBD необходимы следующие участки NTD: первые 36 аминокислот и аминокислоты 372—495. Гормонзависимое взаимодействие NTD с LBD может играть роль в стабилизации димера AR и стабилизации комплекса лиганд-рецептор, замедляя скорость диссоциации лиганда и уменьшая деградацию рецептора. Агонисты, такие как тестостерон и дигидростерон, но не антагонисты (например, гидроксифлутамид и бикалутамид) индуцируют N/C-взаимодействие в полной форме AR. Методом флуоресцентного резонансного переноса энергии (FRET) было показано, что внутримолекулярное N/C-взаимодействие начинается в цитоплазме вскоре после связывания с гормоном, а в ядре, при димеризации рецептора, происходит ещё одно N/C-взаимодействие, на этот раз межмолекулярное (между двумя молекулами AR). N/C-взаимодействие происходит преимущественно в подвижных AR, где оно защищает участок связывания с коактиваторами от ненужных белок-белковых взаимодействий. После связывания с ДНК внутримолекулярная N/C-связь разрывается, позволяя различным кофакторам связаться с рецептором. Некоторые мутации в LBD у пациентов с синдромом нечувствительности к андрогенам, нарушают нормальное взаимодействие NTD с LBD, что не позволяло андрогену связаться с рецептором .
NTD — наименее консервативный домен AR; доля совпадения аминокислотных остатков между NTD AR человека и крысы составляет всего лишь 20 % .
ДНК-связывающий домен


ДНК-связывающий домен (DBD) — наиболее консервативный домен AR: сходство между последовательностями аминокислотных остатков DBD человека и крысы достигает 100 %. Совпадение аминокислотных последовательностей между DBD AR и прогестеронового рецептора достигает 79 %, глюкокортикоидного рецептора — 76 % и эстрогенового — 56 % . Он содержит 70 аминокислотных остатков и кодируется экзонами 2 и 3. Он характеризуется большой долей основных аминокислот и девятью консервативными цистеиновыми остатками. DBD имеет компактную глобулярную структуру, в которой хорошо различимы три субструктуры: два цинковых кластера и менее плотное упакованное С-концевое удлинение (CTE). В обоих цинковых кластерах содержится один атом цинка, который посредством координационных связей взаимодействует с четырьмя остатками цистеина. Каждый цинковый кластер с С-конца фланкируется α-спиралью. Два цинковых кластера структурно и функционально различны и кодируются разными экзонами. α-Спираль цинкового кластера, наиболее ближнего к N-концу, непосредственно взаимодействует с особыми последовательностями в ДНК. За специфическое узнавание этих ответных элементов в ДНК отвечают три ключевые аминокислоты (остатки глицина , серина и валина ), в совокупности образующие так называемый Р-бокс (от «proximal» — ближний) (подробнее о взаимодействии AR с ДНК ). Второй цинковый кластер, по-видимому, участвует в белок-белковых взаимодействиях (например, димеризации) и называется D-боксом (от «distal» — дальний) .
Шарнирный участок
Между ДНК-связывающим доменом и лиганд-связывающим доменом располагается неконсервативный шарнирный участок, размер которого у различных рецепторов стероидных гормонов варьирует. Он кодируется экзоном 4. Его можно рассматривать как гибкий линкер между лиганд-связывающим доменом и остальной частью молекулы. Шарнирный участок важен для ядерной локализации и содержит соответствующий сигнал. Кроме того, с шарнирным участок могут связываться некоторые корепрессоры AR. Кроме того, AR может по мотиву [KLLKK] в шарнирном участке .
Лиганд-связывающий домен

Лиганд-связывающий домен ( англ. ligand binding domain , LBD) — второй по консервативности после DBD домен андрогенового рецептора, кодируется экзонами 5—8. Этот домен образуют порядка 250 аминокислотных остатков на С-конце AR. Была определена пространственная структура AR человека в комплексе с синтетическим агонистом (R1881) и . Его пространственная укладка соответствует типичной укладке лиганд-связывающих доменов ядерных рецепторов, хотя идентичность аминокислотных последовательностей с некоторыми другими рецепторами стероидных гормонов может составлять всего 20 %. LBD этих рецепторов включает 12 α-спиралей (согласно некоторым источникам, у AR спираль 2 плохо различима). Связывающий карман включает 18 аминокислотных остатков, более или менее непосредственно взаимодействующих с лигандом. Остатки глутамина 711, метионина 745, аргинина 752 связываются с циклом A стероидного лиганда, а лейцин 704 и аспарагин 705 связываются с его С-кольцом. В связи с этим со связанным лигандом в основном контактируют спирали 4, 5 и 10. Связывающий карман имеет некоторую гибкость и может связываться с лигандами, имеющими различные структуры. При связывании лиганда спираль 12 закрывает собой карман и «закрывает» лиганд внутри. При связывании рецептора с антагонистом спираль 12 отводится назад, где она мешает связыванию коактиваторов в специальной бороздке, формирующейся на LBD после связывания с гормоном. В AR после связывания с лигандом происходит не только закрывание связывающего кармана спиралью 12, но и закрытие бороздки, обеспечивающей связывание LBD с NTD. С этой бороздкой могут связываться некоторые коактиваторы, но основная часть коактиваторов связывается с AR в области NTD .
В LBD находится ещё функциональный активационный участок, AF-2. Его работа в LBD строго зависит от присутствия коактиваторов ядерных рецепторов. В экспериментах in vivo показано наличие благоприятного функционального лиганд-зависимого взаимодействия между AF-2 и NTD (AF-2 взаимодействует в мотивом FXXFL в NTD). AF-2 также может взаимодействовать с белками-коактиваторами, содержащими мотивы LXXLL или, предпочтительнее, FXXFL .
На поверхности LBD была обнаружена особая регуляторная щель, названная BF-3. Она включает остатки Ile -673, Phe -674, Pro -724, Gly -725, Asn -728, Phe-827, Glu -830, Asn-834, Glu-838 и Arg -841. При связывании с BF-3 гормона щитовидной железы трийодтиронина (Т3) и некоторых противовоспалительных препаратов нестероидной природы транскрипционная активность AR и его способность связываться с коактиваторами уменьшалась; причины этого явления до сих пор не ясны. Кроме того, некоторые мутации, затрагивающие BF-3, приводят или к синдрому нечувствительности к андрогенам (мутации потери функции), или к раку предстательной железы (мутации, изменяющие функции). Мутационный анализ показал необходимость некоторых из этих аминокислот для трансактивации AR. Однако это было установлено лишь в присутствии дигидростерона .
Молекулярные основы функционирования
Геномное действие

Сигнальный путь андрогенового рецептора включает в себя следующие этапы. После проникновения тестостерона в клетку-мишень он связывается с андрогеновым рецептором или непосредственно, или после превращения в более метаболически активную форму — 5α-дигидростерон (DHT) — под действием фермента 5-альфа-редуктазы . DHT образует более стабильный комплекс с AR, и действие комплекса AR-DHT в 3—10 раз более сильное, чем комплекса AR-тестостерон. Связывание лиганда с рецептором в цитоплазме вызывает диссоциацию комплексов шаперонов (в том числе белков теплового шока , а именно , Hsp90 и ), которые в состоянии покоя находятся в связанном с AR состоянии и защищают его от деградации. Одновременно в рецепторе происходят конформационные изменения и фосфорилирование , в результате которых он транслоцируется в ядро. В ходе этих преобразований образуется сайт связывания с коактиваторами (AF-2-сайт) , а домен LBD перестраивается из трёхслойной, напоминающей сэндвич структуры из α-спиралей в более компактную структуру путём перемещения С-концевой спирали (спираль 12) в коровую часть белка .
В ядре комплекс рецептора с лигандом связывается с последовательностями-мишенями ДНК (элементами отклика на андрогены, ARE), которые располагаются в промоторах генов-мишеней. Структура ARE различается у различных генов, благодаря чему AR может выполнять множество регуляторных функций в пределах одного ядра. Усилению и большей специфичности взаимодействия AR с ДНК способствует наличие нескольких ARE (в самом деле, единичный ARE обычно обеспечивает лишь малую активность). Более того, специфичности ответа промотора на связывание с AR и усилению взаимодействия способствует наличие двух основных классов ARE. Последовательности ARE первого класса имеют вид R G AACA-NGN-T G TNCT (AR связывается с подчёркнутыми остатками гуанина ); второго — RGGACA-NNA-AGCCAA (это связывание обеспечивает кооперацию двух соседних связанных с ДНК рецепторов и усиливает специфичность) . Кроме того, ARE, как правило, являются сложными элементами и рядом с последовательностями связывания с AR содержат последовательности для взаимодействия с другими транскрипционными факторами , в числе которых транскрипционные факторы «домашнего хозяйства» (Sp1, CCAAT и NF-1), индуцибельные (NF-kB, и ) и тканеспецифичные транскрипционные факторы. Таким образом, AR регулирует экспрессию генов ещё и за счёт взаимодействия с различными транскрипционными факторами .
Связывание с ДНК обеспечивает мотив из двух цинковых пальцев в домене DBD (аминокислотные остатки 550—624). Ключевую роль в этом процессе играют две α-спирали, расположенные перпендикулярно одна другой. N-концевая спираль играет роль распознающего элемента, причём для этого наиболее важны такие её остатки, как глицин 568, серин 569 и валин 572, которые вместе образуют так называемый Р-бокс. Наличие Р-бокса характерно и для ряда других рецепторов стероидных гормонов, а именно глюкокортикоидного , и . Помимо Р-бокса, для связывания AR c ДНК также важны 12 аминокислотных остатков, расположенных в С-концевой спирали внутри AR .
При связывании с ДНК андрогеновый рецептор димеризуется со второй молекулой AR, образуя антипараллельный димер . В то время как для некоторых рецепторов стероидных гормонов показано образование гомодимеров в растворе и кристаллическом виде, AR не может образовывать димер in vitro . Образовавшийся гомодимер рекрутирует дополнительные белки ( РНК-полимеразу II , другие компоненты транскрипционного аппарата — , , другие общие факторы транскрипции (GTF) и другие , например, ) путём специфичного взаимодействия структурных мотивов. Это в конечном счёте приводит к активации или супрессии генов-мишеней андрогенов .
К настоящему моменту описано 146 генов-мишеней андрогенового рецептора, среди которых гены, кодирующие белки, участвующие в фолдинге белков , клеточном метаболизме, секреции , управлении цитоскелетом и внутриклеточной передаче сигнала. Например, AR положительно регулирует экспрессию простатического специфического антигена (PSA), пробазина, (KGF), ингибитора апоптоза р21 , циклин-зависимых киназ 2 и , рецептора инсулиноподобного фактора роста I ( IGF-1R ) . AR проявляет отрицательную регуляцию экспрессии ингибитора клеточного цикла , результатом чего становится усиленная пролиферация клеток , а также генов-супрессоров опухолей , кодирующих белки серпин и .
Хотя в некоторых исследованиях AR было показано, что его связывание с лигандом происходит в цитоплазме, возможно, что эндогенный AR на самом деле накапливается в ядре. Внутриклеточная локализация AR может также зависеть от типа клеток. Нахождение AR в ядре в значительной мере зависит от шарнирного участка, причём делеции, затрагивающие этот участок, значительно снижают лиганд-индуцированное перемещение AR в ядро, хотя и не полностью блокирует передачу сигнала .
Под корегуляторами андрогенового рецептора понимаются белки, которые могут усиливать или подавлять действие AR на транскрипцию. Было идентифицировано свыше 170 корегуляторов AR, среди которых и активаторы, и репрессоры. Некоторые коактиваторы, такие как или коактиватор рецепторов стероидов-2 ( ), связываются с N-концевым доменом андрогенового рецептора и способствуют его димеризации. Интересно, что сверхэкспрессия или амплификация гена SRC-2 наблюдается в 11 % случаев рака предстательной железы . (Подробнее о взаимодействиях AR с другими белками )
Андрогеновый рецептор может принимать участие в эпигенетических процессах. Например, AR может изменять специфичность — фермента , который в несвязанном с AR виде удаляет метильные группы с Н3К4 (остаток лизина 4 в ) и с помощью этого осуществляет репрессию транскрипции гена-мишени. Однако при связывании с AR LSD1 изменяет свою специфичность: комплекс LSD1-AR Н3К9 вместо Н3К4 и таким образом активирует, а не подавляет транскрипцию. Кроме того, AR может привлекать к промоторам генов-мишеней JHDM2A, которая деметилирует Н3К9 и активирует транскрипцию .
Негеномное действие
Функция андрогенового рецептора не ограничивается связыванием со специфическими последовательностями ДНК в ядре. В частности, он может быстро и независимо от пола оказывать влияние на сигнальный путь Src / Raf-1 /Erk-2. Показано, что андрогеновый рецептор принимает участие в опосредованном андрогенами созревании ооцитов у лягушки Xenopus через сигнальный путь МАРК независимо от транскрипции . И AR, и эстрогеновый рецептор могут связываться с гомологичными или гетерологичными лигандами в цитоплазме и демонстрируют ингибирующее действие на клеточную смерть. Однако эти эффекты относительно слабо выражены по сравнению с значительным эффектом на клеточный рост, выживание и дифференцировку , которые оказывает лиганд-связывающий комплекс в ядре .
Функции
В некоторых типах клеток тестостерон взаимодействует непосредственно с андрогеновыми рецепторами, в то время как в других тестостерон сначала превращается ферментом 5-альфа-редуктазой в дигидротестостерон, ещё более мощный агонист андрогенового рецептора . Тестостерон, по-видимому, является основным активирующим гормоном андрогенового рецептора в вольфовом канале , в то время как дигидротестостерон является основным андрогеновым гормоном в мочеполовом синусе , мочеполовом бугорке и волосяных фолликулах . Таким образом, тестостерон отвечает, прежде всего, за развитие мужских первичных половых признаков , тогда как дигидротестостерон — за развитие вторичных . Кроме того, установлено, что полиморфизм в гене AR может быть связан с возрастным облысением у мужчин .
Андрогены замедляют созревание костей , но ещё более выраженный замедляющий эффект на кости оказывает эстроген , образующийся при ароматизации андрогенов. У людей, принимающих стероиды в подростковом возрасте, возможно замедление роста от избытка андрогенов и/или эстрогена. Индивиды со слишком низким уровнем половых гормонов могут иметь небольшой рост во время полового созревания, но по мере взросления их рост увеличивается до нормального, как в случае синдрома нечувствительности к андрогенам или синдрома нечувствительности к эстрогенам .
Кроме того, исследования на мышах , у которых был удалён ген AR ( нокаутные мыши ), показали, что AR имеет важное значение для нормальной женской фертильности , поскольку он необходим для развития и полноценного функционирования фолликулов яичника и овуляции , действуя как через внутрияичниковый , так и нейроэндокринный механизмы .
Действуя через андрогеновые рецепторы, андрогены играют ключевую роль в поддержании целостности мужского скелета. Регулирование этой целостности через сигнальные пути андрогеновых рецепторов (AR) может касаться как остеобластов , так и остеоцитов . Андрогены важны для регуляции активности и чувствительности к половым гормонам, поддержания массы тела и определения телосложения у обоих полов .
Андрогены оказывают существенное влияние на клетки сосудистого эндотелия и гладких мышц сосудов, а также на процесс ангиогенеза . Установлено, что дигидростерон, связываясь с клетками эндотелия, индуцирует экспрессию в них белка сосудистой клеточной адгезии-1 ( VCAM-1 ), что усиливало связывание моноцитов с эндотелием. Кроме того, тестостерон быстро усиливает образование оксида азота ( NO ) в клетках эндотелия аорты у человека .
Регуляция
Для осуществления регуляции транскрипции необходимо, во-первых, путём ремоделирования хроматина сделать доступными для связывания регуляторные элементы в промоторах, и, во-вторых, привлечь основной аппарат транскрипции к промоторам для усиления инициации и/или элонгации транскрипции. Потенциально андрогеновый рецептор может регулировать два этих процесса, приводя к повышению содержания мРНК гена-мишени. Было продемонстрировано доказательство гормон-зависимого ремоделирования хроматина в промоторе вируса опухоли молочной железы мыши ( ), запускаемого AR. В дальнейшем было показано, что для AR-зависимого изменения топологии ДНК и активации генов необходимы BRG-1 и АТР-азная субъединица комплекса ремоделирования хроматина . Предполагается, что SWI/SNF рекрутируется не непосредственно, а при помощи коактиваторов SRC и CREBBP (CBP), причём наличие у последнего белка гистонацетилтрансферазной активности важно для рецептор-зависимой активации и стабилизации SWI/SNF. Впрочем, при работе AR могут не только гистоны , но и сам AR при помощи коактиваторных белков и p300/CBP-ассоциированного фактора ( PCAF ), а также Tip60. Поэтому ацетилирование может и непосредственно активировать AR, и «открывая» хроматин в генах-мишенях .
Другими посттрансляционными модификациями (кроме ацетилирования), которым может подвергаться AR, являются фосфорилирование, метилирование , убиквитинирование и . Все эти реакции обратимы, поэтому возможны также дефосфорилирование, деметилирование, деубиквитинирование и десумоилирование. Около 23 сайтов AR могут непосредственно подвергаться той или иной модификации. Метилирование AR может осуществлять гистонметилтрансфераза SET9; убиквитинирование — RNF6. И метилирование, и убиквитинирование, и сумоилирование происходят по остаткам лизина . Интересно, что большинство сайтов фосфорилирования лежат в пределах региона AR-NTD и AF-1; это подтверждает, что эти модификации непосредственно модулируют рецептор-зависимую трансактивацию. Возможные механизмы, лежащие в основе этого — изменение белок-белковых взаимодействий и/или изменения в структуре и стабильности белка . AR может фосфорилироваться по остаткам серина, треонина и тирозина, и это может осуществляться такими белками, как (CDK9), МАРК, TFIIH (по остаткам серина ); Ack1 (по остаткам тирозина ); киназа (по остаткам треонина ) .

Функционирование AR может подавляться кошапероном BAG1 ; фактором определения клеточной судьбы ; DAXX ; , который рекрутирует гистондеацетилазу ; (GSK3B); гистондеацетилазой 1 (HDAC1), которая деацетилирует гистоны и мешает работе AR ; SRY . С лиганд-связывающим доменом AR и его N-концом может связываться бета-катенин . , ещё один корегулятор AR, связывается с DBD и LBD рецептора . Белок антигена меланомы регулирует функционирование AR, изменяя взаимодействие его доменов .
Установлено, что AR может регулировать инициацию транскрипции генов-мишеней путём взаимодействия с одним из общих факторов транскрипции — . Кроме того, AR может взаимодействовать с другим фактором транскрипции — . Сайты связывания с этими белками находятся в пределах региона AF1. В этом же домене находятся сайты связывания андрогенового рецептора с такими белками, как семейство коактиваторов p160, регулятор клеточного цикла циклин Е1 , факторы транскрипции и STAT3 , новый коактиватор ART-27 и корепрессор SMRT .
С регионом AR-NTD также связывается множество различных белков. Среди них:
- компоненты общего транскрипционного аппарата: TFIIF, , P-TEFb;
- коактиваторы: ARA160, ART27, CREBBP, семейство коактиваторов р160, AES;
- корепрессоры: SMRT, SMAD3;
- факторы транскрипции: STAT3, ANT-1;
- корегуляторные белки: ARNIP, BRCA1 , , циклин D1 , , pRb .
Подводя итог, можно сказать, что AR-зависимая регуляция генов складывается из совместного действия с другими факторами транскрипции (в том числе тканеспецифичными) и многочисленных взаимодействий с транскрипционным аппаратом .
Агонисты, антагонисты и модуляторы

Эндогенными агонистами AR являются тестостерон и дигидростерон, причём дигидростерон значительно более эффективен, чем тестостерон. Известны и синтетические агонисты AR, например, и производное тестостерона андриол . Агонисты AR могут применяться в качестве анаболических средств , в для лечения мужского гипогонадизма и, возможно, могут применяться в качестве . Недавние исследования показали, что связывание агонистов (как и некоторых антагонистов) может изменять последовательность ДНК, распознаваемую комплексом AR-лиганд, что может быть полезным при лечении, например, рака предстательной железы .

Антагонисты андрогеновых рецепторов часто используются при лечении заболеваний, вызванных избытком андрогенов, например, рака предстательной железы. Соединения, являющиеся полными или частичными антагонистами андрогеновых рецепторов, называют антиандрогенами . Полными антагонистами AR являются, например, нестероидные соединения , и . Некоторые соединения стероидной природы, например, ципротеронацетат и мифепристон , имеют как антагонистическое, так и агонистическое действие на AR . Прогестины в высоких дозах могут блокировать андрогеновые рецепторы , поскольку андрогеновый рецептор наиболее родственен рецепторам прогестерона .
(SARM) оказывают влияние как на геномное, так и на негеномное действие андрогенов за счёт взаимодействия с ними в цитоплазме. Разработка таких соединений, которые модулируют биологическую активность AR тканеспецифичным образом, началась в 1999 году . В настоящее время ведутся клинические испытания препаратов группы SARM энобосарма , действующего преимущественно на кости и мышцы, и .
Связывание AR c антагонистами, агонистами и прочими модуляторами вызывает в нём конформационные изменения, в результате которых набор корегуляторов (коактиваторов и корепрессоров), с которыми может взаимодействовать AR, изменяется. Таким образом, тканевая специфичность и селективность действия того или иного модулятора объясняется уникальным корегулятором, с которым может взаимодействовать рецептор после связывания с модулятором, а силу конечного ответа определяют уровни определённых коактиваторов и корепрессоров .
Роль в патогенезе
Синдром нечувствительности к андрогенам

Разнообразные мутации (как правило, миссенс-мутации ) андрогенового рецептора, делающие невозможным внутриклеточную передачу сигнала через AR при связывании с тестостероном, приводят к развитию состояния, известного как синдром нечувствительности к андрогенам (AIS). У индивидуумов с AIS в ходе эмбрионального развития клетки Лейдига вырабатывают нормальное количество тестостерона, однако производные вольфова протока , дающие начало элементам мужской половой системы, остаются недоразвитыми. Мюллеровы протоки разрушаются под действием антимюллерова гормона , выделяемого клетками Сертоли . Семенники располагаются в брюшной или паховой области и в постпубертантный период характеризуются недоразвитыми клетками Лейдига и с незрелыми клетками Сертоли и примитивными гоноцитами , развитие которых не идёт дальше стадии сперматогониев . В некоторых случаях у пациентов с полностью выраженным AIS наружные гениталии при рождении соответствуют женскому фенотипу и представлены слепо заканчивающимся вагинальным карманом, а в подростковый период начинается развитие молочных желёз. В других случаях, когда AIS выражен не в полной мере, гениталии с гипоспадией и не соответствуют ни чисто мужскому, ни женскому фенотипу. Наконец, в случае умеренно выраженного AIS пациенты характеризуются относительно нормальным мужским фенотипом и бесплодием или атрофией мышц во взрослом возрасте, обусловленной . В раннем детстве и постпубертатном периоде в плазме крови больных AIS отмечается уровень тестостерона, соответствующий или слегка превышающий нормальное содержание этого гормона у мужчин, а также повышенный уровень лютеинизирующего гормона . Однако в условиях полной или частичной нечувствительности к тестостерону начинают преобладать эффекты эстрогена , образующегося при ароматизации тестостерона .
Синдром Кеннеди
Синдром Кеннеди, также известный как спинобульбарная (то есть связанная со спинным и продолговатым мозгом ) , развивается в тех случаях, когда количество CAG-повторов в AR увеличивается до 40—62 повторов. У пациентов с синдромом Кеннеди развиваются прогрессирующие неврологические нарушения, обусловленные дегенерацией спинномозговых мотонейронов и последующим ослаблением мышц; обычно болезнь проявляется в возрасте 40—60 лет. Неврологические проявления синдрома Кеннеди объясняются тем, что белки, содержащие чрезмерно длинные полиглутаминовые участки, индуцируют апоптоз в нейронах , что характерно для многих нейродегенеративных заболеваний . Интересно, что синдром Кеннеди нередко сопровождается нечувствительностью к андрогенам, поскольку AR со слишком длинными полиглутаминовым участком не может нормально функционировать .
Сердечно-сосудистые заболевания
Имеются многочисленные данные о связи андрогенового рецептора и сердечно-сосудистых заболеваний . Согласно эпидемиологическим и клиническим данным, андрогены выступают в качестве независимых факторов, обусловливающих более высокую чувствительность к атеросклерозу у мужчин через неблагоприятное воздействие на липиды , кровяное давление и метаболизм глюкозы . Существуют доказательства того, что андрогены задействованы в преждевременном развитии коронарной недостаточности у спортсменов. В то же время недостаток андрогенов, в особенности, тестостерона, обусловленный старением у мужчин или двусторонней оофорэктомии у женщин, связан с появлением гипертензии , диабета , атеросклероза, причём заместительная тестостероновая терапия оказалась эффективной в отношении таких больных. В нормальных физиологических концентрациях тестостерон может оказывать благоприятное действие на кровеносную систему , усиливая анти-коагулирующую активность, и может проявлять антитромбические эффекты. Более того, кратковременное применение тестостерона у мужчин, страдающих коронарной недостаточностью, уменьшало миокардиальную ишемию и улучшало эндотелиальные вазомоторные функции. Впрочем, данные об участии андрогенов в защите от атеросклероза остаются противоречивыми .
Рак
Рак предстательной железы

Для развития и целостного функционирования предстательная железа нуждается в андрогенах. Врождённая дисфункция андрогенового рецептора или 5-альфа-редуктазы у мужчин приводит либо к полному отсутствию, либо лишь к минимальному развитию предстательной железы. То же самое верно и для самцов других животных. Через неделю после кастрации предстательная железа самца крысы подвергается дегенерации из-за апоптоза эпителиальных клеток (после удаления семенников уровень андрогенов недостаточен для поддержания целостности простаты). Андрогены также относятся к факторам, стимулирующим развитие рака предстательной железы. Изучение евнухоидных индивидуумов показало, что у них простата остаётся маленькой и не подвергается гипертрофии или злокачественному перерождению. Более того, в животных моделях канцерогенеза в предстательной железе необходимо наличие семенников или экзогенных андрогенов для поддержания развития опухоли. У трансгенных мышей с повышенной экспрессией AR в простате клетки эпителия простаты обновляются гораздо быстрее, чем в норме, и простатическая интраэпителиальная неоплазия ( злокачественное новообразование ) у таких мышей появляется значительно раньше. Хотя необходимость андрогенов для развития рака простаты не вызывает сомнений, сложно установить связь между относительным уровнем андрогенов в крови и риском развития рака простаты. Для объяснения различий в частоте возникновения и степени выраженности рака простаты были предложены расовые различия в уровне циркулирующих в крови андрогенов. Впрочем, данные по связи между уровнем андрогенов в крови и риском развития рака предстательной железы весьма противоречивы, и окончательного решения по этому вопросу нет. Возможно, противоречивость данных объясняется варьирующей активностью андрогеновых рецепторов, которая может играть исключительно важную роль в развитии рака простаты .
Показано, что генетическое разнообразие в локусе AR связано с риском рака простаты. В частности, установлено, что количество повторов в области CAG-повторов обратно связано с активностью AR. Проявление этого на клеточном уровне тканеспецифично из-за того, что полиглутаминовый участок в N-концевом домене оказывает влияние на взаимодействие рецептора с p160 и другими коактиваторами. В различных исследованиях было показано, что чем короче участок CAG-повторов в N-концевом домене AR, тем агрессивнее опухоль, раньше начало развития рака и выше вероятность рецидива. Впрочем, в других исследованиях получены иные данные. С риском рака простаты связывают и другие изменения в AR , например, в 5'-нетранслируемой области , но объяснения этим связям пока ещё нет. В отличие от синдрома нечувствительности к андрогеном, для которого было определено множество вызывающих мутаций, мутаций, обусловливающих предрасположенность к раку простаты, немного. Впрочем, одна такая наследуемая мутация (миссенс-мутация) была обнаружена в Финляндии .
В клетках рака простаты ген AR иногда подвергается различным изменениям. Было установлено, что клетки рака простаты, как и клетки эпителия простаты, из которых они произошли, сохраняют необходимость в андрогенах, и в условиях недостатка андрогенов погибают. В самом деле, в 80 % случаях клетки рака простаты реагируют на отсутствие андрогенов. Однако в условиях терапии, направленной на снижение уровня андрогенов (например, в результате кастрации), ген AR этих клеток может претерпеть определённые изменения. Так, у 25—30 % пациентов, подвергшихся такому лечению, ген AR претерпевает амплификацию, что увеличивает количество андрогеновых рецепторов в опухолевых клетках и помогает им выживать в условиях низкого уровня андрогенов. В других случаях изменения приводят к повышению чувствительности рецептора к эндогенным агонистам, позволяют ему распознавать более широкий спектр агонистов или уменьшают его чувствительность к антиандрогенам .
Другие раковые заболевания
До 1970-х годов рак молочной железы с некоторым успехом лечили андрогенами (тестостероном, дигидростероном, ). Однако впоследствии оказалось, что у женщин, страдающих раком молочной железы, наблюдается повышенный уровень андрогенов в крови. Действительно, группу риска для рака груди составляют женщины в пре- и постменопаузный период с повышенным содержанием эстрогенов, тестостерона и надпочечниковых андрогенов в крови. Изучение животных моделей показало, что комбинированное воздействие эстрогенов и тестостерона индуцировало пролиферацию клеток молочной железы, сверхэкспрессию андрогенового рецептора и активацию генов-мишеней эстрогенов, причём все эти эффекты устранялись терапией с применением антиандрогенов. Однако разработка антиандрогенов, специфичных к раку молочной железы, находится на зачаточном уровне, хотя о наличии андрогеновых рецепторов в этой ткани известно уже почти 50 лет .
Возможно, что андрогеновые рецепторы задействованы в развитии . Кроме того, выдвинуто предположение, что андрогены (в частности, дигидростерон) участвуют в развитии рака яичника .
Примечания
- ↑ - Ensembl , May 2017
- ↑ - Ensembl , May 2017
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- Roy A. K. , Lavrovsky Y. , Song C. S. , Chen S. , Jung M. H. , Velu N. K. , Bi B. Y. , Chatterjee B. (англ.) // Vitamins and hormones. — 1999. — Vol. 55. — P. 309—352. — .
- Lu N. Z. , Wardell S. E. , Burnstein K. L. , Defranco D. , Fuller P. J. , Giguere V. , Hochberg R. B. , McKay L. , Renoir J. M. , Weigel N. L. , Wilson E. M. , McDonnell D. P. , Cidlowski J. A. (англ.) // Pharmacological reviews. — 2006. — Vol. 58, no. 4 . — P. 782—797. — doi : . — .
- ↑ Brinkmann A. O. (англ.) . — 2000. — .
- Mooradian A. D. , Morley J. E. , Korenman S. G. (англ.) // Endocrine reviews. — 1987. — Vol. 8, no. 1 . — P. 1—28. — doi : . — .
- Heinlein C. A. , Chang C. (англ.) // Molecular endocrinology (Baltimore, Md.). — 2002. — Vol. 16, no. 10 . — P. 2181—2187. — doi : . — .
- Hiort O. , Holterhus P. M. (англ.) // European journal of endocrinology / European Federation of Endocrine Societies. — 2000. — Vol. 142, no. 2 . — P. 101—110. — .
- Chang C. S. , Kokontis J. , Liao S. T. (англ.) // Science (New York, N.Y.). — 1988. — Vol. 240, no. 4850 . — P. 324—326. — .
- Trapman J. , Klaassen P. , Kuiper G. G. , van der Korput J. A. , Faber P. W. , van Rooij H. C. , Geurts van Kessel A. , Voorhorst M. M. , Mulder E. , Brinkmann A. O. (англ.) // Biochemical and biophysical research communications. — 1988. — Vol. 153, no. 1 . — P. 241—248. — .
- ↑ Quigley C. A. , De Bellis A. , Marschke K. B. , el-Awady MK , Wilson E. M. , French F. S. (англ.) // Endocrine reviews. — 1995. — Vol. 16, no. 3 . — P. 271—321. — doi : . — .
- ↑ Gelmann E. P. (англ.) // Journal of clinical oncology : official journal of the American Society of Clinical Oncology. — 2002. — Vol. 20, no. 13 . — P. 3001—3015. — .
- . Дата обращения: 3 октября 2017. 4 октября 2016 года.
- La Spada A. R. , Wilson E. M. , Lubahn D. B. , Harding A. E. , Fischbeck K. H. (англ.) // Nature. — 1991. — Vol. 352, no. 6330 . — P. 77—79. — doi : . — .
- ↑ McEwan I. J. (англ.) // Endocrine-related cancer. — 2004. — Vol. 11, no. 2 . — P. 281—293. — .
- ↑ Liegibel U. M. , Sommer U. , Boercsoek I. , Hilscher U. , Bierhaus A. , Schweikert H. U. , Nawroth P. , Kasperk C. (англ.) // Steroids. — 2003. — Vol. 68, no. 14 . — P. 1179—1187. — .
- McEwan I. J. (англ.) // Methods in molecular biology (Clifton, N.J.). — 2009. — Vol. 505. — P. 3—18. — doi : . — .
- Jenster G. , van der Korput H. A. , Trapman J. , Brinkmann A. O. (англ.) // The Journal of biological chemistry. — 1995. — Vol. 270, no. 13 . — P. 7341—7346. — .
- Schaufele F. , Carbonell X. , Guerbadot M. , Borngraeber S. , Chapman M. S. , Ma A. A. , Miner J. N. , Diamond M. I. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2005. — Vol. 102, no. 28 . — P. 9802—9807. — doi : . — .
- Klokk T. I. , Kurys P. , Elbi C. , Nagaich A. K. , Hendarwanto A. , Slagsvold T. , Chang C. Y. , Hager G. L. , Saatcioglu F. (англ.) // Molecular and cellular biology. — 2007. — Vol. 27, no. 5 . — P. 1823—1843. — doi : . — .
- van Royen M. E. , Cunha S. M. , Brink M. C. , Mattern K. A. , Nigg A. L. , Dubbink H. J. , Verschure P. J. , Trapman J. , Houtsmuller A. B. (англ.) // The Journal of cell biology. — 2007. — Vol. 177, no. 1 . — P. 63—72. — doi : . — .
- Langley E. , Zhou Z. X. , Wilson E. M. (англ.) // The Journal of biological chemistry. — 1995. — Vol. 270, no. 50 . — P. 29983—29990. — .
- Berrevoets C. A. , Doesburg P. , Steketee K. , Trapman J. , Brinkmann A. O. (англ.) // Molecular endocrinology (Baltimore, Md.). — 1998. — Vol. 12, no. 8 . — P. 1172—1183. — doi : . — .
- ↑ Dubbink H. J. , Hersmus R. , Verma C. S. , van der Korput H. A. , Berrevoets C. A. , van Tol J. , Ziel-van der Made A. C. , Brinkmann A. O. , Pike A. C. , Trapman J. (англ.) // Molecular endocrinology (Baltimore, Md.). — 2004. — Vol. 18, no. 9 . — P. 2132—2150. — doi : . — .
- Kaku N. , Matsuda K. , Tsujimura A. , Kawata M. (англ.) // Endocrinology. — 2008. — Vol. 149, no. 8 . — P. 3960—3969. — doi : . — .
- Saporita A. J. , Zhang Q. , Navai N. , Dincer Z. , Hahn J. , Cai X. , Wang Z. (англ.) // The Journal of biological chemistry. — 2003. — Vol. 278, no. 43 . — P. 41998—42005. — doi : . — .
- Gottlieb B. , Lombroso R. , Beitel L. K. , Trifiro M. A. (англ.) // Reproductive biomedicine online. — 2005. — Vol. 10, no. 1 . — P. 42—48. — .
- Choong C. S. , Wilson E. M. (англ.) // Journal of molecular endocrinology. — 1998. — Vol. 21, no. 3 . — P. 235—257. — .
- Meehan K. L. , Sadar M. D. (англ.) // Frontiers in bioscience : a journal and virtual library. — 2003. — Vol. 8. — P. 780—800. — .
- ↑ Davison S. L. , Bell R. (англ.) // Seminars in reproductive medicine. — 2006. — Vol. 24, no. 2 . — P. 71—77. — doi : . — .
- ↑ Proverbs-Singh T. , Feldman J. L. , Morris M. J. , Autio K. A. , Traina T. A. (англ.) // Endocrine-related cancer. — 2015. — Vol. 22, no. 3 . — P. 87—106. — doi : . — .
- Bolton E. C. , So A. Y. , Chaivorapol C. , Haqq C. M. , Li H. , Yamamoto K. R. (англ.) // Genes & development. — 2007. — Vol. 21, no. 16 . — P. 2005—2017. — doi : . — .
- Kemppainen J. A. , Langley E. , Wong C. I. , Bobseine K. , Kelce W. R. , Wilson E. M. (англ.) // Molecular endocrinology (Baltimore, Md.). — 1999. — Vol. 13, no. 3 . — P. 440—454. — doi : . — .
- Vlahopoulos S. , Zimmer W. E. , Jenster G. , Belaguli N. S. , Balk S. P. , Brinkmann A. O. , Lanz R. B. , Zoumpourlis V. C. , Schwartz R. J. (англ.) // The Journal of biological chemistry. — 2005. — Vol. 280, no. 9 . — P. 7786—7792. — doi : . — .
- Pandini G. , Mineo R. , Frasca F. , Roberts C. T. Jr. , Marcelli M. , Vigneri R. , Belfiore A. (англ.) // Cancer research. — 2005. — Vol. 65, no. 5 . — P. 1849—1857. — doi : . — .
- Quero L. , Rozet F. , Beuzeboc P. , Hennequin C. (англ.) // Cancer radiotherapie : journal de la Societe francaise de radiotherapie oncologique. — 2015. — doi : . — .
- Эпигенетика / под ред. С. Д. Эллиса, Т. Дженювейна, Д. Рейнберга.. — М. : Техносфера, 2013. — С. 200. — 496 с. — ISBN 978-5-94836-257-1 .
- Sinisi A. A. , Pasquali D. , Notaro A. , Bellastella A. (англ.) // Journal of endocrinological investigation. — 2003. — Vol. 26, no. 3 Suppl . — P. 23—28. — .
- Ellis J. A. , Stebbing M. , Harrap S. B. (англ.) // The Journal of investigative dermatology. — 2001. — Vol. 116, no. 3 . — P. 452—455. — doi : . — .
- Frank G. R. (англ.) // Medical and pediatric oncology. — 2003. — Vol. 41, no. 3 . — P. 217—221. — doi : . — .
- Walters K. A. , Simanainen U. , Handelsman D. J. (англ.) // Human reproduction update. — 2010. — Vol. 16, no. 5 . — P. 543—558. — doi : . — .
- Sinnesael M. , Claessens F. , Laurent M. , Dubois V. , Boonen S. , Deboel L. , Vanderschueren D. (англ.) // Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. — 2012. — Vol. 27, no. 12 . — P. 2535—2543. — doi : . — .
- Butler M. G. , Manzardo A. M. (англ.) // Journal of assisted reproduction and genetics. — 2015. — doi : . — .
- ↑ Torres-Estay V. , Carreño D. V. , San Francisco I. F. , Sotomayor P. , Godoy A. S. , Smith G. J. (англ.) // The Journal of endocrinology. — 2015. — Vol. 224, no. 3 . — P. 131—137. — doi : . — .
- Shatkina L. , Mink S. , Rogatsch H. , Klocker H. , Langer G. , Nestl A. , Cato A. C. (англ.) // Molecular and cellular biology. — 2003. — Vol. 23, no. 20 . — P. 7189—7197. — .
- Wu K. , Katiyar S. , Witkiewicz A. , Li A. , McCue P. , Song L. N. , Tian L. , Jin M. , Pestell R. G. (англ.) // Cancer research. — 2009. — Vol. 69, no. 8 . — P. 3347—3355. — doi : . — .
- Lin D. Y. , Fang H. I. , Ma A. H. , Huang Y. S. , Pu Y. S. , Jenster G. , Kung H. J. , Shih H. M. (англ.) // Molecular and cellular biology. — 2004. — Vol. 24, no. 24 . — P. 10529—10541. — doi : . — .
- Niki T. , Takahashi-Niki K. , Taira T. , Iguchi-Ariga S. M. , Ariga H. (англ.) // Molecular cancer research : MCR. — 2003. — Vol. 1, no. 4 . — P. 247—261. — .
- Gaughan L. , Logan I. R. , Cook S. , Neal D. E. , Robson C. N. (англ.) // The Journal of biological chemistry. — 2002. — Vol. 277, no. 29 . — P. 25904—25913. — doi : . — .
- Yuan X. , Lu M. L. , Li T. , Balk S. P. (англ.) // The Journal of biological chemistry. — 2001. — Vol. 276, no. 49 . — P. 46647—46654. — doi : . — .
- Yang F. , Li X. , Sharma M. , Sasaki C. Y. , Longo D. L. , Lim B. , Sun Z. (англ.) // The Journal of biological chemistry. — 2002. — Vol. 277, no. 13 . — P. 11336—11344. — doi : . — .
- Nishimura K. , Ting H. J. , Harada Y. , Tokizane T. , Nonomura N. , Kang H. Y. , Chang H. C. , Yeh S. , Miyamoto H. , Shin M. , Aozasa K. , Okuyama A. , Chang C. (англ.) // Cancer research. — 2003. — Vol. 63, no. 16 . — P. 4888—4894. — .
- Bai S. , He B. , Wilson E. M. (англ.) // Molecular and cellular biology. — 2005. — Vol. 25, no. 4 . — P. 1238—1257. — doi : . — .
- ↑ Köhn F. M. , Schill W. B. (англ.) // World journal of urology. — 2003. — Vol. 21, no. 5 . — P. 311—315. — doi : . — .
- Krüskemper H. L. , Noell G. (англ.) // Steroids. — 1966. — Vol. 8, no. 1 . — P. 13—24. — .
- Chen Z. , Lan X. , Thomas-Ahner J. M. , Wu D. , Liu X. , Ye Z. , Wang L. , Sunkel B. , Grenade C. , Chen J. , Zynger D. L. , Yan P. S. , Huang J. , Nephew K. P. , Huang T. H. , Lin S. , Clinton S. K. , Li W. , Jin V. X. , Wang Q. (англ.) // The EMBO journal. — 2015. — Vol. 34, no. 4 . — P. 502—516. — doi : . — .
- Bardin C. W. , Brown T. , Isomaa V. V. , Jänne O. A. (англ.) // Pharmacology & therapeutics. — 1983. — Vol. 23, no. 3 . — P. 443—459. — .
- Raudrant D. , Rabe T. (англ.) // Drugs. — 2003. — Vol. 63, no. 5 . — P. 463—492. — .
- Dalton J. T. , Barnette K. G. , Bohl C. E. , Hancock M. L. , Rodriguez D. , Dodson S. T. , Morton R. A. , Steiner M. S. (англ.) // Journal of cachexia, sarcopenia and muscle. — 2011. — Vol. 2, no. 3 . — P. 153—161. — doi : . — .
- Basaria S. , Collins L. , Dillon E. L. , Orwoll K. , Storer T. W. , Miciek R. , Ulloor J. , Zhang A. , Eder R. , Zientek H. , Gordon G. , Kazmi S. , Sheffield-Moore M. , Bhasin S. (англ.) // The journals of gerontology. Series A, Biological sciences and medical sciences. — 2013. — Vol. 68, no. 1 . — P. 87—95. — doi : . — .
- Brown T. R. (англ.) // Journal of andrology. — 1995. — Vol. 16, no. 4 . — P. 299—303. — .
- Williams L. , Thompson L. D. , Seethala R. R. , Weinreb I. , Assaad A. M. , Tuluc M. , Ud Din N. , Purgina B. , Lai C. , Griffith C. C. , Chiosea S. I. (англ.) // The American journal of surgical pathology. — 2015. — Vol. 39, no. 5 . — P. 705—713. — doi : . — .
- Kohan-Ivani K. , Gabler F. , Selman A. , Vega M. , Romero C. (англ.) // Journal of cancer research and clinical oncology. — 2015. — doi : . — .
Литература
- Handelsman D. J. (англ.) . — 2000. — .
Ссылки
- .
- 2021-04-18
- 1