Interested Article - Оксид фосфора(V)

- 2021-02-25
- 1
Пентаоксид фосфора , также оксид фосфора(V) ( фосфорный ангидрид , пятиокись фосфора ) — неорганическое химическое соединение класса кислотных оксидов с формулой P 2 O 5 . Белый кристаллический порошок, реагирует с водой; ядовит .
Строение
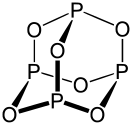
Пары оксида фосфора(V) имеют состав P 2 O 5 . Твёрдый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространственная группа R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространственная группа Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространственная группа Fdd2). Молекулы P 4 O 10 (Н-форма) построены из 4 групп PO 4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль рёбер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру из тетраэдров PO 4 , объединённые в 10-членные (О-форма) и 6-членные (О'-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360 о C.
Свойства
P 2 O 5 очень активно взаимодействует с водой при нагреве (H-форма поглощает воду даже со взрывом), образуя смеси метафосфорных кислот , состав которых зависит от количества воды и других условий:
- При дальнейшем нагреве образует пирофосфорную кислоту:
- На холоде с водой образует метафосфорную кислоту:
При сильном нагревании распадается на:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами , превращая их в нитрилы :
Карбоновые кислоты переводит в соответствующие ангидриды :
Оксид фосфора(V) также взаимодействует со спиртами , эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH 3 и с галогеноводородами , образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P 4 O 10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Оксид активно взаимодействует с водой, поэтому его часто используют в качестве осушителя.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P 2 O 5 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P 4 O 10 .
Основные сферы использования
P 2 O 5 применяют как осушитель газов и . Также он является промежуточным продуктом в производстве ортофосфорной кислоты H 3 PO 4 термическим способом .
Широко используется в органическом синтезе в реакциях дегидратации и конденсации .
Физиологическое значение
Пентаоксид фосфора особо токсичен; относится ко второму классу опасности и в высоких концентрациях раздражает кожу и слизистые оболочки глаз .
ПДК в рабочей зоны - 1 мг/м³ (в соответствии с ГОСТ 12.1.005-76).
ЛД50 на крысах и при пероральном введении составляет 140 мг/кг.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М. : Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9 .
- Кузьменко, Ерёмин, Попков Начала химии 1 том стр. 364
- 2021-02-25
- 1