Кремниевые кислоты
- 1 year ago
- 0
- 0


Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп COOH. Кислотные свойства объясняются тем, что данная группа может сравнительно легко отщеплять протоны . За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH 3 COOH константа диссоциации равна 1,75⋅10 −5 . Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые кислоты.
По международной номенклатуре ИЮПАК, карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание « овая » и слово « кислота ». При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН 3 -СН 2 -СООН — пропановая кислота, СН 3 -CH 2 -С(СН 3 ) 2 -СООН — 2,2-диметилбутановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание « карбоновая » и слово « кислота », не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С 5 Н 9 СООН — циклопентанкарбоновая кислота, СН 3 -С(СН 3 ) 2 -СООН — трет -бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Муравьиная кислота | Метановая кислота | HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | CH 3 COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | C 2 H 5 COOH | пропионаты |
| Масляная кислота | Бутановая кислота | C 3 H 7 COOH | бутираты |
| Валериановая кислота | Пентановая кислота | C 4 H 9 COOH | |
| Капроновая кислота | Гексановая кислота | C 5 H 11 COOH | |
| Энантовая кислота | Гептановая кислота | C 6 H 13 COOH | |
| Каприловая кислота | Октановая кислота | C 7 H 15 COOH | |
| Пеларгоновая кислота | Нонановая кислота | C 8 H 17 COOH | |
| Каприновая кислота | Декановая кислота | C 9 H 19 COOH | |
| Ундециловая кислота | Ундекановая кислота | C 10 H 21 COOH | |
| Лауриновая кислота | Додекановая кислота | C 11 H 23 COOH | лаураты |
| - | Тридекановая кислота | C 12 H 25 COOH | |
| Миристиновая кислота | Тетрадекановая кислота | C 13 H 27 COOH | |
| - | Пентадекановая кислота | C 14 H 29 COOH | |
| Пальмитиновая кислота | Гексадекановая кислота | C 15 H 31 COOH | пальмитаты |
| Маргариновая кислота | Гептадекановая кислота | C 16 H 33 COOH | |
| Стеариновая кислота | Октадекановая кислота | C 17 H 35 COOH | стеараты |
| - | Нонадекановая кислота | C 18 H 37 COOH | |
| Арахиновая кислота | Эйкозановая кислота | C 19 H 39 COOH | |
| - | Генэйкозановая кислота | C 20 H 41 COOH | |
| Бегеновая кислота | Докозановая кислота | C 21 H 43 COOH | |
| - | Трикозановая кислота | C 22 H 45 COOH | |
| Лигноцериновая кислота | Тетракозановая кислота | C 23 H 47 COOH | |
| - | Пентакозановая кислота | C 24 H 49 COOH | |
| Церотиновая кислота | Гексакозановая кислота | C 25 H 51 COOH | |
| - | Гептакозановая кислота | C 26 H 53 COOH | |
| Монтановая кислота | Октакозановая кислота | C 27 H 55 COOH | |
| - | Нонакозановая кислота | C 28 H 57 COOH | |
| Мелиссовая кислота | Триаконтановая кислота | C 29 H 59 COOH | |
| - | Гентриаконтановая кислота | C 30 H 61 COOH | |
| Лацериновая кислота | Дотриаконтановая кислота | C 31 H 63 COOH | |
| Псилластеариновая кислота | Тритриаконтановая кислота | C 32 H 65 COOH | |
| Геддовая кислота | Тетратриаконтановая кислота | C 33 H 67 COOH | - |
| Церопластовая кислота | Пентатриаконтановая кислота | C 34 H 69 COOH | - |
| Гексатриаконтиловая кислота | Гексатриаконтановая кислота | C 35 H 71 COOH | - |
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Акриловая кислота | Пропеновая кислота | C 2 H 3 COOH | Акрилаты |
| цис-2-бутеновая кислота | C 3 H 5 COOH | - | |
| Кротоновая кислота | транс-2-бутеновая кислота | C 3 H 5 COOH | - |
| 3-бутеновая кислота | C 3 H 5 COOH | - | |
| 4-пентеновая кислота | C 4 H 7 COOH | - | |
| транс-2-гексеновая кислота | C 5 H 9 COOH | - | |
| 4-гексеновая кислота | C 5 H 9 COOH | - | |
| 9-деценовая кислота | C 10 H 19 COOH | - | |
| цис-9-додеценовая кислота | C 11 H 21 COOH | - | |
| цис-9-тетрадеценовая кислота | C 13 H 25 COOH | - | |
| Пальмитолеиновая кислота | цис-9-гексадеценовая кислота | C 15 H 29 COOH | - |
| цис-6-гексадеценовая кислота | C 15 H 29 COOH | - | |
| транс-11-октадеценовая кислота | C 17 H 33 COOH | - | |
| цис-6-октадеценовая кислота | C 17 H 33 COOH | - | |
| транс-6-октадеценовая кислота | C 17 H 33 COOH | - | |
| Олеиновая кислота | цис-9-октадеценовая кислота | C 17 H 33 COOH | |
| Элаидиновая кислота | транс-9-октадеценовая кислота | C 17 H 33 COOH | - |
| цис-11-октадеценовая кислота | C 17 H 33 COOH | - | |
| транс-11-октадеценовая кислота | C 17 H 33 COOH | - | |
| цис-9-эйкозеновая кислота | C 19 H 37 COOH | - | |
| цис-11-эйкозеновая кислота | C 19 H 37 COOH | - | |
| цис-13-эйкозеновая кислота | C 19 H 37 COOH | - | |
| транс-13-докозеновая кислота | C 21 H 41 COOH | - | |
| Эруковая кислота | цис-13-докозеновая кислота | C 21 H 41 COOH | - |
| цис-11-докозеновая кислота | C 21 H 41 COOH | - | |
| цис-15-тетракозеновая кислота | C 23 H 45 COOH | - | |
| 17-гексакозеновая | C 25 H 49 COOH | - | |
| 21-триаконтеновая | C 29 H 57 COOH | - | |
| Сорбиновая кислота | транс, транс-2,4-гексадиеновая кислота | C 5 H 7 COOH | - |
| Туатаровая кислота | транс, цис-4,6-октадиеновая кислота | C 7 H 11 COOH | - |
| цис, цис-2,4-декадиеновая кислота | C 9 H 15 COOH | - | |
| Линолевая кислота | цис, цис-9,12-октадекадиеновая кислота | C 17 H 31 COOH | |
| цис, транс-9,11-октадекадиеновая кислота | C 17 H 31 COOH | ||
| транс, транс-9,12-октадекадиеновая кислота | C 17 H 31 COOH | ||
| цис, цис, цис-6,10,14-гексадекатриеновая кислота | C 15 H 25 COOH | ||
| цис, транс, цис-9,11,13-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| цис, цис, цис-9,12,15-октадекатриеновая | C 17 H 29 COOH | - | |
| транс, транс, транс-9,12,15-октадекатриеновая | C 17 H 29 COOH | - | |
| цис, цис, цис-6,9,12-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| цис, транс, цис-6,9,12-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| цис, транс, транс-9,12,15-октадекатриеновая | C 17 H 29 COOH | - | |
| транс, транс, транс-9,12,15-октадекатриеновая | C 17 H 29 COOH | - | |
| Пиноленовая кислота | цис, цис, цис-5,9,12-октадекатриеновая кислота | C 17 H 29 COOH | - |
| транс, транс, цис-8,10,12-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| транс, транс, цис-9,11,13-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| цис, транс, транс-9,11,13-октадекатриеновая кислота | C 17 H 29 COOH | - | |
| Мидовая кислота | цис, цис, цис-5,8,11-эйкозатриеновая кислота | C 19 H 33 COOH | - |
| цис, цис, цис-8,11,14-эйкозатриеновая кислота | C 19 H 33 COOH | - | |
| цис, цис, цис, цис-6,9,12,15-октадекатетраеновая кислота | C 17 H 27 COOH | - | |
| Арахидоновая кислота | цис, цис, цис, цис-6,9,12,15-эйкозатетраеновая кислота | C 19 H 31 COOH | - |
| цис, транс, транс, цис-9,11,13,15-октадекатетраеновая кислота | C 17 H 27 COOH | - | |
| цис, цис, цис, цис-7,10,13,16-докозатетраеновая кислота | C 21 H 35 COOH | - | |
| Тимнодоновая кислота | цис, цис, цис, цис, цис-5,8,11,14,17-эйкозапентаеновая кислота | C 19 H 29 COOH | - |
| цис, цис, цис, цис, цис-7,10,13,16,19-докозапентаеновая кислота | C 21 H 33 COOH | - | |
| цис, цис, цис, цис, цис, цис-4,7,10,13,16,19-докозагексаеновая кислота | C 21 H 31 COOH | - | |
| цис, цис, цис, цис, цис, цис-6,9,12,15,18,21-тетракозагексаеновая кислота | C 23 H 35 COOH | - |
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
|---|---|---|---|
| Щавелевая кислота | Этандиовая кислота | HOOCCOOH | оксалаты |
| Малоновая кислота | Пропандиовая кислота | HOOCCH 2 COOH | малонаты |
| Янтарная кислота | Бутандиовая кислота | HOOC(СH 2 ) 2 COOH | сукцинаты |
| Глутаровая кислота | Пентандиовая кислота | HOOC(СH 2 ) 3 COOH | |
| Адипиновая кислота | Гександиовая кислота | HOOC(СH 2 ) 4 COOH | |
| Пимелиновая кислота | Гептандиовая кислота | HOOC(СH 2 ) 5 COOH | |
| Пробковая кислота | Октандиовая кислота | HOOC(СH 2 ) 6 COOH | |
| Азелаиновая кислота | Нонандиовая кислота | HOOC(СH 2 ) 7 COOH | |
| Себациновая кислота | Декандиовая кислота | HOOC(СH 2 ) 8 COOH | |
| - | HOOC(СH 2 ) 9 COOH | ||
| - | HOOC(СH 2 ) 10 COOH | ||
| Тридекандиовая кислота | HOOC(СH 2 ) 11 COOH | ||
| - | HOOC(СH 2 ) 12 COOH | ||
| - | HOOC(СH 2 ) 13 COOH | ||
| Гексадекандиовая кислота | HOOC(СH 2 ) 14 COOH | ||
| - | HOOC(СH 2 ) 15 COOH | ||
| - | HOOC(СH 2 ) 16 COOH | ||
| - | HOOC(СH 2 ) 17 COOH | ||
| - | HOOC(СH 2 ) 18 COOH | ||
| Японовая кислота | Генэйкозандиовая кислота | HOOC(СH 2 ) 19 COOH |
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
По числу карбоксильных групп кислоты могут быть:
При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH 2 и др.) образуются окси- , кето- , аминокислоты и другие классы соединений.
Уксусная кислота знакома людям с древности. Получение при сухой перегонке (нагревании без доступа воздуха) древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня ( гидротартрат калия ). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля .
Муравьиную кислоту впервые получил в 1670 году английский естествоиспытатель Джон Рэй , нагревая муравьёв в перегонной колбе .
Разнообразные карбоновые кислоты очень широко распространены в природе.
Простейшая из них, акриловая имеет острый запах (на латыни acris — острый, едкий), получается при дегидратации глицерина (при пригорании жиров ). Название кротоновой кислоты происходит от растения кротон слабительный ( Croton tiglium ), из масла которого она была выделена. Ангеликовая кислота была выделена из ангеликового масла полученного из корня растения дягиль лекарственный ( Angelica archаngelica или Archаngelica officinalis ) — дягеля, он же дудник. А тиглиновая — из того же масла Croton tiglium , что и кротоновая кислота, только названа по второй части этого ботанического термина. Сорбиновая кислота была получена из ягод рябины (на латыни — Sorbus ). Эруковая кислота была выделена из масла растения рукола ( Eruca ) — того же семейства Brassicaceae , что и капуста, а также из рапсового масла . При длительном нагревании с сернистой кислотой эруковая кислота изомеризуется в .
Самая распространённая из высокомолекулярных непредельных кислот — олеиновая . Изомерна ей элаидиновая кислота . Наибольшей биологической активностью обладают кислоты с несколькими двойными связями: линолевая с двумя, линоленовая с тремя и арахидоновая с четырьмя. Полиненасыщенные кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей. Названия этих кислот произошли от греч. elaion и лат. oleum — масло, а название арахидоновой (как и арахиновой ) происходит от арахиса. Ненасыщенная рицинолевая кислота выделена из касторового масла , которое содержится в семенах клещевины ( Ricinus communis ). Другая непредельная трёхосновная аконитовая кислота выделена из ядовитых растений Aconitum семейства лютиковых , а название непредельной двухосновной итаконовой кислоты было получено просто перестановкой букв в названии аконитовой кислоты.
с ацетиленовой связью была выделена из горького экстракта коры американского тропического дерева вида Tariri antidesma .
Молочная кислота образуется при молочнокислом брожении сахаров (при прокисании молока и брожении вина и пива).
Яблочная , винная , лимонная , хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы .
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу (амид легко гидролизируется в присутствии H
2
O
2
в щелочной среде или нитрит-иона в кислой); удобный лабораторный метод (если нитрил доступен).
Существует несколько специфических методов, применяемых только для синтеза ароматических кислот.
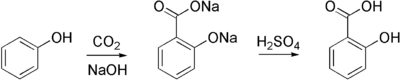

Используется для получения высших гомологов кислот из низших.
а. получают альдегиды и окисляют до соответствующих кислот.
б. получают спирты , а затем сплавляют их при 250—350 °C с щелочью :
в. взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии тетракарбонила никеля или фосфорной кислоты при температуре 300—400 °C и давлении 200—500 атмосфер получают смесь кислот нормального и изостроения, например:

Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода — твёрдые вещества, нерастворимые в воде. Плотность муравьиной и уксусной кислот больше единицы, остальных — меньше. Температура кипения возрастает по мере увеличения молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят при более высокой температуре, чем кислоты изостроения .
У кислот нормального строения есть закономерность: температура плавления кислот с чётным числом атомных углеродов выше, чем температура плавления соседних с нечётным числом. Это объясняется расположением метильной и карбоксильной групп — в кислотах чётного ряда они по разные стороны от оси молекулы, а нечётного — по одну. Благодаря более симметричному строению молекулы кислоты с чётным числом атомов углерода сильнее взаимодействуют между собой в кристаллической решётке и её труднее разрушить при нагревании .
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты. Их молекулы ассоциированы намного сильнее вследствие того что связи в них в большей степени поляризованы по типу . Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя , обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров , а в жидком происходит и линейная ассоциация . Даже в парах они димеризированы . Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль .
Карбоксильная группа планарна, длина связи C=O в различных кислотах составляет 0,118-0,126 нм, связи C-O — 0,121-0,137 нм — наблюдается выравнивание длин связей углерод-кислород при диссоциации . Карбон карбоксильной группы находится в состоянии sp 2 -гибридизации , угол O-C-O в различных кислотах составляет 118—122,5°. Дипольный момент карбоксильной группы составляет ~5,4⋅10 −30 Кл·м . При диссоциации образуется стабилизированный сопряжением анион. В нём обе связи C-O равноценны и составляют 0,127-0,129 нм .
Длина водородной связи в димере 0,26 нм .

Карбоновые кислоты являются слабыми кислотами, p K a большинства алифатических кислот составляет 4,8. Электроноакцепторные заместители и кратные связи усиливают кислотные свойства, электронодонорные, наоборот, ослабляют (хотя и в значительно меньшей степени) . Влияние заместителя быстро падает при отдалении от карбоксильной группы .
Степень диссоциации карбоновых кислот существенно зависит от природы растворителя. В апротонных растворителях карбоновые кислоты практически недиссоциированы. В протонных растворителях наибольшая диссоциация наблюдается в воде .
| Название | p K a | Название | p K a |
|---|---|---|---|
| СF 3 COOH | 0,23 | СCl 3 COOH | 0,64 |
| CHCl 2 COOH | 1,26 | CH 2 NO 2 COOH | 1,48 |
| CF 3 SO 2 CH 2 COOH | 1,88 | CH 3 SO 2 CH 2 COOH | 2,36 |
| NCCH 2 COOH | 2,47 | CH 2 FCOOH | 2,59 |
| CH 2 ClCOOH | 2,86 | CH 2 BrCOOH | 2,90 |
| CH 2 ICOOH | 3,18 | CH 2 OHCOOH | 3,83 |
| C 6 H 5 CH 2 CH 2 COOH | 4,66 | CH 3 С≡С-СOOH | 1,84 |
| CH≡C-COOH | 2,62 | CH 2 CHCOOH | 4,65 |
| транс-CH 3 CH=CH-COOH | 4,68 | транс-C 6 H 5 CH=CH-COOH | 4,44 |
| о-CH 3 OC 6 H 4 COOH | 4,08 | м-CH 3 OC 6 H 4 COOH | 4,10 |
| п-CH 3 OC 6 H 4 COOH | 4,50 | (CH 3 ) 3 C 6 H 4 COOH | 4,20 |
| п-(CH 3 ) 3 C 6 H 4 COOH | 4,38 | п-FC 6 H 4 COOH | 4,15 |
| п-ClC 6 H 4 COOH | 4,00 | HCOOH | 3,75 |
| CH 3 COOH | 4,74 | CH 3 CH 2 COOH | 4,87 |
| CH 3 CH 2 CH 2 COOH | 4,81 | CH 3 CH(CH 3 )COOH | 4,84 |
| (CH 3 ) 3 CCOOH | 5,03 | C 6 H 5 COOH | 4,2 |
| о-CH 3 C 6 H 4 COOH | 3,91 | м-CH 3 C 6 H 4 COOH | 4,25 |
| п-CH 3 C 6 H 4 COOH | 4,37 | о-O 2 NC 6 H 4 COOH | 2,17 |
| м-O 2 NC 6 H 4 COOH | 3,46 | п-O 2 NC 6 H 4 COOH | 3,43 |
| C 6 F 5 COOH | 1,75 | 2,4,6-(O 2 N) 3 C 6 H 2 COOH | 0,65 |
| Кислотный остаток | Название | ||
|---|---|---|---|
| ацилгруппа | название | ацилатгруппа | |
| Н-CO¯ | Формил | H-COO¯ | Формиат |
| CH 3 -CO¯ | Ацетил | CH 3 -COO¯ | Ацетат |
| СН 3 СН 2 -СО¯ | Пропионил | СН 3 СН 2 -СОO¯ | Пропионат |
| СН 3 СН 2 CH 2 -СО¯ | Бутирил | СН 3 СН 2 CH 2 -СОO¯ | Бутират |
| С 3 Н 7 -СО¯ | Изобутирил | С 3 Н 7 -СОO¯ | Изобутират |
| СН 3 (СН 2 ) 3 -СО¯ | Валериил | СН 3 (СН 2 ) 3 -СОO¯ | Валерат |
| С 6 H 5 -СО¯ | Бензоил | С 6 H 5 -СОO¯ | Бензоат |

Карбоновые кислоты проявляют типичные кислотные свойства — при реакции с металлами, их оксидами или их осно́вными
гидроксидами
дают соли соответствующих металлов, могут вытеснять более слабую кислоту из её соли и сами могут быть вытеснены более сильной кислотой:
Соли карбоновых кислот в воде подвергаются гидролизу и имеют щелочную реакцию.
Карбоновые кислоты восстанавливаются до первичных спиртов с помощью литийалюминийгидрида при кипячении в тетрагидрофуране или дибораном в более мягких условиях, кроме того при этом не восстанавливаются группы NO 2 , COOR и CN :
Избирательное восстановление до альдегидов достигается обработкой Li в метиламине (образующийся альдегид защищается растворителем в виде азометина) :
Радикальное галогенирование кислот хлором при облучении УФ-светом при 300—400 °C идёт неселективно и приводит к трудноразделяемой смеси изомеров. Региоселективное α-галогенирование достигается по методу Гелль-Фольгарда-Зелинского — кислоту обрабатывают хлором или бромом в присутствии красного фосфора или соответствующих хлорида или бромида фосфора(III) .
Для реакций нуклеофильного замещения у sp 2 -гибридного ацильного атома углерода реализируется двухстадийный механизм присоединения-отщепления. В первой стадии нуклеофильный агент присоединяется к карбоновой кислоте (или её производному) с образованием заряженного (для анионного нуклеофильного агента) или незаряженного (для нейтрального) тетраэдрического интермедианта. Во второй стадии от этого интермедианта отщепляется в виде аниона или нейтральной молекулы уходящая группа Z и образуется конечный продукт присоединения. Реакция обратима , однако если Z - и Nu - сильно различаются по своей основности и нуклеофильности, она становится необратимой .
Выделение воды идёт за счёт гидроксила карбоксильной группы кислоты и атома водорода гидроксила спирта. В то же время при применении кислоты, меченной 18 O по карбонилу наблюдалась потеря активности. Это свидетельствует о том, что в реакции затрагивается и карбонильный атом кислорода .
Двухосновные янтарная и глутаровая кислоты при нагревании легко превращаются во внутренние ангидриды .
Кетены являются внутренними ангидридами кислот. Их получают в основном элиминированием хлорангидридов кислот. Кетен можно получить пиролизом уксусной кислоты и уксусного ангидрида .
При нагревании аммонийных солей карбоновых кислот образуются их
амиды
:
При нагревании амидов с P 2 O 5 отщепляется вода и образуются нитрилы кислот:
Реакция Бородина-Хунсдиккера — серебряная соль карбоновой кислоты при нагревании с раствором брома в CCl 4 превращается в алкилгалогенид :
При окислении-декарбоксилировании тетраацетатом свинца в зависимости от условий образуются алканы , алкены или сложные эфиры уксусной кислоты :
Карбокатион, отщепляя протон превращается в алкен, а захватывая ацет-анион — в эфир .
Реакция Кольбе — электрохимическая реакция получения углеводородов из карбоновых кислот :
— при реакции с азотистоводородной кислотой образуются амины (промежуточным продуктом является изоцианат ) и выделяется углекислый газ :

При нагревании в присутствии гидроксида бария карбоновые кислоты (а также их кальциевые и бариевые соли) декарбоксилируются с образованием симметрических кетонов. Именно эта реакция долгое время была основным способом получения ацетона :
Примером внутримолекулярной реакции данного типа является получение циклопентанона пиролизом адипиновой кислоты и циклогексанона пиролизом пимелиновой кислоты в присутствии солей бария или кальция () .
Простейшие двухосновные кислоты ( щавелевая и малоновая ) термически неустойчивы и легко декарбоксилируются :
В ИК-спектрах карбоновых кислот проявляются две характеристические полосы поглощения относящиеся к валентным колебаниям гидроксильной группы — 3550−3500 см −1 для свободной и 3330−2500 см −1 для связанной водородной связью и карбоксильной — 1725−1700 см −1 для алифатических кислот, 1715−1690 см −1 для α,β-непредельных, 1700−1680 см −1 для ароматических и 1680−1650 см −1 для связанных внутримолекулярной водородной связью. Карбоксилат-анион имеет две полосы поглощения — 1610−1550 см −1 и 1420−1335 см −1 .
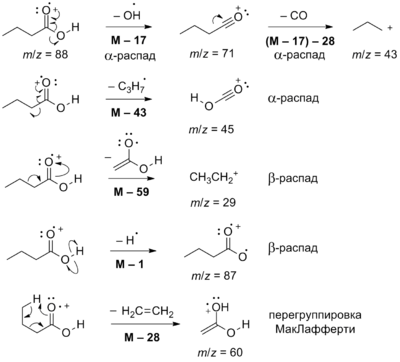
В масс-спектрах карбоновых кислот наиболее интенсивны пики ацил-катионов, образующихся при разрыве ацильной связи. Имеют место также потеря алкильного радикала с образованием иона CO 2 H + с m/z=45, α- и β-расщепление и перегруппировки, для содержащих атом H в γ-положении характерна перегруппировка Мак-Лафферти. Для карбоновых кислот нормального строения характерно наличие пика иона с m/z=60, соответствующего уксусной кислоте .
В УФ-спектре имеются слабые полосы перехода n→π* при 200—210 нм. Для α,β-непредельных характерен более сильные полосы перехода π→π* при 210—220 нм .
Спектры ЯМР характеризуются химическим сдвигом протона карбоксильной группы при 10,5-12 м.д. .
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов , галогенангидридов , виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла , эмульгаторы , смазочные масла ; соли тяжелых металлов — сиккативы , инсектициды и фунгициды , катализаторы . Эфиры кислот — пищевые добавки , растворители ; моно- и диэфиры гликолей и полигликолей — пластификаторы , компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот — эмульгаторы и флотоагенты.
Муравьиная кислота является сильным восстановителем и обладает сильным бактерицидным эффектом. На этих свойствах основано её применение в медицине (используется муравьиный спирт — 1,25 % спиртовой раствор муравьиной кислоты), как консерванта (при силосовании зелёной массы и фруктовых соков) и для дезинфекции. Также применяется для обработки кожи и отделке текстиля и бумаги. Широко используются эфиры муравьиной кислоты — метилформиат , этилформиат и .
Уксусная кислота — в пищевой и химической промышленности (производство ацетилцеллюлозы , из которой получают ацетатное волокно , органическое стекло , киноплёнку ; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. В промышленности — растворитель лаков, коагулянт латекса, ацетилирующий агент .
Масляная кислота — для получения ароматизирующих добавок (эфиры и — ароматизаторы в промышленности), пластификаторов и флотореагентов, как экстрагент щелочно-земельных металлов.
Щавелевая кислота — в металлургической промышленности (удаление окалины ), в качестве протравы при крашении, для отбелки соломы, при приготовлении чернил, как реагент в аналитической органической химии .
Стеариновая C 17 H 35 COOH и пальмитиновая кислота C 15 H 31 COOH — в качестве поверхностно-активных веществ (натриевая соль), смазочных материалов в металлообработке, как компонент и эмульгатор кремов и мазей. Эфиры — антиоксиданты, стабилизаторы пищевых продуктов, компоненты клеящих паст и для обработки текстиля и кожи .
Олеиновая кислота C 17 H 33 COOH — флотореагент при обогащении руд цветных металлов.