Никотинамидадениндинуклеотид
- 1 year ago
- 0
- 0

Никотинамидадениндинуклеоти́д ( сокр. НАД , англ. Nicotinamide adenine dinucleotide , сокр. NAD , устар. diphosphopyridine nucleotide, DPN , ДПН ) — кофермент , имеющийся во всех живых клетках . NAD представляет собой динуклеотид и состоит из двух нуклеотидов , соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин , другой — никотинамид .
Никотинамидадениндинуклеотид существует в двух формах: окисленной (NAD + , NAD ox ) и восстановленной ( NADH , NAD red ).
В метаболизме NAD задействован в окислительно-восстановительных реакциях , перенося электроны из одной реакции в другую. Таким образом, в клетках NAD находится в двух функциональных состояниях: его окисленная форма, NAD + , является окислителем и забирает электроны от другой молекулы , восстанавливаясь в NADH, который далее служит восстановителем и отдаёт электроны. Такие реакции, сопряжённые с переносом электронов, являются основной сферой действия NAD. Однако NAD имеет и другие функции в клетке, в частности, он служит субстратом для ферментов, удаляющих или присоединяющих химические группы к белкам в ходе посттрансляционных модификаций . Из-за важности функций NAD, ферменты, участвующие в его метаболизме, являются мишенями для .
В живых организмах NAD синтезируется из аминокислот аспартата или триптофана . Другие предшественники кофермента поступают в организм экзогенно, как, например, витамин ниацин (витамин В 3 ) с пищей. Похожие соединения образуются в реакциях, приводящих к распаду NAD. После этого такие соединения проходят путь реутилизации, который возвращает их в активную форму. Некоторые молекулы NAD превращаются в никотинамидадениндинуклеотидфосфат ( NADP ). Этот близкий к NAD кофермент химически схож с ним, однако в метаболизме они выполняют разные функции.
Хотя NAD + записывается с плюсом из-за формального положительного заряда атома азота , при физиологических значениях pH большая часть NAD + на самом деле является анионом с отрицательным зарядом −1, а NADH — анионом с зарядом −2.
NAD называют «V-фактором», необходимым для роста гемофильной палочки ( Haemophilus influenzae ) . Так же синонимичным названием является β-NAD .
Никотинамидадениндинуклеотид состоит из двух нуклеотидов, соединённых мостиком из двух фосфатных групп, каждая из которых принадлежит одному из этих нуклеотидов. Кроме фосфатов, в состав этих нуклеотидов входит рибоза и азотистое основание, у одного нуклеотида оно представлено аденином, у другого — никотинамидом. Фосфаты прикрепляются к пятым атомам углерода (5′-положение), а азотистые основания — к первым (1′-положение). Никотинамид может присоединяться к аномерному 1′-атому в двух различных ориентациях, в связи с чем NAD существует в виде двух различных диастереомеров . В живых организмах встречается β-никотинамидный диастереомер NAD + .

В метаболических процессах NAD участвует в окислительно-восстановительных реакциях, принимая или отдавая электроны . Такие реакции, общее уравнение которых приводится ниже, включают формальную передачу гидрид-иона от исходного вещества (субстрата, RН 2 ) к молекуле NAD + . При этом происходит нуклеофильное присоединение гидрида к никотинамидному фрагменту. Таким образом, исходное соединение RН 2 окисляется до R, а NAD + восстанавливается до NADH.
Из электронной пары гидридного иона один электрон переносится на положительно заряженный азот в никотинамидном фрагменте, а атом водорода , оставшийся после отрыва электрона от гидридного иона, переносится на четвёртый атом углерода в кольце (С4), располагающийся напротив атома азота. Стандартный электродный потенциал окислительно-восстановительной пары NAD + /NADH составляет −0,32 вольт , что делает NADH сильным восстановителем . Представленная выше реакция легко обратима , при этом NADH восстанавливает другую молекулу, а сам окисляется до NAD + . Поэтому кофермент может длительно циклично переходить из окисленного состояния в восстановленное, и наоборот, при этом расходования кофермента не происходит .
Физически обе формы кофермента представляют собой белый аморфный гигроскопичный порошок, хорошо растворимый в воде . В твёрдом состоянии кофермент сохраняет стабильность в сухих условиях и в темноте. Раствор NAD + бесцветен и сохраняет стабильность в течение недели при 4 °C и нейтральном pH, однако в щелочах и кислотах он быстро разрушается. При разложении NAD + образуются продукты, являющиеся ингибиторами ферментов .

И NAD + , и NADH устойчиво поглощают ультрафиолетовое излучение из-за наличия аденина. Например, пик поглощения у NAD + приходится на длину волны 259 нм , а коэффициент экстинкции составляет 16900 М −1 см −1 . NADH поглощает и волны больших длин, его второй пик поглощения ультрафиолета соответствует длине волны 339 нм, а коэффициент экстинкции равен 6200 М −1 см −1 . Это различие в спектрах поглощения между окисленной и восстановленной формами кофермента позволяет простым образом измерить переход одной формы в другую при составлении путём измерения поглощения ультрафиолета при 340 нм с помощью спектрофотометра .
NAD + и NADH флуоресцируют по-разному. В растворе NADH имеет пик эмиссии при 460 нм и продолжительность высвечивания 0,4 наносекунд , в то время как окисленная форма кофермента не флуоресцирует . Параметры флуоресцирования NADH изменяются при связывании его с белками, поэтому эти изменения могут быть использованы для измерения константы диссоциации , которая широко используется при изучении кинетики ферментов . Эти изменения во флуоресценции также могут применяться для оценки изменений в окислительно-восстановительном состоянии клетки методами флуоресцентной микроскопии .
В печени крысы суммарное количество NAD + и NADH составляет приблизительно 1 мк моль на грамм сырого веса, что в 10 раз больше концентрации NADP + и NADPH в этих же клетках . Реальную концентрацию NAD + в цитозоле измерить сложнее, и, согласно современным представлениям, в клетках животных она составляет 0,3 мМ , а в клетках дрожжей приблизительно 1,0—2,0 мМ . Однако более 80 % NADH, флуоресцирующего в митохондриях, находится в связанном виде, поэтому его концентрация в растворе значительно ниже .
Данные для других компартментов ограничены, хотя известно, что концентрация NAD + в митохондриях схожа с таковой в цитозоле . В митохондрию NAD + из цитозоля проникает по специальным , так как кофермент не может диффундировать сквозь мембраны .
Баланс между окисленной и восстановленной формой никотинамидадениндинуклеотида называется NAD + /NADH-отношением. Это отношение является важной частью т. н. окислительно-восстановительного состояния клетки — мерой и метаболической активности, и здоровья клетки . Отношение NAD + /NADH имеет комплексное действие и оказывает влияние на активность ряда важнейших ферментов, среди которых и пируватдегидрогеназный комплекс . В здоровых тканях млекопитающих отношение свободных NAD + к NADH в цитоплазме обычно приблизительно равно 700; такое значение хорошо подходит для реакций окисления . Общее отношение NAD + /NADH значительно ниже и составляет от 3 до 10 у млекопитающих . В то же время отношение NADP + /NADPH в норме составляет около 0,005, то есть NADPH является преобладающей формой этого кофермента . Различие в отношениях NAD + /NADH и NADP + /NADPH лежит в основе различных метаболических ролей NAD и NADP.
NAD + синтезируется de novo из аминокислот, а также образуется путём реутилизации продуктов распада пиридиновых нуклеотидов.
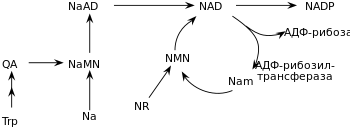
Большинство организмов синтезируют NAD + из аминокислот . Конкретный набор реакций отличается у различных организмов, однако для всех путей синтеза NAD + характерно образование (QA) из аспартата (многие бактерии и растения ) либо триптофана (животные и некоторые бактерии) . Хинолинат декарбоксилируется и фосфорибозилируется фосфорибозилпирофосфатом в никотинат-рибонуклеотид (NaMN). После этой стадии возможны альтернативные пути. В одном из таких путей происходит перенос аденилатного остатка с образованием адениндинуклеотида никотиновой кислоты (дезамино-NAD + , NaAD), после чего остаток никотиновой кислоты в составе NaAD амидируется с образованием никотинамидадениндинуклеотида .
На дополнительном этапе некоторые из новообразованных NAD + превращаются в NADP + ферментом , которая фосфорилирует NAD + . У большинства организмов этот фермент использует АТР в качестве донора фосфорильной группы, хотя некоторые бактерии, как, например, Mycobacterium tuberculosis и гипертермофильная архея используют неорганический пирофосфат в качестве альтернативного донора фосфорильной группы .
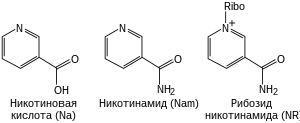
Кроме биосинтеза NAD + de novo из аминокислот аспартата или триптофана , клетки также способны образовывать NAD + из готовой никотиновой кислоты и некоторых её производных. Хотя известны и другие предшественники, в этих метаболических путях обычно используются три природных соединения: никотиновая кислота (Na), никотинамид (Nam) и никотинамидрибозид (NR) . Эти соединения могут попадать в организм экзогенно (например, с пищей, в которой содержится смесь никотиновой кислоты и никотинамида, называемая ниацином, или витамином В 3 ). Однако эти соединения образуются и в самой клетке, где никотинамидный остаток высвобождается из NAD + в реакциях переноса ADP-рибозных остатков. В самом деле, ферменты, обеспечивающие образование NAD + из готовых производных никотиновой кислоты, сконцентрированы в ядре клетки , что может компенсировать большое количество реакций, протекающих в этой органелле с потреблением NAD + . Клетки также могут получать NAD + из своего внеклеточного окружения .
Несмотря на наличие пути синтеза NAD + de novo , реакции образования NAD + из никотиновой кислоты и её производных жизненно важны для людей: при недостатке ниацина развивается заболевание пеллагра . Такая высокая потребность в NAD + обусловлена его постоянным расходованием в таких реакциях, как посттрансляционные модификации, поскольку переход NAD + в NADH и обратно не изменяет общего количества кофермента .
Пути образования NAD + из никотиновой кислоты и её производных у микроорганизмов отличаются от таковых у млекопитающих . Некоторые патогены , например, дрожжи и бактерия Haemophilus influenzae ауксотрофны по NAD + — они не способны синтезировать NAD + de novo , однако такие организмы, являясь зависимыми от экзогенных предшественников NAD + , могут синтезировать NAD + путём реутилизации определённых производных никотиновой кислоты. . У внутриклеточного патогена Chlamydia trachomatis отсутствуют какие-либо гены , которые потенциально могут быть вовлечены в пути образования и NAD + , и NADP + , и он должен получать оба этих кофермента извне .

NAD выполняет несколько важнейших функций в метаболизме. Он выступает как кофермент в окислительно-восстановительных реакциях, как обязательный кофактор ( простетическая группа ) ферментов (циклаз фосфорилированных углеводов , различных эпимераз и др.), как донор АДФ-рибозных остатков в реакциях АДФ-рибозилирования (одна из реакций посттрансляционной модификации белков), как предшественник циклической АДФ-рибозы , являющейся вторичным посредником , а также как субстрат для бактериальных ДНК-лигаз и группы ферментов — сиртуинов , которые используют NAD + для удаления с ферментов. Кроме этих метаболических функций, NAD + может также выполнять важные функции вне клетки, так как он может выделяться из клетки спонтанно или в результате регулируемых процессов .
Наиболее важной функцией NAD + в метаболизме является перенос электронов с одной молекулы на другую. Реакции такого типа катализируются большой группой ферментов, называемых оксидоредуктазами . Правильное название этих ферментов содержит название обоих их субстратов (окислителя и восстановителя), например, NADH-убихиноноксидоредуктаза катализирует перенос электронов с NADH на кофермент Q . Однако, эти ферменты также называют дегидрогеназами и редуктазами: так, НАДН-убихиноноксидоредуктазу часто называют НАДН-дегидрогеназой или кофермент Q-редуктазой .
При связывании с белком NAD + и NADH обычно располагаются в белка, известном как укладка Россмана . Он был назван в честь Майкла Россманна , который был первым учёным, заметившим, что эта структура характерна для нуклеотид-связывающих белков . В этом фолде имеются три или более параллельных бета-слоя , связанных двумя альфа-спиралями в порядке бета-альфа-бета-альфа-бета. В результате образуется общий бета-слой, с каждой стороны фланкированный слоем альфа-спиралей. Поскольку каждый фолд Россмана связывает лишь один нуклеотид, домены, связывающие динуклеотид NAD + , содержат два таких фолда, каждый из которых связывает один нуклеотид кофактора. Однако этот фолд не является универсальным среди NAD-зависимых ферментов; в частности, недавно был описан класс бактериальных ферментов, задействованных в метаболизме аминокислот, которые связывают NAD + , однако лишены этого мотива .
Связываясь с активным сайтом фермента, никотинамидный остаток NAD + и субстрат взаимно ориентируются определённым образом, что благоприятствует эффективной передаче гидрида (H − ). При изучении действия ферментов на дейтерированные субстраты было показано, что оксидоредуктазы селективно переносят гидрид к re - либо si -стороне никотинамидного остатка NAD + . В результате переноса на никотинамидный остаток D − вместо H − образуется один из двух возможных диастереомеров NADH — это и позволяет установить, к какой именно стороне никотинамидного фрагмента NAD + та или иная оксидоредуктаза переносит гидрид.

Высокая селективность обычно наблюдается также и в обратных процессах: оксидоредуктазы могут специфично переносить один из двух атомов водорода NADH (про- R либо про- S ) к восстанавливаемому субстрату. Так, например, алкогольдегидрогеназа дрожжей и алкогольдегидрогеназы из печени человека, лошади переносят к субстрату про- R -атом водорода, а алкогольдегидрогеназа из Drosophila melanogaster производит восстановление при участии про- S -атома водорода . Нативная алкогольдегидрогеназа дрожжей совершает одну «стереохимическую ошибку» на ~ 7 млрд актов катализа; показано, что мутации могут существенно снижать стереоспецифичность .

Эти факты нашли применение в исследованиях кинетики ферментативных реакций, а также в классификации ферментов. Оксидоредуктазы, взаимно ориентирующие субстраты таким образом, при котором гидрид атакует никотинамидный остаток с re -стороны (соответственно, в восстановленном коферменте подвижен H R ), принято называть оксидоредуктазами класса A , тогда как в случае оксидоредуктаз класса B атака происходит с si -стороны (подвижен H S ) .
При изучении ферментов, помимо описанной выше избирательности при выборе атома водорода в молекуле NADH, была обнаружена также и селективность по отношению к энантиотопным сторонам восстанавливаемого субстрата. Это указало на возможность использования ферментов в стереоселективном органическом синтезе для превращения кетонов в ( R )- либо ( S )-спирты.
Хотя механизмы связывания белков с NAD + и NADP + схожи, ферменты, как правило, демонстрируют высокую специфичность к NAD + и NADP + . Такая специфичность вытекает из различных метаболических ролей этих коферментов, и в их коферменто-связывающих сайтах располагаются различные наборы аминокислот. В частности, в активном центре NADP + -зависимых ферментов между аминокислотами основной цепочки и кислотно-фосфатной группой NADP + образуется ионная связь , обусловленная определёнными зарядами аминокислотных остатков. В то же время в сайтах связывания с коферментом у NAD + -зависимых ферментов имеется другой набор зарядов аминокислот, что препятствует связыванию с NADP + . Впрочем, из этого общего правила существуют исключения: такие ферменты, как , глюкозо-6-фосфатдегидрогеназа , метилентетрагидрофолатредуктаза у некоторых видов используют оба кофермента .

Окислительно-восстановительные реакции, катализируемые оксидоредуктазами, составляют важнейшую часть всех метаболических путей , однако наиболее значима их роль в процессах, связанных с выделением энергии из питательных веществ . В них такие восстановленные соединения, как глюкоза и жирные кислоты , окисляются и в связи с этим выделяют энергию. Эта энергия запасается NAD + при его восстановлении до NADH в ряде реакций β-окисления жирных кислот, гликолиза и цикла трикарбоновых кислот . У эукариот электроны, перенесённые на восстановленный в цитоплазме NADH, переносятся в митохондрию для восстановления митохондриальных NAD + с помощью , таких как . Митохондриальный NADH затем окисляется белками электроно-транспортной цепи , которые накачивают протоны в из митохондриального матрикса , и благодаря энергии протонов в ходе окислительного фосфорилирования синтезируется ATP . Такую же транспортную функцию челночные системы имеют и в хлоропластах .
Так как в этих связанных наборах реакций используются и окисленная, и восстановленная формы NAD, клетка поддерживает определённые концентрации NAD + и NADH, и сохраняемое большое значение отношения NAD + /NADH позволяет этому коферменту выступать и в качестве окислителя, и в качестве восстановителя . У NADPH, напротив, главной задачей является служить восстановителем в анаболических процессах, в частности, он вовлечён в такие процессы, как фотосинтез и синтез жирных кислот . Поскольку NADPH выступает как сильный восстановитель и благодаря этому запускает окислительно-восстановительные реакции, значение отношения NADP + /NADPH поддерживается очень низким .
Несмотря на важную роль в катаболизме, NADH также участвует в некоторых анаболических процессах, например, глюконеогенезе . Необходимость NADH в анаболических процессах создаёт проблему для микроорганизмов, растущих на питательных веществах, дающих лишь небольшое количество энергии. Например, нитрифицирующие бактерии окисляют нитрит до нитрата , и выделяющейся при окислении энергии достаточно для накачивания протонов и синтеза ATP, но не для непосредственного образования NADH . Так как NADH всё-таки нужен в анаболических реакциях, эти бактерии используют фермент , которая создаёт достаточную протонодвижущую силу для того, чтобы заставить электроны двигаться по электроно-транспортной цепи в обратном направлении, что приводит к синтезу NADH .

Кофермент NAD + также расходуется в реакциях переноса АДФ-рибозных остатков. Например, ферменты присоединяют свой ADP-рибозный остаток к белкам при посттрансляционной модификации, называемой АДФ-рибозилированием . АДФ-рибозилирование может включать присоединение единственного АДФ-рибозного остатка ( моно (АДФ-рибозил)ирование) или перенос АДФ-рибозных остатков на белки с образованием длинных цепей из этих остатков ( поли (АДФ-рибозил)ирование) . Первоначально моно-АДФ-рибозилирование было известно как механизм созревания бактериальных токсинов , особенно холерного токсина , однако оно задействовано и в нормальной передаче сигналов между клетками . Поли(АДФ-рибозил)ирование осуществляется ферментами поли(АДФ-рибозо)-полимеразами . Поли(АДФ-рибоз)ные цепи участвуют в регуляции некоторых клеточных процессов и особенно важны в клеточном ядре , где они задействованы в репарации ДНК и поддержании теломер . Кроме внутриклеточных АДФ-рибозилтрансфераз, недавно была описана группа внеклеточных АДФ-рибозилтрансфераз, однако их функции пока неизвестны . NAD + также может присоединяться к клеточным РНК при 5′-терминальных модификациях .

Другая функция NAD + в передаче сигналов между клетками обусловлена тем, что он может служить предшественником для циклической АДФ-рибозы — вторичного посредника, который образуется из NAD + под действием АДФ-рибозилциклаз . Эта молекула участвует в , запуская высвобождение кальция из внутриклеточных депо . Такое действие циклической АДФ-рибозы обусловлено её связыванием и последующим открыванием кальциевых каналов , называемых рианодиновыми рецепторами ; эти рецепторы локализованы в мембранах органелл, например, эндоплазматического ретикулума .
NAD + также используется при функционировании сиртуинов , например, . Эти белки являются NAD-зависимыми деацетилазами . Их активность заключается в переносе ацетильных групп с субстратов-белков на АДФ-рибозный остаток NAD + ; это вызывает разрушение кофермента и высвобождение никотинамида и О-ацетил-АДФ-рибозы. По-видимому, сиртуины участвуют в основном в регуляции транскрипции через гистонов и изменение структуры нуклеосом . Однако сиртуины могут деацетилировать и негистоновые белки. Эта активность сиртуинов особенно интересна из-за их важной роли в регуляции старения .
Другими NAD-зависимыми ферментами являются бактериальные ДНК-лигазы , которые соединяют концы двух цепей ДНК , используя второй субстрат — NAD + — как донор остатков AMP для присоединения к 5′-фосфату конца одной из цепей ДНК. Это промежуточное соединение далее атакуется 3′- гидроксильной группой конца другой цепи ДНК, и образуется новая . В отличие от бактериальных ДНК-лигаз, ДНК-лигазы эукариот используют ATP для образования промежуточных соединений ДНК-AMP .
В последние годы было установлено значение NAD + как внеклеточной сигнальной молекулы, участвующей в межклеточной коммуникации . NAD + выделяется и из мозга в кровеносные сосуды , мочевой пузырь , толстую кишку . Предполагается, что NAD + является новым нейромедиатором , который передаёт информацию от нейронов к в гладкомышечных органах . Необходимы дальнейшие исследования для выяснения механизмов внеклеточных действий NAD + и их влияния на здоровье и болезни человека.
Ферменты, вовлечённые в синтез и использование NAD + , имеют важное значение для фармакологии и исследований, направленных на поиск новых способов лечения болезней . При разработке новых препаратов NAD + рассматривается с трёх позиций: как непосредственная мишень для лекарств, для разработки ингибиторов и активаторов ферментов, которые благодаря своей структуре изменяют активность NAD-зависимых ферментов и для изучения методов подавления биосинтеза NAD + .
В настоящий момент сам по себе кофермент NAD + не используется для лечения каких бы то ни было заболеваний. Однако изучается его потенциальная роль в терапии нейродегенеративных заболеваний , таких как болезнь Альцгеймера и болезнь Паркинсона . Имеются различные данные о действии NAD + в нейродегенеративных болезнях. Некоторые исследования на мышах дают обнадёживающие результаты , однако клинические испытания на людях с использованием плацебо не дали какого-либо эффекта .
NAD + также является непосредственной мишенью препарата изониазида , применяющегося для лечения туберкулёза — инфекции , вызываемой бактерией Mycobacterium tuberculosis . Изониазид является пролекарством и при попадании в клетку бактерии он активируется , которая окисляет это вещество в свободно-радикальную форму . Этот радикал далее реагирует с NADH с образованием аддуктов , которые являются очень сильными ингибиторами ферментов и дигидрофолатредуктазы . В одном эксперименте у мышей, которым давали NAD в течение недели, улучшалось взаимодействие клеточного ядра и митохондрий .
Из-за огромного количества оксидоредуктаз, использующих NAD + и NADH в качестве субстратов и связывающихся с ними при помощи одного высококонсервативного структурного мотива, идея разработки ингибитора, блокирующего центр связывания NAD + , и специфичного лишь для определённого фермента, кажется сомнительной . Однако это может быть выполнимым: так, ингибиторы, основанные на и , подавляют в сайте связывания с NAD + . Из-за важной роли этого фермента в метаболизме пуринов эти соединения могут быть полезными противораковыми и противовирусными препаратами или иммунодепрессантами . Другие препараты являются не ингибиторами, а, наоборот, активаторами ферментов, вовлечённых в метаболизм NAD + . В частности, интересной мишенью для таких препаратов могут быть сиртуины, так как активация этих NAD-зависимых деацетилаз увеличивают продолжительность жизни . Такие соединения, как ресвератрол , увеличивают активность этих ферментов, которые могут иметь большое значение благодаря их способности к переносу старения на более позднее время как у позвоночных , так и модельных организмов из числа беспозвоночных .
Из-за различий путей биосинтеза NAD + у различных организмов, в частности, между бактериями и человеком, биосинтез NAD + может стать новой сферой развития новых антибиотиков . Например, фермент , превращающая никотинамид в никотиновую кислоту, служит мишенью разрабатываемых лекарств, так как этот фермент отсутствует у человека, но имеется у бактерий и дрожжей .

Кофермент NAD + был открыт английскими биохимиками Артуром Харденом и в 1906 году . Они заметили, что добавление прокипячённого и профильтрованного экстракта дрожжей к непрокипячённым экстрактам значительно усиливало спиртовое брожение у последних. Неизвестный фактор, ответственный за это явление, они назвали коферментом . В ходе длительного и сложного выделения из экстрактов дрожжей этот теплостойкий фактор был идентифицирован как нуклеотид-сахарофосфат Хансом фон Эйлер-Хельпин . В 1936 году немецкий учёный Отто Генрих Варбург установил функцию этого кофермента по переносу гидридного иона и определил, что в окислительно-восстановительных реакциях участвует никотинамидный остаток .
Источник никотинамида был определён в 1938 году, когда выделил ниацин из печени и показал, что этот витамин содержит никотиновую кислоту и никотинамид . Позднее, в 1939 году, он предоставил первое убедительное доказательство того, что ниацин используется для образования NAD + . В начале 1940-х Артур Корнберг сделал следующий шаг к пониманию роли NAD + в метаболизме: он первым установил присутствие этого кофермента в биосинтетических путях . Далее, в 1949 году американские биохимики Моррис Фридкин и Альберт Ленинджер доказали, что NAD + связан с такими метаболическими путями, как цикл трикарбоновых кислот и окислительное фосфорилирование . Наконец, в 1959 году Джек Присс ( англ. Jack Preiss) и Филип Хандлер ( англ. Philip Handler) описали ферменты и промежуточные соединения биосинтеза NAD + , поэтому путь синтеза NAD + de novo часто называют путём Присса — Хандлера в их честь.
Функции NAD и NADP, не связанные с окислительно-восстановительными реакциями, были открыты лишь в недавнее время . Такой первой открытой функцией NAD + было участие в качестве донора ADP-рибозного остатка в реакциях ADP-рибозилирования; это было установлено в начале 1960-х . Более поздние исследования 1980-х и 1990-х годов показали участие NAD + и NADP + в передаче сигнала между клетками. В частности, действие циклической ADP-рибозы было установлено в 1987 году . Метаболизм NAD + и в XXI веке остаётся в сфере интенсивных исследований. Этот интерес особенно возрос после открытия в 2000 году Шинихиро Имаи ( англ. Shinichiro Imai) и сотрудниками из Массачусетского технологического института NAD + -зависимых деацетилаз — сиртуинов .