Спутник (вирофаг)
- 1 year ago
- 0
- 0

Вирофа́ги ( англ. Virophages , лат. Lavidaviridae) — группа вирусов , которые могут размножаться в клетках только в присутствии другого вируса (вируса-хозяина), однако имеющих более сложные геномы и вирионы , чем другие вирусы-сателлиты . Вирофаги имеют икосаэдрические капсиды , их геномы представлены двуцепочечными молекулами ДНК . Первые представители этой группы вирусов описаны в 2008 году, и к концу 2016 года было известно 18 геномов вирофагов, два из которых почти полностью секвенированы . Вирофаги обнаружены в самых разных местообитаниях — в глубоководных районах океанов и на суше; один вирофаг был выделен из жидкости для контактных линз , поэтому, возможно, вирофаги взаимодействуют и с организмом человека .
Вирофагов предложено выделять в семейство Lavidaviridae , филогенетические связи которого пока не вполне выяснены . Впрочем, по состоянию на март 2018 года Международный комитет по таксономии вирусов официально признавал только два рода и три вида .
У всех изученных вирофагов вирус-хозяин относится к семейству (впрочем, у ряда выделенных вирофагов вирус-хозяин неизвестен), поэтому история изучения вирофагов тесно связана с историей изучения данного семейства гигантских вирусов . До 2008 года в этом семействе был известен только один представитель — мимивирус Acanthamoeba polyphaga mimivirus , поражающий амёбу . В 2008 году был описан ещё один член семейства Mimiviridae , размножающийся в амёбе Acanthamoeba castellanii и получивший название . В то же время в цитоплазме амёб, заражённых мамавирусом, с помощью электронной микроскопии удалось идентифицировать маленькие вирионы диаметром около 50 нм (их геном состоял из 18 343 пар оснований , кодирующих 21 белок ). Они обнаружены в вирусных фабриках мамавируса, за что новый вирус получил название Спутник ( англ. Sputnik) .
В амёбах, заражённых мамавирусом и Спутником одновременно, образующиеся вирионы мамавируса имели неправильную морфологию, и только 30 % от них были способны вызывать инфекцию в других клетках. Поскольку Спутник использовал для своего размножения вирусные фабрики мамавируса, снижая эффективность размножения последнего, его выделили в новую группу вирусов, получившую название вирофагов . С тех пор было описано ещё несколько вирофагов (главным образом, на основании метагеномных данных). Удалось выделить шесть вирофагов из самых разных источников — таких как вода, почва и даже жидкость для промывки контактных линз — добытых в самых разных местах: во Франции , США ( Техас ), Бразилии и Тунисе . Ещё большее число вирофагов известны только по геномным данным и описаны по результатам метагеномного образцов из самых разных мест .
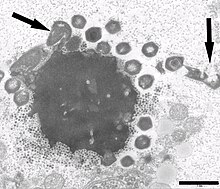
Все выделенные вирофаги — это маленькие вирусы, имеющие икосаэдрические капсиды диаметром 35—74 нм. Только у вирофага Спутник была изучена пространственная структура капсида (с помощью криоэлектронной микроскопии ). Вирионы Спутника имеют диаметр 74 нм, а его икосаэдрический капсид состоит из 260 псевдогексамерных и 12 пентамерных капсомеров , которые располагаются в вершинах капсида. Псевдогексамерные капсомеры образуются при тримеризации мономеров с помощью укладки типа . В капсомерах имеются центральные полости, которые, как и у бактериофагов , могут служить для входа и выхода из капсида молекул ДНК. Под капсидом находится липидный бислой толщиной 4 нм .
Геномы вирофагов представлены двуцепочечными молекулами ДНК размером от 17 до 30 тысяч пар оснований (п. о.) и кодируют от 16 до 34 белков. Около 60 % генов каждого вирофага — гены-сироты ( англ. ORFans) с неизвестными функциями, то есть они не имеют гомологии ни с одним из известных на данный момент генов. Шесть из известных генов вирофагов есть почти у всех вирофагов; они, как правило, играют важнейшую роль в их репликации . К числу этих генов относятся гены, кодирующие большой и малый белки капсида, гены предполагаемого семейства упаковывающих ДНК АТФаз FtsK-HerA, ген цистеиновой протеазы, ген ДНК- хеликазы /праймазы (S3H), а также ген, кодирующий белок, содержащий домен цинковой ленты ( англ. zinc-ribbon domain). Кроме того, у нескольких вирофагов имеются консервативные гены, кодирующие интегразы двух различных семейств (предполагаемая тирозиновая интеграза у Спутника и предполагаемая интеграза rve у мавируса и AML). Наличие нескольких консервативных генов свидетельствует в пользу монофилетического происхождения вирофагов .
По состоянию на 2016 год, в базе данных GenBank находились полные или частичные геномные последовательности 18 вирофагов . К концу 2017 года число полных или частичных геномных последовательностей вирофагов, доступных исследователям, возросло до 57 .
За открытием вирофага Спутник в 2008 году последовало описание трёх других родственных ему вирофагов. Спутник 2 был выделен в 2012 году из жидкости для промывки контактных линз в ассоциации с Lentillevirus — мимивирусом группы А. Оказалось, что геном лентиллевируса содержит интегрированный в него геном Спутника 2, а также ранее неизвестные мобильные элементы, получившие название . Спутник 3 был обнаружен при помощи полимеразной цепной реакции (ПЦР) в 2013 году в образце почвы. В 2014 году был описан Спутник Рио Негро — вирофаг, паразитирующий на вирусе Самба (мимивирус группы С). Капсид этого вирофага вдвое меньше капсидов других Спутников (его диаметр составляет 35 нм против ~70 нм у остальных мимивирусов) .
Геномы всех известных на данный момент Спутников представлены кольцевыми молекулами ДНК. У вирофага Спутника геном включает 18 343 пар оснований (п. о.), 18 338 п. о. — у Спутника 2 и столько же у Спутника 3. Геном Спутника Рио Негро ещё недоступен. Отличия между геномами трёх Спутников составляют менее 10 п. о.; у всех трёх вирофагов геном имеет низкий GC-состав , как у мимивирусов. Они содержат 20—21 открытую рамку считывания ( англ. open reading frame, ORF), которые кодируют белки длиной от 88 до 779 аминокислотных остатков (а. о.). Для четырёх генов из геномов мимивирусов нашлись гомологи в геномах эукариот и бактериофагов , для трёх — среди генов мимивирусов и один ген гомологичен гену вируса архей ; остальные гены не обнаруживают какой-либо гомологии с известными последовательностями. Столь мозаичный состав генов свидетельствует о том, что эти вирофаги участвуют в горизонтальном переносе генов .
Мавирус стал вторым известным вирофагом. Его капсид имеет сферическую форму и достигает 60 нм в диаметре. Он был выделен в 2010 году из прибрежных вод в Техасе, США. Как уже отмечалось, он паразитирует на вирусе , который заражает морского жгутиконосца . Геном мавируса представляет собой кольцевую двуцепочечную ДНК из 19 063 п. о., содержащую 20 ORF. Как и у Спутников, геном этого вирофага характеризуется низким GC-составом. 10 открытых рамок считывания в обнаруживают гомологию с генами ретровирусов , бактерий , эукариот и вирусов, чей геном представлен двуцепочечной ДНК. В частности, 4 гомологичные ORF найдены в геноме Спутника; они кодируют белок капсида, предполагаемую цистеиновую протеазу , предполагаемую GIY-YIG- эндонуклеазу и предполагаемую упаковывающую ДНК АТФазу .
Вирофаг Замилон был выделен в 2013 году из образца почвы из Туниса вместе с мимивирусом Mont1, принадлежащим к группе С. Вирион имеет сферическую форму, его диаметр достигает 50—60 нм. Геном Замилона — это кольцевая молекула ДНК длиной 17 276 п. о. с низким GC-составом, содержит 20 ORF длиной от 222 до 2337 п. о. Он значительно отличается от генома Спутника: у них идентичны 76 % нуклеотидов при покрытии генома Спутника на 75 %. Тем не менее, 17 ORF Замилона гомологичны генам Спутника, две ORF гомологичны генам Megavirus chiliensis , и одна ORF гомологична гену Moumouvirus monve . Согласно предложенной в 2016 году классификации вирофагов, Замилон и Спутник с его вариантами объединяют в один род Sputnikvirus (где они представляют соответственно виды Mimivirus-dependent virus Zamilon и Mimivirus-dependent virus Sputnik ), а мавирус выделяют в отдельный род Mavirus (вид Cafeteriavirus-dependent mavirus ) .
Первым вирофагом, открытым при помощи методов метагеномики , стал (OVL). Он был обнаружен в 2011 году в пробе воды из — гиперсолёного меромиктического озера ( Берег Ингрид Кристенсен , Восточная Антарктида ). Сферические частицы этого вирофага диаметром 50 нм были обнаружены при помощи просвечивающей электронной микроскопии . Геном OLV представляет собой кольцевую двуцепочечную молекулу ДНК, содержащую 26 421 п. о. и имеющую GC-состав 36,5 %. Предполагается, что в геноме OLV закодированы 24 белка, из которых шесть гомологичны белкам Спутника. Среди них белок капсида, упаковывающая ДНК АТФаза, предполагаемая ДНК- полимераза / праймаза и три белка с неизвестной функцией .
В 2012—2014 годах при метагеномном анализе вод озера Йеллоустон были получены полные геномные последовательности семи вирофагов, получивших название Yellowstone Lake virophages (YSLV, возможное русское название — вирофаги озера Йеллоустон). Их геномы насчитывают 22—29 тысяч п. о.; в частности длина генома у вирофага YSLV1 составляет 27 849 п. о. с 26 ORF, у YSLV2 — 23 184 п. о. с 21 ORF, у YSLV3 — 27 050 п. о. с 23 ORF, у YSLV4 — 28 306 п. о. с 34 ORF . GC-состав равен 33,4 % у YSLV1, 33,6 % у YSLV2, 34,9 % у YSLV3 и 37,2 % у YSLV4. По результатам проведённого в 2013 году предварительного кладистического анализа , 4 известных тогда вирофага YSLV образовывали единую кладу — сестринскую группу для Спутника, а вирофаг ALM входил совместно с мавирусом в другую кладу . Ещё 3 вирофага из группы YSLV были обнаружены в 2014 году; это — YSLV5 с длиной генома 29 767 п. о. и 32 ORF, YSLV6 (24 837 п. о. и 29 ORF) и YSLV7 (23 193 п. о. и 26 ORF). У вирофага YSLV5 GC-состав равен 51,1 % (что намного выше, чем у других вирофагов группы), у YSLV6 — 26,8 %, у YSLV7 — 27,3 % .
Геном вирофага, паразитирующего на вирусе Phaeocystis globosa virus (PgV), был обнаружен в 2013 году при метагеномном анализе прибрежных вод Нидерландов в ходе сборки цепочки PgV-16T генома вируса PgV. В геноме этого вирофага ( Phaeocystis globosa virus-associated virophage , PgVV) были предсказаны 16 ORF, большинство из которых не гомологичны каким-либо из известных последовательностей. Три ORF, кодирующие эндонуклеазу, предполагаемую ДНК-полимеразу и праймазу, гомологичны генам мавируса, ещё одна ORF гомологична гену OLV. Возможно, что данный вирофаг утратил структурные гены, потому что в заражённых клетках гаптофитовой водоросли Phaeocystis globosa обнаруживаются только вирусные частицы вируса-хозяина (PgV). Было высказано предположение, что вирофаг PgVV существует в виде линейной плазмиды или провирофага, интегрированного в геном вируса-хозяина .
В 2013 году была опубликована почти полная геномная последовательность вирофага, получившего название мавирус Эйс-Лейк ( англ. Ace Lake Mavirus , ALM). Она была получена из пробы воды озера Эйс-Лейк в Антарктике. Длина генома этого вирофага составляет 17 767 п. о., он имеет невысокий GC-состав (26,7 %) и содержит 22 ORF, 14 из которых имеют гомологов среди ORF мавируса .
В 2015 году были опубликованы данные о присутствии генома вирофага, похожего на Замилон, в непроветриваемом биореакторе . Новый вирофаг получил название Замилон 2. В том же году появилась информация о присутствии нуклеотидных последовательностей , похожих на последовательности вирофагов, в пищеварительном тракте животных, в том числе человека .
В том же году было обнаружено, что в ядерном геноме хлорарахниофитовой водоросли имеются активно транскрибируемые вставки, соответствующие геномам вирофагов. Кроме того, в геноме этой водоросли имеются последовательности, произошедшие от вирусов порядка Megavirales , а также повторяющиеся элементы, похожие на трансповироны. Возможно, эта водоросль приобрела вставки в виде вирофагов в качестве молекулярного оружия против вирусов .
В 2016 году новая группа вирофагов была обнаружена при анализе вод искусственного озера Дишуй в Шанхае ( Китай ). Была получена полная геномная последовательность вирофага Dishui Lake virophage (DSLV1). Его геном представляет собой кольцевую двуцепочечную ДНК длиной 28 788 п. о. с GC-составом 43,2 % и 28 ORF. В этих же образцах были выявлены последовательности вирофагов, родственных OLV и вирофагам группы YSLV . В том же году новый вирофаг был описан при изучении планктонного микробного сообщества горного озера Кукунор в китайской провинции Цинхай . Он получил название Qinghai Lake virophage (QLV, возможное русское название — вирофаг озера Цинхай). Геном QLV имеет длину 23 379 п. о., имеет GC-состав 33,2 % и содержит 25 ORF, из которых 7—11 ORF гомологичны генам OLV и вирофагов группы YSLV, а остальные специфичны для QLV. В тех же образцах выявлялись последовательности, близкие к последовательностям ( Phycodnaviridae ) , которые, по-видимому, являются хозяевами этого вирофага .
В 2017 году выполнена метагеномная сборка геномной последовательности вирофага Med-OCT2015-2000m, обнаруженного в 2015 году в пробах воды из Средиземного моря (первый вирофаг, найденный в глубоких морских водах). Длина его генома составила 30 521 п. о. с 35 ORF. На построенном филогенетическом дереве этот вирофаг образовал кладу с вирофагом YSLV5, хотя оба вирофага сильно различаются по GC-составу (27,7 % и 51,1 % соответственно) .
Тогда же были получены полные (или почти полные) геномные последовательности 17 новых вирофагов из озёр штата Висконсин , США: 9 из озера и 8 из озера . Предполагается, что длина полного генома у этих вирофагов лежит в диапазоне от 13,8 до 25,8 тыс. п. о., причём они содержат от 13 до 25 ORF. Полученные геномные последовательности достаточно разнообразны: на реконструированном филогенетическом дереве вирофаги из Траут-Бог-Лейк образуют 3 кластера (совместно со Sputnikvirus и вирофагами YSLV7 и YSLV5 соответственно), в то время как большинство вирофагов из озера Мендота входит в группу, представленную вирофагами OLV, QLV, DSLV1 и большей частью вирофагов группы YSLV, хотя один из них оказывается сестринской группой для Sputnikvirus и ещё один — сестринской группой для клады из Mavirus и ALM .
Большое количество последовательностей, похожих на последовательности генов, кодирующих белок капсида вирофагов, было выявлено при метагеномном анализе микробных сообществ озёр (в том числе озёр Антарктики), рек и мелких пресноводных прудов. Они также обнаруживались при метагеномном анализе активного ила, пресноводных донных отложений, пищеварительного тракта у разных животных, морских и сточных вод. Эти данные свидетельствуют о чрезвычайной распространённости и большом разнообразии вирофагов .
Существует точка зрения, что вирофагов нужно рассматривать в составе вирусов-сателлитов . Главным аргументом в пользу этой гипотезы является тот факт, что выделенные на данный момент вирофаги не могут размножаться в клетках в отсутствие вируса-хозяина. С другой стороны, вирофаги устроены значительно сложнее, чем вирусы-сателлиты, являющиеся, по сути, субвирусными агентами . Известные вирофаги выделяются в самостоятельное семейство Lavidaviridae (Lavida: LArge VIrus-Dependent or Associated virus) .
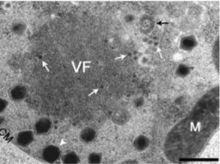
Вероятнее всего, все вирофаги обитают в вирусных фабриках гигантских вирусов, в которых происходит их транскрипция и репликация. Способы попадания вирофагов в клетку-хозяина в большинстве случаев неизвестны . Жизненный цикл и влияние на вируса-хозяина был детально изучен только у одного вирофага — Спутника. Сами по себе вирофаги не могут вызывать инфекцию у амёб , и для размножения им строго необходима вирусная фабрика вируса-хозяина. Все известные на данный момент вирофаги паразитируют на гигантских вирусах .
Предполагается, что вирионы Спутника слишком малы, чтобы амёба могла их фагоцитировать , поэтому для проникновения вирофага внутрь клетки нужен другой механизм. Незадолго до проникновения внутрь амёбы Спутник прикрепляется к фибриллам на поверхности мамавируса при помощи белка R135, и образующийся комплекс фагоцитируется амёбой. Как и следовало ожидать, разновидности мимивирусов, лишённые фибрилл, устойчивы к действию Спутника .
Через 1—2 часа после заражения в цитоплазме амёбы можно наблюдать эндоцитозные вакуоли . Далее в течение 2—4 часов происходят репликация вирусных геномов и синтез вирусных белков. Репликация Спутника и мимивируса происходит в хорошо различимых плотных зонах цитоплазмы, отличных от ядра — вирусных фабриках. На этой стадии увидеть или выделить частицы вирофага ещё невозможно .
Образование вирионов вирофага начинается на одном из полюсов вирусной фабрики, до образования вирионов мимивируса. В редких случаях в заражённых клетках удаётся наблюдать вирусные фабрики, занимающиеся производством только частиц вирофага и только частиц мимивируса. Через 16 часов после заражения амёба полностью наполнена частицами Спутника и мимивируса; вирионы могут свободно располагаться в цитоплазме или накапливаться в вакуолях амёбы. Через сутки после заражения более двух третей заражённых амёб подвергаются лизису , высвобождая наружу новосинтезированные частицы вирофага и мимивируса .
В отличие от Спутника, который может паразитировать на самых разных мимивирусах, вирофаг Замилон, описанный в 2014 году, может размножаться только в присутствии мимивирусов групп В и С (характерными представителями которых являются соответственно Moumouvirus и Megavirus chiliensis ): мимивирусы группы А (куда входят Mimivirus и Mamavirus ) к нему устойчивы. В частности, вирофаг ( Mavirus ) размножается внутри морского жгутиконосца только в присутствии входящего в семейство Mimiviridae гигантского вируса (CroV). В отличие от Спутника, эндоцитоз мавируса происходит независимо от эндоцитоза CroV (вероятно, при помощи клатрин -опосредованного эндоцитоза) .
Было показано, что репликация вирофага замилон значительно усиливалась после сайленсинга трёх генов мимивируса: R349 ( убиквитинлигаза , имеющая домен ), R350 ( АТФ -связывающий белок с хеликазной активностью) и R354 ( с нуклеазной активностью). В нормальных условиях замилон не может использовать вирусные фабрики мимивируса для размножения, вероятно, за счёт активности защитной системы мимивируса, известной как MIMIVIRE (см. . Было установлено, что геном вирофага мавирус может интегрироваться в геном клетки-хозяина. Инфекция , вызванная CroV, активирует мавирус, и после лизиса клетки наружу выходят и вирионы CroV, и вирионы мавируса .
В 2017 году был проведён анализ протеомов нескольких вирофагов, заключающийся в поиске мотивов с известными функциями в белках вирофагов. Сходство белкового состава протеомов двух вирофагов оценивалось с помощью . Например, оказалось, что в наибольшей степени функционально схожи протеомы вирофагов YLV5 и DSLV, поэтому, вероятно, эти вирофаги запускают одни и те же сигнальные каскады в клетке-хозяине. Также, вероятно, схожий клеточный ответ вызывают вирофаги OLV и YLV6, а также замилон и QLV. Наиболее сильные функциональные значения наблюдались между протеомами Спутника 2 и Спутника 3. Предполагается, что схожие последовательности в геномах разных вирофагов происходят от общего предка или из геномов близкородственных хозяев (из-за горизонтального переноса генов ) .
Поиск функциональных мотивов показал, что около 70 % белков вирофага замилон имеют SUMO -связывающий мотив, в то время как у Спутника этот мотив имеется у примерно 38 % белков. Поскольку ковалентное присоединение белка SUMO является одной из самых распространённых посттрансляционных модификаций , предполагается, что ключевую роль в репликации замилона играют именно посттрансляционные модификации. Вероятно, посттрансляционные модификации, а также фибриллы капсида мимивируса играют ключевую роль в подавлении размножения Спутника. Если нокаутировать гены, кодирующие белки фибрилл, то начинается активное размножение вирофага. Кроме того, в белках Спутника и мавируса найдены мотивы (от англ. Immunoreceptor tyrosine-based activation motifs — иммунорецепторные активирующие тирозинзависимые мотивы), а в белках замилона, PgVV и QLV они не были обнаружены. Мотивы ITAM имеются в белках ряда вирусов и связаны с избеганием иммунного ответа , подавлением апоптоза и злокачественной трансформацией некоторых клеток. Ни один из белков PgVV не содержит сигнал ядерной локализации ( англ. nuclear localization signal, NLS), а у замилона NLS имеет лишь один белок. Возможно, вирофаги используют альтернативные пути для попадания в ядро , а PgVV, вероятно, размножается только в цитоплазматической вирусной фабрике .
Вирофаги демонстрируют заметное сходство с особой группой мобильных элементов — полинтонами . Полинтоны представляют собой необычную группу мобильных элементов, поскольку они могут удваиваться с помощью собственных полимеразы и интегразы (отсюда название: POLymerase-INTegrase-ON). Полинтоны и вирофаги представлены ДНК, имеют схожий размер и ряд генов общего происхождения: большой и малый белок капсида, АТФазу, служащую для упаковки ДНК в капсид, и протеазу, задействованную в созревании вирионов. Впрочем, белки капсида вирофагов и полинтонов значительно отличаются. Часть сходств полинтонов и вирофагов можно объяснить горизонтальным переносом генов и конвергентной эволюцией , однако данные филогенетических и геномных исследований убедительно свидетельствуют об общности их происхождения .
Вопрос о том, каков был общий предок полинтонов и вирофагов — был это мобильный элемент, похожий на современные полинтоны, или же он был вирусом — окончательно не решён. Согласно одной из гипотез, вирофаги представляют собой потомков «сбежавших» полинтонов. Против этой гипотезы свидетельствует тот факт, что для размножения вирофагов необходимы гигантские вирусы, а для размножения полинтонов — нет, и вряд ли это свойство было приобретено вирофагами с нуля. Стоит отметить, что вирофаг Мавирус разделяет с полинтонами семь генов, а с другими вирофагами — всего три и потому стоит ближе к полинтонам, чем к другим вирофагам. Этот факт говорит в пользу того, что существовал поток генов от вирусов к мобильным элементам, и общим предком вирофагов и полинтонов был именно вирус. Известно несколько примеров встраивания вирофагов в геномы вирусов-хозяев и заражаемых клеток, поэтому возможно, что полинтоны произошли от интегрированных в клеточный геном вирофагов. Предполагается существование гипотетической группы вирусов — полинтовирусов, — которые дали начало не только полинтонам и вирофагам, но также крупным ядерно-цитоплазматическим ДНК-содержащим вирусам , и аденовирусам . Полинтовирусы, в свою очередь, могли произойти от вирусов семейства — бактериофагов , поражающих грамотрицательные бактерии , которые попали в клетки эукариот вместе с приобретением митохондрий . Тективирусы приобрели цистеиновую протеазу и интегразу от уже существовавших транспозонов и стали полинтовирусами, а полинтовирусы, утратившие способность формировать капсиды, дали начало полинтонам. Впрочем, полинтовирусы пока обнаружить не удалось . Стоит отметить, что более широкое распространение полинтонов в природе (они встречаются у различных групп эукариот , в то время как вирофаги обнаружены только в клетках протистов), их большее генетическое разнообразие и длительная коэволюция с эукариотами свидетельствует о том, что, возможно, вирофаги произошли от полинтонов, но не наоборот . Таким образом, вопрос происхождения вирофагов остаётся нерешённым.
Взаимосвязи вирофагов с другими мобильными элементами можно проиллюстрировать кладограммой , построенной на основании последовательностей ДНК-полимеразы .
|
||||||||||||||||||||||||||||||||||
Открытие новых вирофагов позволило в 2016 году провести новое исследование филогении вирофагов, уточнившее результаты анализа 2013 года. Согласно данному исследованию, подтверждается монофилия рода Sputnikvirus , а в целом филогенетические взаимоотношения между исследованными представителями семейства Lavidaviridae могут быть представлены следующей кладограммой :
| Lavidaviridae |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В 2016 году появилось сообщение об обнаружении у мимивирусов группы А механизма, ответственного за устойчивость к вирофагу замилон. Ключевым элементом этого механизма является генетическая система MIMIvirus VIrophage Resistant Element (MIMIVIRE), содержащая несколько вставок, соответствующих последовательностям из генома замилона. Было высказано предположение, что система на основе MIMIVIRE функционирует подобно системам CRISPR /Cas, обеспечивающим защиту от вирусов у бактерий и архей: со вставок в геноме мимивируса синтезируются РНК , которые комплементарно связываются с геномами вирофага, приводя к их уничтожению . В пользу этого вывода говорят данные экспериментов по отключению MIMIVIRE. Однако у этой гипотезы существует ряд проблем. Неясно, например, каким образом система MIMIVIRE отличает вставки из генома вирофага в геном мимивируса от таких же последовательностей в геноме вирофага и избегает разрушения генома самого мимивируса. Предложен альтернативный механизм работы MIMIVIRE, в основе которого лежат не комплементарные взаимодействия нуклеиновых кислот, а белок-белковые взаимодействия .
Известен ряд случаев, когда вирофаги интегрировались в геном гигантского вируса или клетки протиста-хозяина. Например, геном Спутника 2 может быть интегрирован в геном мимивируса. Как упоминалось выше, несколько вставок, произошедших от вирофагов, имеется в геноме хлорарахниофитовой водоросли Bigelowiella natans . При коинфекции морского жгутиконосца Cafeteria roenbergensis вирусом CroV и вирофагом мавирус примерно в 30 % заражённых клеток геном вирофага вставляется в геном протиста . Если выжившие после инфекции клетки со вставленным геномом мавируса вновь подвергнуть инфекции CroV, то происходит индукция размножения вирофага и экспрессии его генов, в частности, за счёт активации транскрипции вставок мавируса при помощи транскрипционного фактора , кодируемого CroV. В конце концов происходит образование частиц вирофага, однако, что любопытно, размножение вирофага не оказывает значительного воздействия на размножение CroV. Впрочем, в итоге клетка всё же умирает, что не даёт CroV размножаться в ней дальше. Механизм защиты от инфекции CroV, опосредованный мавирусом, можно истолковать как форму адаптивного иммунитета , при котором память о предыдущих инфекциях сохраняется в форме вставок в геноме клетки. Эта идея напоминает принцип работы адаптивного иммунитета бактерий и архей — системы CRISPR/Cas .
В течение нескольких лет, прошедших с момента открытия первых вирофагов, вирусы данной группы были при помощи метагеномики обнаружены в различных местообитаниях, от глубоководий до суши, и в самых разных частях земного шара. Вирофагов обнаруживают в пресной воде и донных отложениях чаще, чем в образцах воды из глубоководных областей. Кроме того, вирофаги были найдены в почве, льде и воздухе. Вирофаги активно взаимодействуют с другими микроорганизмами и даже могут влиять на их рост; например, Спутник может контролировать не только популяцию амёб, но и рост бактерий , регулируя вирулентность своих вирусов-хозяев. Влияя на динамику популяций гигантских вирусов и их эукариотических хозяев, вирофаги могут оказывать значительное влияние на разнообразные экосистемы .
Связь вирофагов с человеком пока не вполне ясна. В образцах фекалий и лёгочной ткани человека были обнаружены гигантские вирусы; помимо этого, гигантские вирусы могут поражать амёб, населяющих пищеварительный тракт человека, и в фекальных образцах действительно были выявлены последовательности, соответствующие вирофагам. Кроме того, вирофаг Спутник 2 был выделен из жидкости для контактных линз. Антитела к вирофагу Спутник были обнаружены у двух пациентов, страдающих от лихорадки, и у одного из них наблюдалась . Данные о потенциальной патогенности вирофагов для человека отсутствуют .