Interested Article - Y-РНК
- 2020-03-27
- 1
Y-РНК — малые некодирующие РНК , входят в состав рибонуклеопротеинов , содержащих белки и , которые являются мишенью аутоантител у пациентов, страдающих системной красной волчанкой и синдромом Шегрена . Они также необходимы для репликации ДНК , так как взаимодействуют с хроматином и инициаторными белками .
Y-РНК впервые были описаны в 1981 году. Они были выявлены в цитоплазме клеток млекопитающих ( человека , мыши и мартышки ), в связи с чем получили название Y-РНК от c y toplasmic в противовес ядерным РНК (U-РНК от n u clear) .
Гены
Y-РНК удалось обнаружить у всех исследованных позвоночных , причём у каждого вида есть от одного до четырёх генов Y-РНК, что свидетельствует о дупликациях и делециях этих генов в ходе эволюции позвоночных. У человека насчитываются четыре вида Y-РНК: hY1, hY3, hY4 и hY5. Ранее в их число также включали hY2, однако впоследствии оказалось, что это не отдельный вид Y-РНК, а продукт разрушения РНК hY1. Все 4 гена Y-РНК у человека образуют единый кластер на 7-й хромосоме в локусе 7q36, у других позвоночных они тоже сгруппированы в кластер. Самой древней среди Y-РНК позвоночных, по-видимому, является Y3 . Каждый ген Y-РНК транскрибируется РНК-полимеразой III с собственного промотора . Было показано, что малые некодирующие РНК нематод , известные как (от англ. stem-bulge — стебельчато-выпуклые), по структуре и функциям гомологичны Y-РНК позвоночных. При этом у нематоды Caenorhabditis elegans есть и одна собственно Y-РНК — CeY-РНК . Малые некодирующие РНК, похожие на Y-РНК позвоночных или sbРНК нематод, были обнаружены у многих других эукариот , например, у протиста Chlamydomonas reinhardtii , у насекомых и Bombyx mori , а также ланцетника Branchiostoma floridae . Сходные РНК имеются и у прокариот , в числе которых Deinococcus radiodurans , Salmonella enterica serovar Typhimurium , Mycobacterium smegmatis и другие. Однако эти бактериальные РНК всё же значительно отличаются от Y-РНК позвоночных и не гомологичны им .
Структура
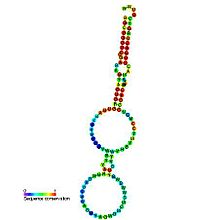
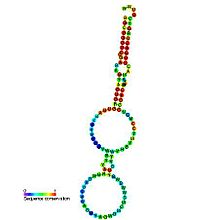
Молекулы Y-РНК состоят из 80—120 нуклеотидов и имеют характерную шпилечную вторичную структуру . 5'- и 3'-конец каждой молекулы Y-РНК гибридизуются с образованием двух двуцепочечных стеблевых участков, разделённых небольшой внутренней петлёй. Самая длинная петля — у hY1, самая короткая — у hY5. Нуклеотидные последовательности нижнего и верхнего стеблей высококонсервативны , в то время как последовательности внутренней петли сильно различаются у разных Y-РНК. Нижний стебель несёт консервативно выпяченный остаток цитозина , который является ключевым остатком, участвующим в связывании с белком Ro60 . Именно петля взаимодействует с разнообразными белками, в числе которых нуклеолин , PTB и . Показано, что стабильность и процессинг 3'-концов Y-РНК зависят от экзорибонуклеазы . Все четыре человеческие Y-РНК взаимодействуют с антивирусной , которая также входит в состав рибонуклеопротеинов, содержащих Ro60 и La. Возможно, APOBEC3G осуществляет редактирование Y-РНК. Петлевой домен также задействован во взаимодействии Y-РНК с ядерными хроматиновыми доменами. hY5 взаимодействует с особым набором белков, что указывает на её функции, отличные от прочих Y-РНК — она, например, взаимодействует с и IFIT5. Кроме того, hY5 взаимодействует с 5S рРНК , преимущественно в неуложенном виде .
Функции

Первоначально Y-РНК были описаны как некодирующие РНК, связывающиеся с белком Ro60, который является антигеном , распознаваемым антителами из крови пациентов с системной красной волчанкой и синдромом Шегрена . Ro60 у позвоночных консервативен, его гомологи были выявлены у большинства Metazoa , а также в 5 % бактериальных геномов (среди которых геномы D. radiodurans и Salmonella ). У всех этих организмов гомологи Ro60 связываются с Y-РНК или подобными им РНК с образованием рибонуклеопротеинов. У позвоночных Ro60 взаимодействует с нижним стеблевым доменом Y-РНК. С частью рибонуклеопротеинов, состоящих из Ro60 и Y-РНК (RoRNP), связывается белок La. Он необходим для правильной терминации транскрипции, опосредованной РНК-полимеразой III, и связывается с 3'-концевым хвостом новосинтезированных РНК в ядре. Большинство РНК впоследствии утрачивают полиуридиновый хвост, но Y-РНК его сохраняют и продолжают взаимодействовать с La. Он участвует в накоплении Y-РНК в ядре и защищает их от разрушения экзонуклеазами .
RoRNP участвуют в контроле качества некодирующих РНК, регулируют стабильность РНК и у некоторых видов участвуют в клеточном ответе на стресс. У многих видов, в числе которых лягушка Xenopus laevis , нематода C. elegans и домовая мышь , Ro60 связывается с такими дефектными некодирующими РНК, как неправильно уложенные 5S рРНК и . Нематоды, лишённые гомолога Ro60, жизнеспособны, однако у них нарушается процесс формирования особой личинки, предназначенной для перенесения неблагоприятных условий. Под действием УФ-излучения в клетках мыши и D. radiodurans происходит накопление RoRNP, и в отсутствие Ro60 их устойчивость к УФ-излучению понижается. У D. radiodurans ортолог Ro60 участвует в созревании рРНК , экспрессия которых была индуцирована тепловым стрессом, и разрушении рРНК, вызванном голоданием. Связывание Ro60 с неправильно уложенными некодирующими РНК неспецифично в отношении последовательности, и, по-видимому, этот белок может связываться с самыми разными РНК. По этой причине RoRNP можно рассматривать как внутриклеточные сенсоры стресса. В отсутствие Ro60 уровень Y-РНК в клетках как эукариот, так и прокариот снижался, из чего, вероятно, следует, что Ro60 стабилизирует Y-РНК, с которыми он взаимодействует .
Y-РНК участвует в инициации репликации хромосомной ДНК , а именно в формировании новых репликативных вилок. Однако они не нужны для элонгации и репликации и самого процесса удвоения ДНК как такового. Y-РНК вовлечены в инициацию репликации ДНК не сами по себе, а посредством белков. Для участия в инициации репликации ДНК необходим верхний стебель Y-РНК, но не участки связывания с белками Ro60 и La и не сами эти белки. Фактически около половины Y-РНК в человеческих клетках существует вне комплексов с белками Ro60 и La. Нарушение работы Y-РНК с помощью РНК-интерференции блокирует репликацию ДНК и пролиферацию клеток млекопитающих. При этом нормальный фенотип возвращается при введении в такие клетки короткой двуцепочечной РНК, соответствующей верхнему стеблю РНК hY1. Инактивация Y-РНК с помощью морфолиновых олигонуклеотидов в эмбрионах X. laevis и рыбы Danio rerio приводит к остановке развития и гибели на ранних этапах эмбриогенеза . В человеческих опухолях , напротив, наблюдается сверхэкспрессия Y-РНК по сравнению с нормальными тканями . Последовательности верхних стеблей Y-РНК таких организмов, как C. elegans , B. floridae и D. radiodurans , сильно отличаются от последовательностей позвоночных, и эти Y-РНК не могут функционально заменить Y-РНК в клетках человека .
Конкретный механизм участия Y-РНК в инициации репликации ДНК неизвестен. Известно, однако, что Y-РНК взаимодействует с несколькими белками, вовлечёнными в инициацию репликации ДНК, в числе которых репликации ORC, а также , и DUE-B, но не взаимодействует с белками репликативной вилки. С помощью Y-РНК удалось показать, что у человека Y-РНК динамически взаимодействуют с нереплицированным хроматином в G1-фазе клеточного цикла , колокализуясь с несколькими белками инициации репликации ДНК. После того как репликация началась, Y-РНК вытесняются из места начала репликации и не выявляются в местах активного синтеза ДНК .
Локализация
У эукариот биогенез Y-РНК начинается в ядре, но в дальнейшем Y-РНК могут выйти в цитоплазму, как другие транскрипты РНК-полимеразы III (тРНК и пре-микроРНК), или же остаться в ядре, как малые ядерные РНК . Экспериментальные данные об относительном распределении Y-РНК между ядром и цитоплазмой противоречивы, возможно, из-за используемых методик. Первоначальные эксперименты с показали, что в клетках млекопитающих в культуре и ооцитах X. laevis Y-РНК локализованы преимущественно или даже исключительно в цитоплазме. Далее было показано, что hY1, hY3 и hY4 (и соответствующие мышиные гомологи) находятся в цитоплазме, а hY5 накапливается в ядре. и электронная микроскопия показали, однако, что Y-РНК образуют дискретные кластеры как в ядре, так и в цитоплазме в клетках человека в культуре. В пролиферирующих человеческих клетках hY1, hY3 и hY5 также выявляются на краю ядрышка (в околоядрышковом компартменте ). Использование флуоресцентно-меченных Y-РНК показало, что все четыре человеческие Y-РНК динамически связываются с хроматином в переходе из G1-фазы в S-фазу . При этом hY1, hY3 и hY4 локализуются вместе и связаны преимущественно с эухроматином на ранних этапах репликации, а hY5 накапливается в ядрышке. В связи с тем, что hY5 взаимодействует с 5S рРНК и локализуется в ядрышке, можно предположить, что она участвует в биогенезе рибосом . Таким образом, вероятнее всего, Y-РНК присутствуют как в ядре, так и в цитоплазме эукариотических клеток, а их относительное преобладание в одном из компартментов связано с методологией эксперимента .
Экспорт Y-РНК из ядра происходит при участии ГТФазы , поэтому в роли транспортных рецепторов для Y-РНК, вероятнее всего, выступают . Нижний стебель Y-РНК очень похож на структуру других РНК-субстратов экспортина-5, и было показано, что связывается с комплексом hY1 и Ran/ГТФ. Делеция нижнего стебля hY1 вызывает нарушения в её экспорте из ядра. Механизм обратного поступления Y-РНК в ядро неизвестен .
Было высказано предположение, что в клетках млекопитающих Y-РНК регулирует внутриклеточную локализацию Ro60. Этот белок выявляется и в ядре, и в цитоплазме, и было показано, что Y-РНК может влиять на его локализацию. В клетках мыши связывание Y-РНК с Ro60 приводит к тому, что его сигнал ядерной локализации оказывается скрыт в глубине комплекса, из-за чего RoRNP остаётся в цитоплазме .
Внутриклеточная локализация Y-РНК меняется в условиях стресса. У некоторых видов после окислительного стресса или воздействия УФ-излучения и Ro60, и Y-РНК накапливаются в ядре, что согласуется с предполагаемой ролью RoRNP в клеточном ответе на стресс. Возможно также, что в условиях стресса нарушается работа ГТФазы Ran, что приводит к накоплению комплексов в ядре .
У млекопитающих Y-РНК могут быть селективно упакованы в вирусные частицы. Подобный эффект был показан для ВИЧ -1 и вируса мышиной лейкемии Moloney. Для упаковки в вирионы не нужен Ro60, и, вероятно, это происходит на ранних этапах биогенеза Y-РНК, когда она ещё не успевает покинуть ядро. Роль Y-РНК в вирусной инфекции неизвестна .
С помощью нозерн-блоттинга была проанализирована экспрессия Y-РНК в различных тканях взрослых мышей. Базальный уровень экспрессии mY1 и mY3 наблюдался во всех тканях. Наибольшие уровни Y-РНК наблюдались в мозге, лёгких, сердце, желудке, почках, яичниках, жировой и мышечной тканях , а наименьшие — в печени, кишечнике, селезёнке, коже и крови. При этом паттерн экспрессии Y-РНК был похож на таковой у Ro60 .
Производные Y-РНК
Секвенирование тотальной РНК , выделенной из эукариотических клеток, показало, что в клетках в состоянии апоптоза накапливается много малых РНК, представляющих собой «обломки» Y-РНК. Тем не менее, эти малые РНК связываются с Ro60 и La, поэтому, видимо, участки связывания с этими белками в нижнем стебле защищены от разрушения. Вероятно, основной мишенью разрушения при апоптозе является верхний стебель, который участвует в инициации репликации ДНК. Производные Y-РНК также выявляются в пролиферирующих клетках, как раковых, так и нераковых, в мозге, сетчатке и других здоровых тканях млекопитающих, а также в разнообразных опухолях. Некоторые из них были первоначально ошибочно идентифицированы как новый тип микроРНК , образующийся при процессинге полноразмерных Y-РНК. Однако впоследствии было показано, что малые РНК образуются из Y-РНК не так, как микроРНК. Более того, производные Y-РНК, в отличие от микроРНК, не участвуют в сайленсинге генов. Было показано, что в крови человека и других животных циркулирует большое количество производных Y-РНК, как в составе везикул , так и в виде свободных рибонуклеопротеинов. Уровень РНК, образованных из 3'- и 5'-концов Y-РНК, а также из 5'-конца тРНК , значительно выше в крови пациентов, страдающих от рака груди , по сравнению со здоровыми людьми, поэтому эти РНК могут иметь диагностическое значение как биомаркеры рака . Полноразмерные Y-РНК и производные Y-РНК были выявлены в везикулах, образованных мышиными иммунными клетками , кроме того, производные Y-РНК составляют весомую долю РНК-компонента экзосом в человеческой сперме . Фрагмент Y-РНК, известный как EV-YF1, в составе экзосом, вероятно, можно использовать для минимизации отрицательных эффектов на сердце и почки, вызванных инфузиями ангиотензина II . Фрагмент Y-РНК, известный как 5'-YsRNA, возможно, может служить биомаркером синдрома Шегрена . Функции производных Y-РНК неизвестны, но, возможно, они участвуют в передаче сигнала между клетками .
Бактериальные Y-РНК
Лучше всего Y-РНК изучены у бактерии Deinococcus radiodurans . У этой бактерии почти все функции Y-РНК так или иначе связаны с гомологом Ro60, известным как Rsr. Например, Y-РНК обеспечивает взаимодействие Rsr с экзорибонуклеазой . Y-РНК и Rsr опосредуют клеточный ответ на воздействие УФ-излучения. У Salmonella enterica serovar Typhimurium Y-РНК также тесно взаимодействуют с Rsr. Поиск гомологов Y-РНК Salmonella показал, что Y-РНК очень широко распространены среди бактерий, а также кодируются геномами некоторых бактериофагов . Некоторые бактериальные Y-РНК даже демонстрируют структурное сходство с тРНК. Широкое распространение Y-РНК среди неродственных бактерий говорит о том, что у большинства видов гены Y-РНК были приобретены при помощи горизонтального переноса генов .
Клиническое значение
Чрезмерная экспрессия Y-РНК характерна для некоторых человеческих опухолей и необходима для клеточной пролиферации . Кроме того, небольшие фрагменты размером с микроРНК, образующиеся при распаде Y-РНК, могут играть некоторую роль в развитии аутоиммунных заболеваний и некоторых других патологических состояний .
Примечания
- Hall A. E. , Turnbull C. , Dalmay T. (англ.) // Biomolecular concepts. — 2013. — Vol. 4, no. 2 . — P. 103—110. — doi : . — .
- Lerner M. R. , Boyle J. A. , Hardin J. A. , Steitz J. A. (англ.) // Science (New York, N.Y.). — 1981. — Vol. 211, no. 4480 . — P. 400—402. — .
- ↑ Kowalski M. P. , Krude T. (англ.) // The International Journal Of Biochemistry & Cell Biology. — 2015. — September ( vol. 66 ). — P. 20—29 . — doi : . — .
- Christov C. P. , Gardiner T. J. , Szüts D. , Krude T. (англ.) // Molecular and cellular biology. — 2006. — Vol. 26, no. 18 . — P. 6993—7004. — doi : . — .
- Zhang A. T. , Langley A. R. , Christov C. P. , Kheir E. , Shafee T. , Gardiner T. J. , Krude T. (англ.) // Journal of cell science. — 2011. — Vol. 124, no. Pt 12 . — P. 2058—2069. — doi : . — .
- ↑ Köhn M. , Pazaitis N. , Hüttelmaier S. (англ.) // Biomolecules. — 2013. — Vol. 3, no. 1 . — P. 143—156. — doi : . — .
- Van Horn D. J. , Eisenberg D. , O'Brien C. A. , Wolin S. L. (англ.) // RNA (New York, N.Y.). — 1995. — Vol. 1, no. 3 . — P. 293—303. — .
- Boria I. , Gruber A. R. , Tanzer A. , Bernhart S. H. , Lorenz R. , Mueller M. M. , Hofacker I. L. , Stadler P. F. (англ.) // Journal of molecular evolution. — 2010. — Vol. 70, no. 4 . — P. 346—358. — doi : . — .
- Shukla S. , Parker R. (англ.) // Molecular And Cellular Biology. — 2017. — 15 October ( vol. 37 , no. 20 ). — doi : . — .
- Stein A. J. , Fuchs G. , Fu C. , Wolin S. L. , Reinisch K. M. (англ.) // Cell. — 2005. — Vol. 121, no. 4 . — P. 529—539. — doi : . — .
- Cambier L. , Giani J. F. , Liu W. , Ijichi T. , Echavez A. K. , Valle J. , Marbán E. (англ.) // Hypertension (Dallas, Tex. : 1979). — 2018. — August ( vol. 72 , no. 2 ). — P. 370—380 . — doi : . — .
- Kabeerdoss J. , Sandhya P. , Danda D. (англ.) // International Journal Of Rheumatic Diseases. — 2017. — November ( vol. 20 , no. 11 ). — P. 1763—1766 . — doi : . — .
- Sim S. , Wolin S. L. (англ.) // Microbiology Spectrum. — 2018. — July ( vol. 6 , no. 4 ). — doi : . — .
- Christov C. P. , Trivier E. , Krude T. (англ.) // British journal of cancer. — 2008. — Vol. 98, no. 5 . — P. 981—988. — doi : . — .
- Verhagen A. P. , Pruijn G. J. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2011. — Vol. 33, no. 9 . — P. 674—682. — doi : . — .
Ссылки
- .
- . Дата обращения: 2 февраля 2015. Архивировано из 14 мая 2015 года.
- . Дата обращения: 2 февраля 2015. Архивировано из 21 декабря 2014 года.
- 2020-03-27
- 1


















