Interested Article - Топоизомеразы

- 2021-05-20
- 2

Топоизомера́зы ( англ. topoisomerase ) — класс ферментов - изомераз , которые влияют на топологию ДНК . Топоизомеразы способны релаксировать сверхспирализованные молекулы ДНК путём внесения одно- или двуцепочечных разрывов с последующим восстановлением (лигированием) . Вместе с тем в некоторых случаях топоизомеразы могут вносить в ДНК отрицательные супервитки или катенаны .
Впервые топоизомеразы были описаны профессором Гарвардского университета Джеймсом Вонгом .
Топоизомеразы, облегчая расплетание цепей ДНК в двойной спирали, играют важную роль в процессах репликации и транскрипции . Показана роль топоизомераз в образовании петель хроматина во время конденсации хромосом . Встраивание вирусной ДНК в хромосомы хозяина и другие формы рекомбинации также требуют присутствия топоизомераз .
Классификация
В зависимости от механизма действия топоизомеразы подразделяют на топоизомеразы I типа, вносящие одноцепочечные разрывы без затрат энергии, и топоизомеразы II типа, осуществляющие внесение двуцепочечных разрывов с затратой АТФ . Особое место среди топоизомераз занимает ДНК-гираза , характерная для кишечной палочки E. coli .
В следующей таблице перечислены основные особенности различных типов топоизомераз:
| Топоизомеразы | IA | IB | IIA | IIB |
|---|---|---|---|---|
| Необходимость ионов металлов | Да | Нет | Да | Да |
| Зависимость от АТФ | Нет | Нет | Да | Да |
| Разрыв | оц | оц | дц | дц |
| Конец прикрепления | 5' | 3' | 5' | 5' |
| Изменение числа супервитков | ±1 | ±1 | ±2 | ±2 |
Топоизомеразы I

( КФ ) представляют собой мономерные белки . Они релаксируют ДНК, внося одноцепочечные разрывы без затрат АТФ. Механизм этого таков. Внесение одноцепочечных разрывов происходит за счёт остатка аминокислоты тирозина , который осуществляет нуклеофильную атаку фосфатной группы ДНК, образуя фосфотирозин . Сам фермент при этом связывается с высвободившимся 3'- или 5'-концом цепи. В зависимости от того, к какому концу присоединяется топоизомераза, выделяют:
- топоизомеразы IA-типа , связывающиеся с 5'-концом; снимают только отрицательную суперспирализацию;
- топоизомеразы IB-типа , связывающиеся с 3'-концом ; снимают как положительную, так и отрицательную суперспирализацию .
Такой механизм действия не требует затрат энергии, то есть при работе топоизомераз I типа АТФ не расходуется . Число витков при этом изменяется на 1 .
Первая топоизомераза I типа, как уже отмечалось, была выделена в клетках E. coli . В 1972 году топоизомеразы этого типа были обнаружены в клетках млекопитающего , впоследствии — в дрожжевых клетках. Топоизомеразы I типа известны у архей, например, IA-топоизомераза термофильной археи , а также у некоторых вирусов, например, вируса оспы .
Топоизомеразы II

( КФ ) функционируют у прокариот в виде тетрамеров, у эукариот — в виде димеров . Они осуществляют АТФ-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием. Разрыв происходит из-за связывания тирозинов топоизомеразы с ДНК с образованием двух 5'- . В образовавшийся разрыв проходит другая двуцепочечная ДНК. Таким образом, число положительных или отрицательных супервитков изменяется на 2 (а не на 1, как у топоизомераз I). Итак, топоизомеразы II могут катенировать и декатенировать узлы ДНК. Относящаяся к этому типу ДНК-гираза вносит отрицательные супервитки .
Топоизомеразы II, как и топоизомеразы I, подразделяют на 2 группы: IIA и IIB . Однако анализ структур топоизомераз IА, IIА и IIB выявил их большое структурное сходство, в частности, наличие специального фолда для связывания с ионами металлов .
Разнообразие топоизомераз
В следующей таблице кратко характеризованы топоизомеразы из различных классов, выделенные из различных организмов .
| Топоизомераза | Тип | Организм | Размер (кДа) и строение субъединицы | Особенности |
|---|---|---|---|---|
| Бактериальная топоизомераза I (ω-белок) | IA | Бактерии (в т. ч. E. coli ) | 97; мономер | Неспособна релаксировать положительные супервитки |
| Эукариотическая топоизомераза I | IB | Эукариоты (в т. ч. человек) | 91; мономер | Может релаксировать как положительные, так и отрицательные супервитки |
| Топоизомераза I вируса коровьей оспы | IB | Вирус коровьей оспы | 37; мономер | АТФ стимулирует активность фермента |
| Топоизомераза III | IA | Бактерии (в т. ч. E. coli ) | 73; мономер | Имеет сильную декатенирующую активность |
| Обратная гираза | IA | Термофильные археи (в т. ч. | 143; мономер | Может АТФ-зависимо вносить положительные супервитки в ДНК |
| ДНК-гираза | IIA | Бактерии (в т. ч. E. coli ), некоторые низшие эукариоты | 97 и 99 A 2 B 2 | Может АТФ-зависимо вносить отрицательные супервитки в ДНК |
| Т4-топоизомераза | IIA | Фаг Т4 | 58, 51 и 18; 2 копии каждой субъединицы | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
| Эукариотическая топоизомераза II | IIA | Эукариоты (в т. ч. человек) | 174; гомодимер | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
| Топоизомераза IV | IIA | Бактерии (в т. ч. E. coli ) | 84 и 70 C 2 E 2 | Релаксирует ДНК, но не суперспирализует, сильная декатеназа (АТФ-зависимая) |
| Топоизомераза VI | IIB | Археи (в т. ч. ) | 45 и 60 A 2 B 2 | Релаксирует ДНК, но не суперспирализует (АТФ-зависимо) |
Медицинское значение

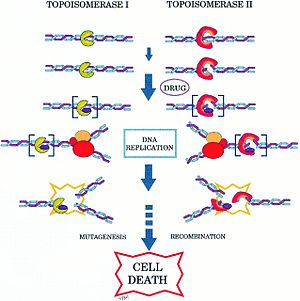
Топоизомеразы играют важную роль в процессах роста и деления клетки , в связи с чем они нередко являются мишенями различных лекарств — .
Так, ДНК-гираза и близкая к ней топоизомераза IV являются мишенями двух основных групп антибактериальных препаратов: хинолонов и кумаринов . Хинолоны (в том числе налидиксовая кислота и ципрофлоксацин ) предположительно блокируют стадию разрыва и лигирования в работе гиразы. Кумарины (в их числе и ) действуют совершенно иначе: они блокируют гидролиз АТФ гиразой .
Эукариотические топоизомеразы также являются мишенями многих лекарственных препаратов, в частности, противоопухолевых . Например, противораковый препарат , производные которого широко используются в противораковой химиотерапии , действует на человеческую топоизомеразу I подобно тому, как хинолоны действуют на гиразу .
Кроме того, что топоизомеразы могут быть мишенями антибиотиков и противоопухолевых препаратов, они также могут выступать как мишени токсинов . Так, бактериальный токсин Ссdb действует на гиразу. Ссdb представляет собой небольшой белок массой 11,7 кДа. Он входит в состав токсин-антитоксиновой системы, образуя комплекс с другим белком — Ссda, и играет роль в стабилизации F-плазмиды E. coli . Утрата F-плазмиды ведёт к утрате относительно нестабильного Ссdа. В результате Ссdb высвобождается, блокирует гиразу и тем самым убивает хозяйскую клетку. Изучение механизма действия таких токсинов может дать новые идеи для разработки новых ингибиторов гиразы .
В следующей таблице приведена информация по различным ингибиторам топоизомераз :
| Ингибитор | Топоизомераза-мишень | Терапевтическое действие |
|---|---|---|
| Хинолоны (в т. ч. ципрофлоксацин ) | ДНК-гираза и топоизомераза IV | Эффективные антибактериальные средства |
| Кумарины (в т. ч. ) | ДНК-гираза и топоизомераза IV | Антибиотики , но не используются широко |
| (в т. ч. топотекан ) | Человеческая топоизомераза I | Противораковые препараты |
| (mAMSA) | Человеческая топоизомераза II | Противораковые препараты |
| Подофиллотоксины (в т. ч. тенипозид ) | Человеческая топоизомераза II | Противораковые препараты |
Примечания
- Champoux J.J. DNA topoisomerases: structure, function, and mechanism (англ.) // : journal. — 2001. — Vol. 70 . — P. 369—413 . — doi : . — .
- ↑ , с. 99.
- ↑ , с. 100.
- . National Academy of Science. Дата обращения: 7 января 2009. Архивировано из 29 декабря 2010 года.
- Жимулев И. Ф. Общая и молекулярная генетика. — 1. — Новосибирск: Издательство Новосибирского университета, 2002. — 459 с. — 2000 экз. — ISBN 5761505096 .
- ↑ Арефьев В. А., Лисовенко Л. А. ДНК-релаксирующие ферменты // Англо-русский толковый словарь генетических терминов. — М. : Изд-во ВНИРО, 1995. — ISBN 5-85382-132-6 .
- ↑ Д. В. Бугреев, Г. А. Невинский . // Успехи биологической химии. — 2009. — Т. 49 . — С. 129—158 . 21 марта 2014 года.
- , с. 99—100.
- ↑ . Дата обращения: 19 марта 2014. 19 марта 2014 года.
См. также
Литература
- James C. Wang (2009) Untangling the Double Helix. DNA Entanglement and the Action of the DNA Topoisomerases , Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2009. 245 pp. ISBN 9780879698799
- Коничев А. С., Севастьянова Г. А. Молекулярная биология. — Издательский центр «Академия», 2012. — 400 с. — ISBN 978-5-7695-9147-1 .
- 2021-05-20
- 2