Interested Article - Дезоксирибонуклеиновая кислота

- 2021-03-18
- 2


Дезоксирибонуклеи́новая кислота́ ( ДНК ) — макромолекула (одна из трёх основных, две другие — РНК и белки ), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования организмов . Молекула ДНК хранит биологическую информацию в виде генетического кода , состоящего из последовательности нуклеотидов . ДНК содержит информацию о структуре различных видов РНК и белков .
В клетках эукариот ( животных , растений и грибов ) ДНК находится в ядре клетки в составе хромосом , а также в некоторых клеточных органеллах ( митохондриях и пластидах ). В клетках прокариотических организмов ( бактерий и архей ) кольцевая или линейная молекула ДНК, так называемый нуклеоид , прикреплена изнутри к клеточной мембране . У прокариот и у низших эукариот (например дрожжей ) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами . Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов .
С химической точки зрения ДНК — длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов . Каждый нуклеотид состоит из азотистого основания , сахара ( дезоксирибозы ) и фосфатной группы . Связи между нуклеотидами в полимерной цепи образуются за счёт дезоксирибозы и фосфатной группы (фосфодиэфирные связи).
В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух нуклеотидных цепей. В нуклеотидах, входящих в состав ДНК, встречаются четыре азотистых основания: аденин (A), гуанин (G), тимин (T) и цитозин (C). Азотистые основания одной цепи соединены с азотистыми основаниями другой цепи водородными связями , обеспечивая таким образом связь двух цепей макромолекулы ДНК друг с другом. Азотистые основания образуют связи попарно согласно принципу комплементарности : аденин (A) соединяется только с тимином (T), гуанин (G) — только с цитозином (C) .
Двухцепочечная молекула ДНК закручена по винтовой линии . Структура молекулы ДНК в целом получила традиционное, но ошибочное название «двойной спирали »: на самом деле, она является «двойным винтом ». Винтовая линия может быть правой ( A- и B-формы ДНК) или левой ( Z-форма ДНК ) . Формы ДНК также различаются по диаметру, количеству оснований на виток спирали и шагу спирали .
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные ( мРНК ), рибосомальные ( рРНК ) и транспортные ( тРНК ). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции , и далее принимают участие в биосинтезе белков (процессе трансляции ). Помимо кодирующих последовательностей, ДНК содержит последовательности, выполняющие в клетках регуляторные и структурные функции. Кроме того, в геноме эукариот часто встречаются участки, принадлежащие «генетическим паразитам», например транспозонам .
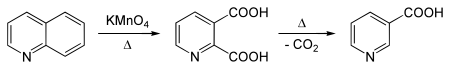
Расшифровка структуры ДНК ( 1953 год ) стала одним из поворотных моментов в истории биологии. За выдающийся вклад в это открытие Фрэнсису Крику , Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия по физиологии или медицине 1962 года. Розалинд Франклин , получившая рентгенограммы , без которых Уотсон и Крик не имели бы возможность сделать выводы о структуре ДНК, умерла в 1958 году от рака ( Нобелевскую премию не дают посмертно) .
История изучения



ДНК как химическое вещество была выделена Иоганном Фридрихом Мишером в 1869 году из остатков клеток, содержащихся в гное. Он выделил вещество, в состав которого входят азот и фосфор. Вначале новое вещество получило название нуклеин , а позже, когда Мишер определил, что это вещество обладает кислотными свойствами, вещество получило название нуклеиновая кислота . Биологическая функция новооткрытого вещества была неясна, и долгое время ДНК считалась запасником фосфора в организме . Более того, даже в начале XX века многие биологи считали, что ДНК не имеет никакого отношения к передаче информации, поскольку строение молекулы, по их мнению, было слишком однообразным и не могло содержать закодированную информацию.
До 1930-х годов считалось, что ДНК содержится только в животных клетках, а в растительных — РНК . В 1934 году в журнале «Hoppe-Seyler’s Zeitschrift für physiologishe Chemie» , затем в 1935 году в « » вышли статьи советских биохимиков А. Н. Белозерского и А. Р. Кизеля , в которых доказывалось присутствие ДНК в растительных клетках. В 1936 году группой Белозерского ДНК была выделена из семян и тканей бобовых, злаковых и других растений . Результатом исследований этой же группы советских учёных в 1939 — 1947 годах стала первая в мировой научной литературе информация о содержании нуклеиновых кислот у различных видов бактерий.
Постепенно было доказано, что именно ДНК, а не белки, как считалось раньше, является носителем генетической информации . Одно из первых решающих доказательств принесли эксперименты Освальда Эвери, Колина Маклауда и Маклина Маккарти (1944 г.) по трансформации бактерий . Им удалось показать, что за так называемую трансформацию (приобретение болезнетворных свойств безвредной культурой в результате добавления в неё мёртвых болезнетворных бактерий) отвечает выделенная из пневмококков ДНК. Эксперимент американских учёных Алфреда Херши и Марты Чейз ( эксперимент Херши — Чейз , 1952 г.) с помеченными радиоактивными изотопами белками и ДНК бактериофагов показали, что в заражённую клетку передаётся только нуклеиновая кислота фага, а новое поколение фага содержит такие же белки и нуклеиновую кислоту, как исходный фаг .
Вплоть до 50-х годов XX века точное строение ДНК, как и способ передачи наследственной информации, оставалось неизвестным. Хотя и было доподлинно известно, что ДНК состоит из нескольких цепочек, состоящих из нуклеотидов, никто не знал точно, сколько этих цепочек и как они соединены.
В результате работы группы биохимика Эрвина Чаргаффа в 1949—1951 гг. были сформулированы так называемые правила Чаргаффа . Чаргаффу и сотрудникам удалось разделить нуклеотиды ДНК при помощи бумажной хроматографии и определить точные количественные соотношения нуклеотидов разных типов. Соотношение, выявленное для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказалось следующим: количество аденина равно количеству тимина, а гуанина — цитозину: А=Т, Г=Ц . Эти правила, наряду с данными рентгеноструктурного анализа, сыграли решающую роль в расшифровке структуры ДНК.
Структура двойной спирали ДНК была предложена Френсисом Криком и Джеймсом Уотсоном в 1953 году на основании рентгеноструктурных данных, полученных Морисом Уилкинсом и Розалинд Франклин , и правил Чаргаффа . Позже предложенная Уотсоном и Криком модель строения ДНК была доказана, а их работа отмечена Нобелевской премией по физиологии или медицине 1962 г. Среди лауреатов не было скончавшейся к тому времени от рака Розалинд Франклин, так как премия не присуждается посмертно .
Интересно, что в 1957 году американцы Александер Рич, Гэри Фелзенфелд и Дэйвид Дэйвис описали нуклеиновую кислоту, составленную тремя спиралями . А в 1985—1986 годах Максим Давидович Франк-Каменецкий в Москве показал, как двухспиральная ДНК складывается в так называемую H-форму, составленную уже не двумя, а тремя нитями ДНК .
Структура молекулы
Нуклеотиды
Дезоксирибонуклеиновая кислота (ДНК) представляет собой биополимер ( полианион ), мономером которого является нуклеотид .
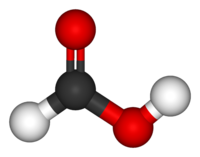
Каждый нуклеотид состоит из остатка фосфорной кислоты , присоединённого по 5'-положению к сахару дезоксирибозе , к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований . Именно наличие характерного сахара и составляет одно из главных различий между ДНК и РНК , зафиксированное в названиях этих нуклеиновых кислот (в состав РНК входит сахар рибоза ) . Пример нуклеотида — аденозинмонофосфат , у которого основанием, присоединённым к фосфату и рибозе , является аденин (A) (показан на рисунке).
Исходя из структуры молекул, основания, входящие в состав нуклеотидов, разделяют на две группы: пурины ( аденин [A] и гуанин [G]) образованы соединёнными пяти- и шестичленным гетероциклами ; пиримидины ( цитозин [C] и тимин [T]) — шестичленным гетероциклом .
В виде исключения, например, у бактериофага PBS1, в ДНК встречается пятый тип оснований — урацил ([U]), пиримидиновое основание , отличающееся от тимина отсутствием метильной группы на кольце, обычно заменяющее тимин в РНК .
Тимин (T) и урацил (U) не так строго приурочены к ДНК и РНК соответственно, как это считалось ранее. Так, после синтеза некоторых молекул РНК значительное число урацилов в этих молекулах метилируется с помощью специальных ферментов, превращаясь в тимин. Это происходит в транспортных и рибосомальных РНК .
Двойная спираль

Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей во вторичную структуру, получившую название двойной спирали . Остов каждой из цепей состоит из чередующихся фосфатов и сахаров . Внутри одной цепи ДНК соседние нуклеотиды соединены , которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нуклеотида и 5'-фосфатной группой (5'—РО 3 ) другого. Асимметричные концы цепи ДНК называются 3' (три прайм) и 5' (пять прайм). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу).
Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированной водородными связями , образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу).
Диаметр двойной спирали составляет от 22 до 24 Å , или 2,2—2,4 нм , длина каждого нуклеотида — 3,3 Å (0,33 нм) . Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть рёбра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы.
В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки . Белки, например, факторы транскрипции , которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны .
Образование связей между основаниями
Каждое основание на одной из цепей связывается с одним определённым основанием на второй цепи. Такое специфическое связывание называется комплементарным . Пурины комплементарны пиримидинам (то есть способны к образованию водородных связей с ними): аденин образует связи только с тимином, а цитозин — с гуанином. В двойной спирали цепочки также связаны с помощью гидрофобных взаимодействий и стэкинга , которые не зависят от последовательности оснований ДНК .
Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи. Обратимость и специфичность взаимодействий между комплементарными парами оснований важна для репликации ДНК и всех остальных функций ДНК в живых организмах.
Так как водородные связи нековалентны , они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться как замок-молния под действием ферментов ( хеликазы ) или при высокой температуре . Разные пары оснований образуют разное количество водородных связей. АТ связаны двумя, ГЦ — тремя водородными связями, поэтому на разрыв ГЦ требуется больше энергии. Процент ГЦ-пар и длина молекулы ДНК определяют количество энергии, необходимой для диссоциации цепей: длинные молекулы ДНК с большим содержанием ГЦ более тугоплавки . Температура плавления нуклеиновых кислот зависит от ионного окружения, рост ионной силы стабилизирует ДНК по отношению к денатурированию. При добавлении к ДНК хлорида натрия существует линейная зависимость между температурой плавления и логарифмом ионной силы раствора. Предполагается, что добавление электролита ведет к экранированию зарядов в цепях ДНК и этим уменьшает силы электростатического отталкивания между заряженными фосфатными группами, способствуя жёсткости структуры. Аналогично температуру плавления ДНК повышают ионы марганца, кобальта, цинка и никеля, но ионы меди, кадмия и свинца, напротив, понижают её .
Части молекул ДНК, которые из-за их функций должны быть легко разделяемы, например, ТАТА последовательность в бактериальных промоторах , обычно содержат большое количество А и Т.
Химические модификации азотистых оснований

|

|

|
| Цитозин | 5-метилцитозин | Тимин |
Азотистые основания в составе ДНК могут быть ковалентно модифицированы, что используется при регуляции экспрессии генов. Например, в клетках позвоночных метилирование цитозина с образованием 5-метилцитозина используется соматическими клетками для передачи профиля генной экспрессии дочерним клеткам. Метилирование цитозина не влияет на спаривание оснований в двойной спирали ДНК. У позвоночных метилирование ДНК в соматических клетках ограничивается метилированием цитозина в последовательности ЦГ . Средний уровень метилирования отличается у разных организмов, так, у нематоды Caenorhabditis elegans метилирование цитозина не наблюдается, а у позвоночных обнаружен высокий уровень метилирования — до 1 % . Другие модификации оснований включают метилирование аденина у бактерий и гликозилирование урацила с образованием «J-основания» в кинетопластах .
Метилирование цитозина с образованием 5-метилцитозина в промоторной части гена коррелирует с его неактивным состоянием . Метилирование цитозина важно также для инактивации Х-хромосомы у млекопитающих . Метилирование ДНК используется в геномном импринтинге . Значительные нарушения профиля метилирования ДНК происходят при канцерогенезе .
Несмотря на биологическую роль, 5-метилцитозин может спонтанно утрачивать аминную группу (деаминироваться), превращаясь в тимин , поэтому метилированные цитозины являются источником повышенного числа мутаций .
Повреждения ДНК

ДНК может повреждаться разнообразными мутагенами , к которым относятся окисляющие и алкилирующие вещества, а также высокоэнергетическая электромагнитная радиация — ультрафиолетовое и рентгеновское излучение . Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолет повреждает ДНК путём образования в ней димеров тимина, которые возникают при образовании ковалентных связей между соседними основаниями .
Оксиданты, такие как свободные радикалы или пероксид водорода , приводят к нескольким типам повреждения ДНК, включая модификации оснований, в особенности гуанозина, а также двухцепочечные разрывы в ДНК . По некоторым оценкам, в каждой клетке человека окисляющими соединениями ежедневно повреждается порядка 500 оснований . Среди разных типов повреждений наиболее опасные — это двухцепочечные разрывы, потому что они трудно репарируются и могут привести к потерям участков хромосом ( делециям ) и транслокациям .
Многие молекулы мутагенов вставляются ( интеркалируют ) между двумя соседними парами оснований. Большинство этих соединений, например: бромистый этидий , даунорубицин , доксорубицин и талидомид , имеет ароматическую структуру. Для того чтобы интеркалирующее соединение могло поместиться между основаниями, они должны разойтись, расплетая и нарушая структуру двойной спирали. Эти изменения в структуре ДНК мешают репликации , вызывая мутации, и транскрипции . Поэтому интеркалирующие соединения часто являются канцерогенами , наиболее известные из которых — бензопирен , акридины , афлатоксин и бромистый этидий . Несмотря на эти негативные свойства, в силу их способности подавлять транскрипцию и репликацию ДНК, интеркалирующие соединения используются в химиотерапии для подавления быстро растущих клеток рака .
Некоторые вещества ( цисплатин , митомицин C , псорален ) образуют поперечные сшивки между нитями ДНК и подавляют синтез ДНК, благодаря чему используются в химиотерапии некоторых видов рака (см. Химиотерапия злокачественных новообразований ).
Суперскрученность
Если взяться за концы верёвки и начать скручивать их в разные стороны, она становится короче и на верёвке образуются «супервитки». Так же может быть суперскручена и ДНК. В обычном состоянии цепочка ДНК делает один оборот на каждые 10,4 пар оснований, но в суперскрученном состоянии спираль может быть свёрнута туже или расплетена . Выделяют два типа суперскручивания: положительное — в направлении нормальных витков, при котором основания расположены ближе друг к другу; и отрицательное — в противоположном направлении. В природе молекулы ДНК обычно находятся в отрицательном суперскручивании, которое вносится ферментами — топоизомеразами . Эти ферменты удаляют дополнительное скручивание, возникающее в ДНК в результате транскрипции и репликации .

Структуры на концах хромосом
На концах линейных хромосом находятся специализированные структуры ДНК, называемые теломерами . Основная функция этих участков — поддержание целостности концов хромосом . Теломеры также защищают концы ДНК от деградации экзонуклеазами и предотвращают активацию системы репарации . Поскольку обычные ДНК-полимеразы не могут реплицировать 3' концы хромосом, это делает специальный фермент — теломераза .
В клетках человека теломеры часто представлены одноцепочечной ДНК и состоят из нескольких тысяч повторяющихся единиц последовательности ТТАГГГ . Эти последовательности с высоким содержанием гуанина стабилизируют концы хромосом, формируя очень необычные структуры, называемые G-квадруплексами и состоящие из четырёх, а не двух взаимодействующих оснований. Четыре гуаниновых основания, все атомы которых находятся в одной плоскости, образуют пластинку, стабилизированную водородными связями между основаниями и хелатированием в центре неё иона металла (чаще всего калия ). Эти пластинки располагаются стопкой друг над другом .
На концах хромосом могут образовываться и другие структуры: основания могут быть расположены в одной цепочке или в разных параллельных цепочках. Кроме этих «стопочных» структур теломеры формируют большие петлеобразные структуры, называемые Т-петли или теломерные петли. В них одноцепочечная ДНК располагается в виде широкого кольца, стабилизированного теломерными белками . В конце Т-петли одноцепочечная теломерная ДНК присоединяется к двухцепочечной ДНК, нарушая спаривание цепочек в этой молекуле и образуя связи с одной из цепей. Это трёхцепочечное образование называется Д-петля (от англ. displacement loop ) .
Биологические функции
ДНК является носителем генетической информации , записанной в виде последовательности нуклеотидов с помощью генетического кода . С молекулами ДНК связаны два основополагающих свойства живых организмов — наследственность и изменчивость . В ходе процесса, называемого репликацией ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении , отсюда следует, что образовавшиеся клетки оказываются генетически идентичны исходной.
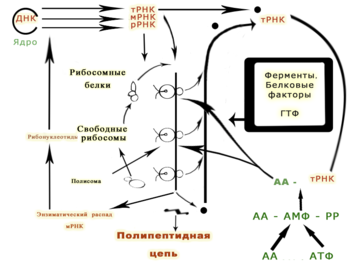
Генетическая информация реализуется при экспрессии генов в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК ).
Последовательность нуклеотидов «кодирует» информацию о различных типах РНК: информационных, или матричных ( мРНК ), рибосомальных ( рРНК ) и транспортных ( тРНК ). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции . Роль их в биосинтезе белков (процессе трансляции ) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке , рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых — сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков — в активный центр рибосомы, «ползущей» по иРНК.
Структура генома

Большинство природных ДНК имеет двухцепочечную структуру, линейную ( эукариоты , некоторые вирусы и отдельные роды бактерий ) или кольцевую ( прокариоты , хлоропласты и митохондрии ). Линейную одноцепочечную ДНК содержат некоторые вирусы и бактериофаги . Молекулы ДНК находятся in vivo в плотно упакованном, состоянии . В клетках эукариот ДНК располагается главным образом в ядре и на стадии профазы, метафазы или анафазы митоза доступны для наблюдения с помощью светового микроскопа в виде набора хромосом . Бактериальная (прокариоты) ДНК обычно представлена одной кольцевой молекулой ДНК, расположенной в неправильной формы образовании в цитоплазме, называемым нуклеоидом . Генетическая информация генома состоит из генов. Ген — единица передачи наследственной информации и участок ДНК, который влияет на определённую характеристику организма. Ген содержит открытую рамку считывания , которая транскрибируется, а также , например промотор и энхансер , которые контролируют экспрессию открытых рамок считывания.
У многих видов только малая часть общей последовательности генома кодирует белки. Так, только около 1,5 % генома человека состоит из кодирующих белок экзонов , а больше 50 % ДНК человека состоит из некодирующих повторяющихся последовательностей ДНК . Причины наличия такого большого количества некодирующей ДНК в эукариотических геномах и огромная разница в размерах геномов (С-значение) — одна из неразрешённых научных загадок ; исследования в этой области также указывают на большое количество фрагментов реликтовых вирусов в этой части ДНК.
Последовательности генома, не кодирующие белок
В настоящее время накапливается всё больше данных, противоречащих идее о некодирующих последовательностях как «мусорной ДНК» ( англ. junk DNA ). Теломеры и центромеры содержат малое число генов, но они важны для функционирования и стабильности хромосом . Часто встречающаяся форма некодирующих последовательностей человека — псевдогены , копии генов, инактивированные в результате мутаций . Эти последовательности нечто вроде молекулярных ископаемых , хотя иногда они могут служить исходным материалом для дупликации и последующей дивергенции генов . Другой источник разнообразия белков в организме — это использование интронов в качестве «линий разреза и склеивания» в альтернативном сплайсинге . Наконец, не кодирующие белок последовательности могут кодировать вспомогательные клеточные РНК , например мяРНК . Недавнее исследование транскрипции генома человека показало, что 10 % генома даёт начало полиаденилированным РНК , а исследование генома мыши показало, что 62 % его транскрибируется .
Транскрипция и трансляция
Генетическая информация, закодированная в ДНК, должна быть прочитана и в конечном итоге выражена в синтезе различных биополимеров , из которых состоят клетки. Последовательность оснований в цепочке ДНК напрямую определяет последовательность оснований в РНК , на которую она «переписывается» в процессе, называемом транскрипцией. В случае мРНК эта последовательность определяет аминокислоты белка. Соотношение между нуклеотидной последовательностью мРНК и аминокислотной последовательностью определяется правилами трансляции , которые называются генетическим кодом . Генетический код состоит из трёхбуквенных «слов», называемых кодонами , состоящих из трёх нуклеотидов (то есть ACT, CAG, TTT и т. п.). Во время транскрипции нуклеотиды гена копируются на синтезируемую РНК РНК-полимеразой . Эта копия в случае мРНК декодируется рибосомой , которая «читает» последовательность мРНК, осуществляя спаривание матричной РНК с транспортными РНК , которые присоединены к аминокислотам. Поскольку в трёхбуквенных комбинациях используются 4 основания, всего возможны 64 кодона (4³ комбинации). Кодоны кодируют 20 стандартных аминокислот, каждой из которых соответствует в большинстве случаев более одного кодона. Один из трёх кодонов, которые располагаются в конце мРНК, не означает аминокислоту и определяет конец белка, это «стоп» или «нонсенс» кодоны — TAA, TGA, TAG.
Репликация
Деление клеток необходимо для размножения одноклеточного и роста многоклеточного организма, но до деления клетка должна удвоить геном, чтобы дочерние клетки содержали ту же генетическую информацию, что и исходная клетка. Из нескольких теоретически возможных механизмов удвоения (репликации) ДНК реализуется полуконсервативный. Две цепочки разделяются, а затем каждая недостающая комплементарная последовательность ДНК воспроизводится ферментом ДНК-полимеразой . Этот фермент синтезирует полинуклеотидную цепь, находя правильный нуклеотид через комплементарное спаривание оснований и присоединяя его к растущей цепочке. ДНК-полимераза не может начинать новую цепь, а может лишь наращивать уже существующую, поэтому она нуждается в короткой цепочке нуклеотидов — ( праймере ), синтезируемом праймазой . Так как ДНК-полимеразы могут синтезировать цепочку только в направлении 5' --> 3', антипараллельные цепи ДНК копируются по-разному: одна цепь синтезируется непрерывно, а вторая прерывчато .
Взаимодействие с белками

Все функции ДНК зависят от её взаимодействия с белками. Взаимодействия могут быть неспецифическими, когда белок присоединяется к любой молекуле ДНК, или зависеть от наличия особой последовательности. Ферменты также могут взаимодействовать с ДНК, из них наиболее важные — это РНК-полимеразы , которые копируют последовательность оснований ДНК на РНК в транскрипции или при синтезе новой цепи ДНК — репликации .
Структурные и регуляторные белки
Хорошо изученными примерами взаимодействия белков и ДНК, не зависящего от нуклеотидной последовательности ДНК, является взаимодействие со структурными белками. В клетке ДНК связана с этими белками, образуя компактную структуру, которая называется хроматин . У эукариот хроматин образован при присоединении к ДНК небольших щелочных белков — гистонов, менее упорядоченный хроматин прокариот содержит гистон-подобные белки . Гистоны формируют дискообразную белковую структуру — нуклеосому , вокруг каждой из которых вмещается два оборота спирали ДНК. Неспецифические связи между гистонами и ДНК образуются за счёт ионных связей щелочных аминокислот гистонов и кислотных остатков сахарофосфатного остова ДНК . Химические модификации этих аминокислот включают метилирование, фосфорилирование и ацетилирование . Эти химические модификации изменяют силу взаимодействия между ДНК и гистонами, влияя на доступность специфических последовательностей для факторов транскрипции и изменяя скорость транскрипции . Другие белки в составе хроматина, которые присоединяются к неспецифическим последовательностям — белки с высокой подвижностью в гелях, которые ассоциируют большей частью с согнутой ДНК . Эти белки важны для образования в хроматине структур более высокого порядка .
Особая группа белков, присоединяющихся к ДНК — это белки, которые ассоциируют с одноцепочечной ДНК. Наиболее хорошо охарактеризованный белок этой группы у человека — репликационный белок А, без которого невозможно протекание большинства процессов, где расплетается двойная спираль, включая репликацию, рекомбинацию и репарацию . Белки этой группы стабилизируют одноцепочечную ДНК и предотвращают формирование стеблей-петель или деградации нуклеазами .
В то же время другие белки узнают и присоединяются к специфическим последовательностям. Наиболее изученная группа таких белков — различные классы факторов транскрипции , то есть белки, регулирующие транскрипцию . Каждый из этих белков узнаёт свою последовательность, часто в промоторе , и активирует или подавляет транскрипцию гена. Это происходит при ассоциации факторов транскрипции с РНК-полимеразой либо напрямую, либо через белки-посредники. Полимераза ассоциирует сначала с белками, а потом начинает транскрипцию . В других случаях факторы транскрипции могут присоединяться к ферментам , которые модифицируют находящиеся на промоторах гистоны , что изменяет доступность ДНК для полимераз .
Так как специфические последовательности встречаются во многих местах генома , изменения в активности одного типа фактора транскрипции могут изменить активность тысяч генов . Соответственно, эти белки часто регулируются в процессах ответа на изменения в окружающей среде, развития организма и дифференцировки клеток . Специфичность взаимодействия факторов транскрипции с ДНК обеспечивается многочисленными контактами между аминокислотами и основаниями ДНК, что позволяет им «читать» последовательность ДНК. Большинство контактов с основаниями происходит в главной бороздке, где основания более доступны .
Ферменты, модифицирующие ДНК
Топоизомеразы и хеликазы
В клетке ДНК находится в компактном, т. н. суперскрученном состоянии, иначе она не смогла бы в ней уместиться. Для протекания жизненно важных процессов ДНК должна быть раскручена, что производится двумя группами белков — топоизомеразами и хеликазами.
Топоизомеразы — ферменты, которые имеют и нуклеазную, и лигазную активности. Они изменяют степень суперскрученности в ДНК. Некоторые из этих ферментов разрезают спираль ДНК и позволяют вращаться одной из цепей, тем самым уменьшая уровень суперскрученности, после чего фермент заделывает разрыв . Другие ферменты могут разрезать одну из цепей и проводить вторую цепь через разрыв, а потом лигировать разрыв в первой цепи . Топоизомеразы необходимы во многих процессах, связанных с ДНК, таких как репликация и транскрипция .
Хеликазы — белки, которые являются одним из . Они используют химическую энергию нуклеозидтрифосфатов , чаще всего АТФ , для разрыва водородных связей между основаниями, раскручивая двойную спираль на отдельные цепочки . Эти ферменты важны для большинства процессов, где белкам необходим доступ к основаниям ДНК.
Нуклеазы и лигазы
В различных процессах, происходящих в клетке, например рекомбинации и репарации , участвуют ферменты, способные разрезать и восстанавливать целостность нитей ДНК. Ферменты, разрезающие ДНК, носят название нуклеаз. Нуклеазы, которые гидролизуют нуклеотиды на концах молекулы ДНК, называются экзонуклеазами, а эндонуклеазы разрезают ДНК внутри цепи. Наиболее часто используемые в молекулярной биологии и генетической инженерии нуклеазы — это эндонуклеазы рестрикции (рестриктазы), которые разрезают ДНК около специфических последовательностей. Например, фермент EcoRV (рестрикционный фермент № 5 из ' E. coli ' ) узнаёт шестинуклеотидную последовательность 5'-GAT|ATC-3' и разрезает ДНК в месте, указанном вертикальной линией. В природе эти ферменты защищают бактерии от заражения бактериофагами , разрезая ДНК фага, когда она вводится в бактериальную клетку. В этом случае нуклеазы — часть системы модификации-рестрикции . ДНК-лигазы «сшивают» концы фрагментов ДНК между собой, катализируя формирование фосфодиэфирной связи с использованием энергии АТФ . Рестрикционные нуклеазы и лигазы используются в клонировании и фингерпринтинге .

Полимеразы
Существует также важная для метаболизма ДНК группа ферментов, которые синтезируют цепи полинуклеотидов из нуклеозидтрифосфатов — ДНК-полимеразы. Они добавляют нуклеотиды к 3'- гидроксильной группе предыдущего нуклеотида в цепи ДНК, поэтому все полимеразы работают в направлении 5'--> 3' . В активном центре этих ферментов субстрат — нуклеозидтрифосфат — спаривается с комплементарным основанием в составе одноцепочечной полинуклеотидной цепочки — матрицы.
В процессе репликации ДНК ДНК-зависимая ДНК-полимераза синтезирует копию исходной последовательности ДНК. Точность очень важна в этом процессе, так как ошибки в полимеризации приведут к мутациям , поэтому многие полимеразы обладают способностью к «редактированию» — исправлению ошибок. Полимераза узнаёт ошибки в синтезе по отсутствию спаривания между неправильными нуклеотидами. После определения отсутствия спаривания активируется 3'--> 5' экзонуклеазная активность полимеразы, и неправильное основание удаляется . В большинстве организмов ДНК-полимеразы работают в виде большого комплекса, называемого реплисомой , которая содержит многочисленные дополнительные субъединицы, например хеликазы .
РНК-зависимые ДНК-полимеразы — специализированный тип полимераз, которые копируют последовательность РНК на ДНК. К этому типу относятся обратная транскриптаза , которая содержится в ретровирусах и используется при инфекции клеток, а также теломераза , необходимая для репликации теломер . Теломераза — необычный фермент, потому что она содержит собственную матричную РНК .
Транскрипция осуществляется ДНК-зависимой РНК-полимеразой , которая копирует последовательность ДНК одной цепочки на мРНК . В начале транскрипции гена РНК-полимераза присоединяется к последовательности в начале гена, называемой промотором , и расплетает спираль ДНК. Потом она копирует последовательность гена на матричную РНК до тех пор, пока не дойдёт до участка ДНК в конце гена — терминатора , где она останавливается и отсоединяется от ДНК. Также как ДНК-зависимая ДНК-полимераза человека, РНК-полимераза II, которая транскрибирует большую часть генов в геноме человека , работает в составе большого белкового комплекса, содержащего регуляторные и дополнительные единицы .
Генетическая рекомбинация

Двойная спираль ДНК обычно не взаимодействует с другими сегментами ДНК, и в человеческих клетках разные хромосомы пространственно разделены в ядре . Это расстояние между разными хромосомами важно для способности ДНК действовать в качестве стабильного носителя информации. В процессе рекомбинации с помощью ферментов две спирали ДНК разрываются, обмениваются участками, после чего непрерывность спиралей восстанавливается, поэтому обмен участками негомологичных хромосом может привести к повреждению целостности генетического материала.
Рекомбинация позволяет хромосомам обмениваться генетической информацией, в результате этого образуются новые комбинации генов, что увеличивает эффективность естественного отбора и важно для быстрой эволюции новых белков . Генетическая рекомбинация также играет роль в репарации , особенно в ответе клетки на разрыв обеих цепей ДНК .
Самая распространённая форма кроссинговера — это гомологичная рекомбинация , когда принимающие участие в рекомбинации хромосомы имеют очень похожие последовательности. Иногда в качестве участков гомологии выступают транспозоны . Негомологичная рекомбинация может привести к повреждению клетки, поскольку в результате такой рекомбинации возникают транслокации . Реакция рекомбинации катализируется ферментами, которые называются рекомбиназы, например, Cre. На первом этапе реакции рекомбиназа делает разрыв в одной из цепей ДНК, позволяя этой цепи отделиться от комплементарной цепи и присоединиться к одной из цепей второй хроматиды . Второй разрыв в цепи второй хроматиды позволяет ей также отделиться и присоединиться к оставшейся без пары цепи из первой хроматиды, формируя структуру Холлидея . Структура Холлидея может передвигаться вдоль соединённой пары хромосом, меняя цепи местами. Реакция рекомбинации завершается, когда фермент разрезает соединение, а две цепи лигируются .
Эволюция метаболизма, основанного на ДНК
ДНК содержит генетическую информацию, которая делает возможной жизнедеятельность, рост, развитие и размножение всех современных организмов. Однако как долго в течение четырёх миллиардов лет истории жизни на Земле ДНК была главным носителем генетической информации, неизвестно. Существуют гипотезы, что РНК играла центральную роль в обмене веществ , поскольку она может и переносить генетическую информацию, и осуществлять катализ с помощью рибозимов . Кроме того, РНК — один из основных компонентов «фабрик белка» — рибосом . Древний РНК-мир, где нуклеиновая кислота была использована и для катализа, и для переноса информации, мог послужить источником современного генетического кода, состоящего из четырёх оснований. Это могло произойти в результате того, что число оснований в организме было компромиссом между небольшим числом оснований, увеличивавшим точность репликации , и большим числом оснований, увеличивающим каталитическую активность рибозимов .
Древние генетические системы не дошли до наших дней. ДНК в окружающей среде в среднем сохраняется в течение 1 миллиона лет, постепенно деградируя до коротких фрагментов. Извлечение ДНК из бактериальных спор, заключённых в кристаллах соли 250 млн лет назад, и определение последовательности генов 16S рРНК служит темой оживлённой дискуссии в научной среде . Самой древней ДНК на момент 2023 г. считается ДНК возрастом более 2 млн лет .
См. также
Примечания
- Александр Панчин . Сумма биотехнологии . — АСТ, 2015. — С. 13. — 432 с. — ISBN 978-5-17-093602-1 .
- Bustamante C., Bryant Z., Smith S. B. (англ.) // Nature. — 2003. — Vol. 421 , no. 6921 . — P. 423—427 . 6 июня 2011 года.
- David W Ussery. (англ.) . ENCYCLOPEDIA OF LIFE SCIENCES . Macmillan Publishers Ltd, Nature Publishing Group. Дата обращения: 30 мая 2023. 9 декабря 2022 года.
- Wiktoria Seroczynska. (англ.) . Дата обращения: 30 мая 2023. 30 мая 2023 года.
- Erica Westly. (англ.) . Scientific American (6 октября 2008). Дата обращения: 18 ноября 2013. 8 января 2014 года.
- Dahm R. Friedrich Miescher and the discovery of DNA (англ.) // : journal. — 2005. — Vol. 278 , no. 2 . — P. 274—288 . — .
- Kiesel A., Beloserskii A. Hoppe-Seyler’s Zeitschrift fur physiologishe Chemie, 229, 160—166. 1934.
- Белозерский А. Н. Ученые записки МГУ, вып.4, 209—215, 1935.
- Белозерский А. Н., Чигирев С. Д. Биохимия, 1, 136—146, 1936.
- Hershey A., Chase M. (англ.) // : journal. — , 1952. — Vol. 36 , no. 1 . — P. 39—56 . — . 1 октября 2008 года.
- Elson D., Chargaff E. On the deoxyribonucleic acid content of sea urchin gametes (англ.) // Experientia : journal. — 1952. — Vol. 8 , no. 4 . — P. 143—145 . — doi : . — .
- Chargaff E., Lipshitz R., Green C. (англ.) // J Biol Chem : journal. — 1952. — Vol. 195 , no. 1 . — P. 155—160 . — . 3 февраля 2018 года.
- ↑ Watson J., Crick F. (рум.) // Nature. — 1953. — Т. 171 , nr. 4356 . — P. 737—8 . 23 августа 2014 года.
- от 4 января 2007 на Wayback Machine Nobelprize .org Accessed 22 Dec 06
- . Дата обращения: 21 апреля 2013. 3 октября 2013 года.
- . Дата обращения: 21 апреля 2013. 16 ноября 2005 года.
- Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. (англ.) . — New York and London: , 2002. 18 сентября 2009 года.
- Butler, John M. (2001) Forensic DNA Typing «Elsevier». pp. 14 — 15. ISBN 978-0-12-147951-0
- ↑ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- от 5 февраля 2007 на Wayback Machine IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
- Takahashi I., Marmur J. Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis (англ.) // Nature : journal. — 1963. — Vol. 197 . — P. 794—5 .
- Agris P. (англ.) // : journal. — 2004. — Vol. 32 , no. 1 . — P. 223—38 . — .
- Ghosh A., Bansal M. A glossary of DNA structures from A to Z (англ.) // : journal. — International Union of Crystallography , 2003. — Vol. 59 , no. Pt 4 . — P. 620—6 .
- Mandelkern M., Elias J., Eden D., Crothers D. The dimensions of DNA in solution (англ.) // : journal. — 1981. — Vol. 152 , no. 1 . — P. 153—61 .
- Wing R., Drew H., Takano T., Broka C., Tanaka S., Itakura K., Dickerson R. Crystal structure analysis of a complete turn of B-DNA (англ.) // Nature : journal. — 1980. — Vol. 287 , no. 5784 . — P. 755—8 .
- ↑ Pabo C., Sauer R. Protein-DNA recognition (англ.) // : journal. — Vol. 53 . — P. 293—321 .
- Ponnuswamy P., Gromiha M. On the conformational stability of oligonucleotide duplexes and tRNA molecules (англ.) // : journal. — 1994. — Vol. 169 , no. 4 . — P. 419—432 . — .
- Clausen-Schaumann H., Rief M., Tolksdorf C., Gaub H. (англ.) // : journal. — 2000. — Vol. 78 , no. 4 . — P. 1997—2007 . — . 24 сентября 2019 года.
- Chalikian T., Völker J., Plum G., Breslauer K. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1999. — Vol. 96 , no. 14 . — P. 7853—7858 . — . 24 сентября 2019 года.
- Е.Е.Крисс, К.Б.Яцимирский. Взаимодействие нуклеиновых кислот с металлами..
- Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и др. — М.-Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — Т. I. — С. 719—733. — 808 с. — ISBN 978-5-4344-0112-8 .
- Bird A. DNA methylation patterns and epigenetic memory (англ.) // Genes Dev : journal. — 2002. — Vol. 16 , no. 1 . — P. 6—21 .
- Gommers-Ampt J., Van Leeuwen F., de Beer A., Vliegenthart J., Dizdaroglu M., Kowalak J., Crain P., Borst P. beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei (англ.) // Cell : journal. — Cell Press , 1993. — Vol. 75 , no. 6 . — P. 1129—36 .
- Jones P. A. // Nature Reviews Genetics. — 2012. — Т. 13 , № 7 . — С. 484—492 . 16 апреля 2014 года.
- Klose R., Bird A. Genomic DNA methylation: the mark and its mediators (англ.) // : journal. — 2006. — Vol. 31 , no. 2 . — P. 89—97 .
- Li E., Beard C., Jaenisch R. Role for DNA methylation in genomic imprinting //Nature. — 1993. — Т. 366. — №. 6453. — С. 362—365
- Ehrlich M. DNA methylation in cancer: too much, but also too little //Oncogene. — 2002. — Т. 21. — №. 35. — С. 5400-5413
- Walsh C., Xu G. Cytosine methylation and DNA repair (неопр.) // Curr Top Microbiol Immunol. — Т. 301 . — С. 283—315 .
- Created from от 22 сентября 2008 на Wayback Machine
- Douki T., Reynaud-Angelin A., Cadet J., Sage E. Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation (англ.) // Biochemistry : journal. — 2003. — Vol. 42 , no. 30 . — P. 9221—6 .
- Cadet J., Delatour T., Douki T., Gasparutto D., Pouget J., Ravanat J., Sauvaigo S. Hydroxyl radicals and DNA base damage (неопр.) // . — Elsevier , 1999. — Т. 424 , № 1—2 . — С. 9—21 .
- Shigenaga M., Gimeno C., Ames B. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1989. — Vol. 86 , no. 24 . — P. 9697—701 . 7 марта 2008 года.
- Cathcart R., Schwiers E., Saul R., Ames B. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1984. — Vol. 81 , no. 18 . — P. 5633—7 . 25 июня 2008 года.
- Ferguson L., Denny W. The genetic toxicology of acridines (неопр.) // . — Elsevier , 1991. — Т. 258 , № 2 . — С. 123—60 .
- Jeffrey A. (англ.) // Pharmacol Ther : journal. — 1985. — Vol. 28 , no. 2 . — P. 237—72 .
- Stephens T., Bunde C., Fillmore B. Mechanism of action in thalidomide teratogenesis (англ.) // : journal. — 2000. — Vol. 59 , no. 12 . — P. 1489—99 .
- Braña M., Cacho M., Gradillas A., de Pascual-Teresa B., Ramos A. Intercalators as anticancer drugs (англ.) // : journal. — 2001. — Vol. 7 , no. 17 . — P. 1745—80 .
- Trzaska, Stephen. (англ.) // : journal. — 2005. — 20 June ( vol. 83 , no. 25 ). 20 апреля 2017 года.
- Tomasz, Maria. Mitomycin C: small, fast and deadly (but very selective) (англ.) // : journal. — 1995. — September ( vol. 2 , no. 9 ). — P. 575—579 . — doi : . — .
- Wu Q., Christensen L. A., Legerski R. J., Vasquez K. M. Mismatch repair participates in error-free processing of DNA interstrand crosslinks in human cells (англ.) // : journal. — 2005. — June ( vol. 6 , no. 6 ). — P. 551—557 . — doi : . — . — PMC .
- Benham C., Mielke S. DNA mechanics (неопр.) // . — 2005. — Т. 7 . — С. 21—53 . — .
- ↑ Champoux J. DNA topoisomerases: structure, function, and mechanism (англ.) // : journal. — 2001. — Vol. 70 . — P. 369—413 . — .
- ↑ Wang J. Cellular roles of DNA topoisomerases: a molecular perspective (англ.) // Nat Rev Mol Cell Biol : journal. — 2002. — Vol. 3 , no. 6 . — P. 430—440 . — .
- Created from 7 июня 2013 года.
- Greider C., Blackburn E. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts (англ.) // Cell : journal. — Cell Press , 1985. — Vol. 43 , no. 2 Pt 1 . — P. 405—413 . — .
- ↑ Nugent C., Lundblad V. (англ.) // Genes Dev : journal. — 1998. — Vol. 12 , no. 8 . — P. 1073—1085 . — . 27 сентября 2007 года.
- Wright W., Tesmer V., Huffman K., Levene S., Shay J. (англ.) // Genes Dev : journal. — 1997. — Vol. 11 , no. 21 . — P. 2801—2809 . — . 27 сентября 2007 года.
- ↑ Burge S., Parkinson G., Hazel P., Todd A., Neidle S. (англ.) // : journal. — 2006. — Vol. 34 , no. 19 . — P. 5402—5415 . — . 24 сентября 2019 года.
- Griffith J., Comeau L., Rosenfield S., Stansel R., Bianchi A., Moss H., de Lange T. Mammalian telomeres end in a large duplex loop (англ.) // Cell . — Cell Press , 1999. — Vol. 97 , no. 4 . — P. 503—514 . — .
- Teif V.B. and Bohinc K. Condensed DNA: condensing the concepts (неопр.) // Progress in Biophysics and Molecular Biology. — 2010. — doi : .
- Thanbichler M., Wang S., Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure (англ.) // : journal. — 2005. — Vol. 96 , no. 3 . — P. 506—21 .
- Wolfsberg T., McEntyre J., Schuler G. Guide to the draft human genome (англ.) // Nature. — 2001. — Vol. 409 , no. 6822 . — P. 824—6 .
- Gregory T. (англ.) // Ann Bot (Lond) : journal. — 2005. — Vol. 95 , no. 1 . — P. 133—46 . 16 мая 2007 года.
- Pidoux A., Allshire R. (англ.) // Philos Trans R Soc Lond B Biol Sci : journal. — 2005. — Vol. 360 , no. 1455 . — P. 569—79 . (недоступная ссылка)
- Harrison P., Hegyi H., Balasubramanian S., Luscombe N., Bertone P., Echols N., Johnson T., Gerstein M. (англ.) // : journal. — 2002. — Vol. 12 , no. 2 . — P. 272—80 . 28 октября 2007 года.
- Harrison P., Gerstein M. Studying genomes through the aeons: protein families, pseudogenes and proteome evolution (англ.) // : journal. — 2002. — Vol. 318 , no. 5 . — P. 1155—74 .
- Soller M. (англ.) // Cell Mol Life Sci : journal. — 2006. — Vol. 63 , no. 7—9 . — P. 796—819 . (недоступная ссылка)
- Michalak P. RNA world - the dark matter of evolutionary genomics (англ.) : journal. — 2006. — Vol. 19 , no. 6 . — P. 1768—74 . [ Архивировано] 28 января 2019 года.
- Cheng J., Kapranov P., Drenkow J., Dike S., Brubaker S et al. (англ.) : journal. — 2005. — Vol. 308 . — P. 1149—54 . 1 октября 2010 года.
- Mattick J. S. (англ.) // Nat Rev Genet : journal. — 2004. — Vol. 5 . — P. 316—323 . 23 апреля 2008 года.
- Albà M. (англ.) // : journal. — 2001. — Vol. 2 , no. 1 . — P. REVIEWS3002 .
- Sandman K., Pereira S., Reeve J. (англ.) // Cell Mol Life Sci : journal. — 1998. — Vol. 54 , no. 12 . — P. 1350—64 .
- Dame R. T. The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin (англ.) // : journal. — , 2005. — Vol. 56 , no. 4 . — P. 858—870 . — .
- Luger K., Mäder A., Richmond R., Sargent D., Richmond T. Crystal structure of the nucleosome core particle at 2.8 A resolution (англ.) // Nature : journal. — 1997. — Vol. 389 , no. 6648 . — P. 251—60 .
- Jenuwein T., Allis C. Translating the histone code (англ.) // Science. — 2001. — Vol. 293 , no. 5532 . — P. 1074—80 .
- Ito T. Nucleosome assembly and remodelling (неопр.) // Curr Top Microbiol Immunol. — Т. 274 . — С. 1—22 .
- Thomas J. HMG1 and 2: architectural DNA-binding proteins (англ.) // : journal. — 2001. — Vol. 29 , no. Pt 4 . — P. 395—401 .
- Grosschedl R., Giese K., Pagel J. HMG domain proteins: architectural elements in the assembly of nucleoprotein structures (англ.) // : journal. — 1994. — Vol. 10 , no. 3 . — P. 94—100 .
- Iftode C., Daniely Y., Borowiec J. Replication protein A (RPA): the eukaryotic SSB (англ.) // : journal. — 1999. — Vol. 34 , no. 3 . — P. 141—80 .
- Myers L., Kornberg R. Mediator of transcriptional regulation (англ.) // : journal. — Vol. 69 . — P. 729—49 .
- Spiegelman B., Heinrich R. Biological control through regulated transcriptional coactivators (англ.) // Cell : journal. — Cell Press , 2004. — Vol. 119 , no. 2 . — P. 157—167 .
- Li Z., Van Calcar S., Qu C., Cavenee W., Zhang M., Ren B. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2003. — Vol. 100 , no. 14 . — P. 8164—9 . 24 сентября 2019 года.
- Schoeffler A., Berger J. Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism (англ.) // : journal. — 2005. — Vol. 33 , no. Pt 6 . — P. 1465—70 .
- Tuteja N., Tuteja R. Unraveling DNA helicases. Motif, structure, mechanism and function (англ.) // : journal. — 2004. — Vol. 271 , no. 10 . — P. 1849—1863 .
- Bickle T., Krüger D. (англ.) // : journal. — , 1993. — Vol. 57 , no. 2 . — P. 434—50 .
- Joyce C., Steitz T. (англ.) // : journal. — 1995. — Vol. 177 , no. 22 . — P. 6321—9 . 24 сентября 2019 года.
- Hubscher U., Maga G., Spadari S. Eukaryotic DNA polymerases (англ.) // : journal. — Vol. 71 . — P. 133—63 .
- Johnson A., O'Donnell M. Cellular DNA replicases: components and dynamics at the replication fork (англ.) // : journal. — Vol. 74 . — P. 283—315 .
- Tarrago-Litvak L., Andréola M., Nevinsky G., Sarih-Cottin L., Litvak S. (англ.) // : journal. — , 1994. — Vol. 8 , no. 8 . — P. 497—503 . 5 сентября 2008 года.
- Martinez E. (неопр.) // Plant Mol Biol. — 2002. — Т. 50 , № 6 . — С. 925—47 .
- Cremer T., Cremer C. Chromosome territories, nuclear architecture and gene regulation in mammalian cells (англ.) // Nat Rev Genet : journal. — 2001. — Vol. 2 , no. 4 . — P. 292—301 .
- Pál C., Papp B., Lercher M. An integrated view of protein evolution (англ.) // Nat Rev Genet : journal. — 2006. — Vol. 7 , no. 5 . — P. 337—48 .
- O'Driscoll M., Jeggo P. The role of double-strand break repair - insights from human genetics (англ.) // Nat Rev Genet : journal. — 2006. — Vol. 7 , no. 1 . — P. 45—54 .
- Dickman M., Ingleston S., Sedelnikova S., Rafferty J., Lloyd R., Grasby J., Hornby D. The RuvABC resolvasome (англ.) // : journal. — 2002. — Vol. 269 , no. 22 . — P. 5492—501 .
- Joyce G. The antiquity of RNA-based evolution (англ.) // Nature. — 2002. — Vol. 418 , no. 6894 . — P. 214—21 .
- Orgel L. (англ.) // : journal. — Vol. 39 , no. 2 . — P. 99—123 . 28 июня 2007 года.
- Davenport R. Ribozymes. Making copies in the RNA world (англ.) // Science. — 2001. — Vol. 292 , no. 5520 . — P. 1278 . — .
- Szathmáry E. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1992. — Vol. 89 , no. 7 . — P. 2614—8 . — . 25 июня 2008 года.
- Vreeland R., Rosenzweig W., Powers D. Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal (англ.) // Nature : journal. — 2000. — Vol. 407 , no. 6806 . — P. 897—900 .
- Hebsgaard M., Phillips M., Willerslev E. Geologically ancient DNA: fact or artefact? (англ.) // : journal. — 2005. — Vol. 13 , no. 5 . — P. 212—20 .
- Nickle D., Learn G., Rain M., Mullins J., Mittler J. Curiously modern DNA for a "250 million-year-old" bacterium (англ.) // : journal. — 2002. — Vol. 54 , no. 1 . — P. 134—7 .
- Kurt H. Kjær, Mikkel Winther Pedersen, Bianca De Sanctis, Binia De Cahsan, Thorfinn S. Korneliussen, Christian S. Michelsen, Karina K. Sand, Stanislav Jelavić, Anthony H. Ruter, Astrid M. A. Schmidt, Kristian K. Kjeldsen, Alexey S. Tesakov, Ian Snowball, John C. Gosse, Inger G. Alsos, Yucheng Wang, Christoph Dockter, Magnus Rasmussen, Morten E. Jørgensen, Birgitte Skadhauge, Ana Prohaska, Jeppe Å Kristensen, Morten Bjerager, Morten E. Allentoft, Eric Coissac, Alexandra Rouillard, Alexandra Simakova, Antonio Fernandez-Guerra, Chris Bowler, Marc Macias-Fauria, Lasse Vinner, John J. Welch, Alan J. Hidy, Martin Sikora, Matthew J. Collins, Richard Durbin, Nicolaj K. Larsen, Eske Willerslev. (англ.) // Nature. — 2022-12. — Vol. 612 , iss. 7939 . — P. 283–291 . — ISSN . — doi : . 17 декабря 2022 года.
- Michael Marshall. (англ.) // New Scientist. — 2022-12-17. — Vol. 256 , iss. 3417 . — P. 12 . — ISSN . — doi : .
- Анна Муравьёва. . N + 1 — главное издание о науке, технике и технологиях . Дата обращения: 31 мая 2023. 11 декабря 2022 года.
Литература
- Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3 .
- Докинз Р. Эгоистичный ген. — М.: Мир, 1993. — 318 с. — ISBN 5-03-002531-6 .
- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
- Льюин Б. Гены. — М.: Мир, 1987. — 544 с.
- Пташне М. Переключение генов. Регуляция генной активности и фаг лямбда. — М.: Мир, 1989. — 160 с. от 30 октября 2007 на Wayback Machine .
- Уотсон Дж. Д. от 18 января 2012 на Wayback Machine — М.: Мир, 1969. — 152 с.
- Франк-Каменецкий, М. . — 2-е изд. — М. : Альпина нон-фикшн, 2018. — 336 с. — ISBN 978-5-00139-038-1 .
Ссылки
- от 8 июня 2007 на Wayback Machine выделения и исследования ДНК.
- Веб-адреса от 15 августа 2007 на Wayback Machine .
- Международная от 21 марта 2010 на Wayback Machine — последовательности ДНК из разных организмов (англ.) .
- от 8 января 2021 на Wayback Machine одного из мировых лидеров в области определения последовательностей ДНК и их анализа (англ.) .
- 2021-03-18
- 2