Interested Article - Пироптоз

- 2021-09-06
- 1
Пиропто́з ( англ. pyroptosis ) — вид программируемой некротической гибели клетки , при котором в результате активации каспазы 1 происходит нарушение целостности плазматической мембраны и быстрое высвобождение наружу содержимого клетки. Характерной чертой пироптоза является зависимое от каспазы 1 активное выделение клеткой интерлейкинов IL‑1β и IL‑18 , что приводит к воспалению . Пироптоз служит защитным механизмом врождённого иммунитета , ограничивающим размножение внутриклеточных патогенов , однако этот тип гибели клеток не ограничивается бактериальными инфекциями .
История
Впервые явление пироптоза описали Артуро Зихлински с коллегами в 1992 году, когда изучали литическую форму гибели макрофагов , заражённых Shigella flexneri . Поначалу этот вид клеточной гибели приняли за апоптоз , поскольку для него оказались характерны некоторые черты, присущие апоптозу: фрагментация ДНК, конденсация ядер, а также зависимость от каспаз . Позднее была описана форма клеточной гибели макрофагов, заражённых Salmonella enterica subsp. enterica ( серовар Typhimurium); она оказалась зависимой от каспазы 1 и совершенно отличной от апоптоза. Для неё в 2001 году был предложен термин «пироптоз» . Греческий корень «пиро» означает «огонь», что указывает на воспалительную природу этой формы гибели, а корень «птоз» («опадение») используется в названиях других форм клеточной гибели .
Ключевые особенности
Пироптоз определяется рядом критериев. Во-первых, пироптоз запрограммирован воспалительными каспазами. Для пироптоза необходима протеолитическая активность каспаз, но не аутопротеолитический процессинг (то есть разрезание каспазами друг друга, приводящее к их активации). В большинстве случаев пироптоза каспазы активируются иначе, то есть не разрезанием друг друга, а при непосредственном участии особого комплекса — инфламмасомы , содержащей домен CARD . Во-вторых, активация воспалительных каспаз приводит к образованию пор в плазматической мембране , и клетка при этом становится проницаемой для красителей с малой молекулярной массой , для которых мембрана непроницаема, как то: (7-AAD), бромистый этидий (EtBr) и (PI). По-видимому, эти поры имеют диаметр 1,1—2,4 нм. При апоптозе, наоборот, клеточная мембрана остаётся интактной и клетка распадается на апоптотические тельца, которые не окрашиваются 7-AAD или PI .
После нарушения целостности мембраны в клетку устремляются ионы и вода, в результате чего клетка набухает и подвергается лизису , высвобождая наружу своё содержимое. После разрушения мембраны внутренняя сторона плазматической мембраны оказывается выставленной во внеклеточную жидкость, а потому может быть окрашена , который связывается с фосфатидилсерином (PS) — фосфолипидом , встречающимся только во внутренней стороне клеточной мембраны. При апоптозе флиппаза перемещает PS в наружный слой мембраны, благодаря чему становится возможным окрашивание аннексином V. Таким образом, окрашивание аннексином V не даёт возможности отличить апоптоз от пироптоза .
В-третьих, при пироптозе в клетках происходит , а даёт положительный результат, однако не такой интенсивный, как при апоптозе. Более того, ( англ. DNA laddering ) при пироптозе выражен слабо. Как и при апоптозе, происходит конденсация хроматина , однако ядро остаётся интактным. При апоптозе повреждение ДНК обеспечивается работой (CAD), а при пироптозе этот фермент остаётся связанным со своим ингибитором (хотя в условиях in vitro каспаза 1 может расщеплять ICAD). Вместе с тем разрушение ДНК не является необходимым для пироптоза, и подавление фрагментации ДНК с помощью ингибиторов нуклеаз не предотвращает лизис клеток .
Наконец, при непрограммируемой некротической литической гибели клетки повреждение ДНК активирует полимеразу ADP-рибозы (PARP), которая расходует NAD + , тем самым понижая уровень АТР в клетке. Эффекторные каспазы апоптоза разрезают и инактивируют PARP, поддерживая уровень АТР в клетке, достаточный для дальнейшего хода апоптоза. Однако при пироптозе, индуцируемом Salmonella typhimurium , PARP не инактивируется, хотя in vitro каспаза 1 может разрезать PARP. Неизвестно, может ли каспаза 11 расщеплять ICAD или PARP in vitro , подобно каспазе 1. Макрофаги , лишённые PARP, успешно подвергались пироптозу, поэтому PARP не необходима для пироптоза. Было показано, что in vitro PARP-1 может выступать кофактором ядерного фактора-κВ ( NF-κB ) в регуляции транскрипции каспазы 11, индуцированной липополисахаридом (LPS). Однако нокдаун PARP-1 при помощи shРНК никак не влиял на индуцированную интерфероном γ (IFN-γ) транскрипцию каспазы 11, поэтому PARP-1, видимо, не участвует в пироптозе, опосредованном каспазой 11. Пироптоз отличен также и от программируемой некротической гибели клетки ( некроптоза ); ключевые отличия пироптоза, апоптоза и некроптоза резюмированы в таблице ниже .
| Параметр сравнения | Пироптоз | Апоптоз | Некроптоз |
|---|---|---|---|
| Воспаление | Есть | Нет | Есть |
| Литический/нелитический | Литический | Нелитический | Литический |
| Инициаторные каспазы | Каспазы 1, 4, 5, 11 | Каспазы 2, 8, 9, 10 | Нет |
| Эффекторные каспазы | Нет | Каспазы 3, 6, 7 | Нет |
|
Повреждение ДНК
Эффект лестницы |
Нет |
Есть |
Нет |
| TUNEL-анализ | Положительный | Положительный | Положительный |
| Разрушение ICAD | Нет | Да | Нет |
| Конденсация хроматина | Да | Да | Нет |
| Интактность ядра | Да | Нет | Да |
| Образование пор в мембране | Да | Нет | Да |
| Разрушение PARP | Нет | Да | Нет |
| Окрашивание аннексином V | Положительное | Положительное | Положительное |
Молекулярные механизмы

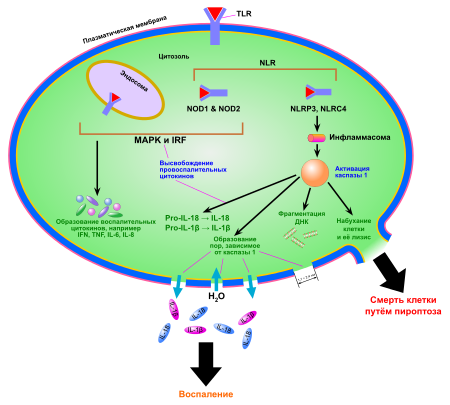
Пироптоз запускается сигналами опасности, которые распознаются во вне- и внутриклеточной среде двумя группами рецепторов опознавания паттерна : Nod-подобными рецепторами (NLR), находящимися в цитоплазме , и Toll-подобными рецепторами (TLR), расположенными в плазматической мембране . Эти сигналы опасности могут выделяться патогенными организмами , при повреждениях тканей . При связывании с NLR внутриклеточных бактериальных, вирусных или принадлежащих самой клетке сигналов опасности начинается сборка мультибелкового комплекса — инфламмасомы (от англ. inflammation — воспаление). Сборка инфламмасомы приводит к активации каспазы 1, которая необходима для образования и выделения провоспалительных цитокинов . Наиболее хорошо изученная инфламмасома, NLRP3 , имеет домены трёх главных типов: домены, содержащие (LRR), центральный нуклеотид -связывающий домен олигомеризации (NBD) и N-концевой (PYD) . Взаимодействие каспазы 1 и NLRP3 осуществляется при помощи ASC . ASC содержит домен активации и рекрутирования каспаз ( CARD-домен ), который связывается с прокаспазой 1 и облегчает её активацию через взаимодействие с её доменом CARD . В результате прокаспазы 1 сближаются, димеризуются и разрезают друг друга на фрагменты p10 и p20, которые способы осуществлять процессинг про-IL-1β и про-IL-18. В других случаях инфламмасома активирует каспазу 1 через другие белки , содержащие домен CARD или PYD .

Ключевая роль каспазы 1 в пироптозе была продемонстрирована в 1995 году в экспериментах с мышами , нокаутными по каспазе 1: их клетки были неспособны к пироптозу. Впрочем, в 2011 году было показано, что все эти мыши несли ещё и сопутствующую мутацию в гене . Поэтому каспаза 11 ( человеческие ортологи — и ) также играет важную роль в пироптозе и врождённой защите от внутриклеточных патогенов. Более того, каспаза 11 может усиливать активацию каспазы 1 при инфекциях, вызванных грамотрицательными бактериями , так что обе эти каспазы могут инициировать пироптоз .
Для прохождения пироптоза необходима протеолитическая активность каспаз, и при пироптозе происходит разрушение или нарушение работы ряда белков, необходимых для функционирования и выживания клетки. К настоящему моменту известно множество мишеней каспазы 1. Среди них белки цитоскелета , внутриклеточного транспорта, трансляции и ключевых метаболических путей (например, гликолитические ферменты альдолаза , , , енолаза и пируваткиназа ). Кроме того, каспаза 1 процессирует и другие каспазы: 4, 5 и 7. Хотя является эффекторной каспазой апоптоза , её активация для пироптоза необязательна, что свидетельствует о различиях в сигнальных путях этих двух видов клеточной гибели .
Ранним этапом пироптоза является образование небольших пор в клеточной мембране, проницаемых для катионов . Это нарушает ионный баланс клетки и приводит к её набуханию и лизису . Через эти поры в клетку входят ионы Ca 2+ , которые участвуют во многих клеточных событиях, связанных с каспазой 1. Лизису клетки предшествуют конденсация ядра , , а также секреция IL-1β и IL-18. Кальций также способствует экзоцитозу лизосом , которые «закрывают» прорехи в мембране и делают возможным высвобождение антимикробных соединений. Эти соединения убивают бактерий, находящихся во внутриклеточной среде. Кроме того, путём экзоцитоза до лизиса клетки наружу выделяются фагоцитированные частицы и внутриклеточные патогены .
В ходе пироптоза из клетки высвобождаются так называемые ( англ. Damage-associated molecular patterns, DAMP ), которые во внеклеточной среде выступают сильными провоспалительными факторами. К их числу принадлежат АТФ , ДНК , РНК , белки теплового шока . DAMP запускают воспалительные процессы в клетках, активируют выделение цитокинов и усиливают нацеливание Т-клеток на определённые мишени. Один из DAMP, HMGB1 , играет особую роль в пироптозе. HMGB1 — это ядерный транскрипционный фактор , который высвобождается наружу при пироптозе и активирует клеточные рецепторы TLR4 и , которые, в свою очередь, активируют выделение цитокинов и миграцию клеток. Показано, что один только HMGB1, без IL-1β, IL-18 и других DAMP, может вызывать воспаление .
Сигнальные липиды группы эйкозаиноидов , такие как лейкотриены и простагландины , увеличивают проницаемость кровеносных сосудов и способствуют воспалению. В 2012 было показано, что входящий ток кальция после активации каспазы 1 может индуцировать синтез эйкозаиноидов. При этом глицин , ингибирующий лизис клетки, но не секреторные пути, связанные с каспазой 1, не блокировал выделение эйкозаноидов, подтверждая, что они действительно секретируются, а не просачиваются во внешнюю среду пассивно при увеличении проницаемости мембраны. Сигнальные пути эйкозаиноидов не всегда связаны с активацией каспазы 1, однако они представляют собой очень быстрый и сильный провоспалительный сигнал, запускаемый каспазой 1 .
В ходе ряда исследований было показано, что активация каспазы 1 и аутофагия антагонистичны по отношению друг к другу: активная каспаза 1 подавляет аутофагию, а аутофагия мешает активации каспазы 1 и уменьшает количество IL-1β и инфламмасом в цитозоле .
Пироптоз и патогены
Важность пироптоза как механизма, который удаляет патогенов из внеклеточной среды, для которой они приспособлены, подтверждается тем фактом, что у многих патогенов имеются механизмы, позволяющие им избежать этой реакции врождённого иммунитета. Среди таких патогенов есть как бактерии , так и вирусы . В общем, можно выделить три основных направления, на которых основаны эти механизмы избегания пироптоза.
- Патогены могут ограничивать экспрессию лиганда , активирующего инфламмасомы, компартментами, недоступными для инфламмасом, или делать так, чтобы лиганд не мог связаться с NLR.
- Патогены модифицируют структуру лиганда так, чтобы инфламмасомы не могли распознавать её;
- Патогены непосредственно блокируют функционирование инфламмасом.
Стоит подчеркнуть, что, в зависимости от патогена, для него может быть важным заблокировать не только пироптоз, но также секрецию интерлейкинов IL-1b и (или) IL-18 (или только её, без блокировки пироптоза) .
В таблице ниже представлены стратегии, которые различные патогены используют для того, чтобы избежать пироптоза .
| Патоген | Стратегия | Эффектор | Инфламмасома/каспаза |
|---|---|---|---|
|
Бактерии
Salmonella typhimurium |
Подавление экспрессии флагеллина (он активирует инфламмасомы) Модификация лигандов Поддержание стабильности вакуолей , в которых заключены бактерии |
Флагеллин T3SS SifA |
NLRC4 NLRC4 NLRC4/ NLRP3 |
|
Альтернативная структура LPS,
не распознаваемая каспазой 11 Поддержание стабильности клеточной стенки |
LPS
CRISPR-Cas |
Каспаза 11
AIM2 |
|
|
Подавление экспрессии флагеллина
Ограничение экспрессии (LLO) вакуолями |
Флагеллин/MogR
LLO |
NLRC4
NLRP3 |
|
| Подавление активации каспазы 1 | YopM | Каспаза 1 | |
| Legionella pneumophila | Поддержание стабильности вакуолей | ShdA | NLRC4, AIM2 , каспаза 11 |
| Подавление активации каспазы 1 | OspC3 | Каспаза 4 | |
|
Вирусы
|
Подавление активации каспазы 1 |
M13L-PYD |
Каспаза 1 |
| Подавление активации каспазы 1 | CrmA | Каспаза 1 | |
| (KHSV) | Подавление инфламмасомы NLRP1 | Orf16 | NLRP1 |
Кроме вышеперечисленных бактерий, механизмами избегания пироптоза обладают такие бактерии, как , , Burkholderia pseudomallei . Кроме того, инфламмасомы связаны с развитием некоторых протозойных инфекций , например, вызванных Trypanosoma cruzi , Toxoplasma gondii , Plasmodium spp. и Leishmania .
Физиологическое и клиническое значение
Как упоминалось выше, пироптоз представляет собой важный защитный механизм врождённого иммунитета, поскольку запускает воспалительный процесс. Кроме того, пироптоз наряду с некроптозом служит важным механизмом элиминирования заражённых клеток. Однако при это распространяется и на гемопоэтические стволовые и прогениторные клетки , результатом чего становятся нарушения гематопоэза, цитопения и иммуносупрессия . Вместе с тем, постоянное воспаление связано со многими заболеваниями, в числе которых метаболические нарушения, аутовоспалительные расстройства и повреждения печени .
Уровень экспрессии инфламмасомы NLRP3 и каспазы 1 непосредственно связан с выраженностью симптомов таких , как ожирение и сахарный диабет 2-го типа . Это связано с влиянием каспазы 1 на уровни IL-1β и IL-18, которые ослабляют секрецию инсулина . При сверхэкспрессии каспазы 1 поглощение клетками глюкозы уменьшается, и наступает состояние, известное как инсулинорезистентность . Далее оно ещё более усугубляется, поскольку IL-1β индуцирует разрушение β-клеток поджелудочной железы .
Мутации в генах, кодирующих компоненты инфламмасом, приводят к развитию аутовоспалительных заболеваний, известных как криопиринопатии. К числу этих заболеваний относятся синдром Макла — Уэльса , холодовая аллергия и . Все они характеризуются внезапными приступами жара и лихорадки и локализованными воспалениями; эти эффекты обусловлены чрезмерным образованием IL-1β .
Имеются свидетельства, что каспаза 1 вовлечена в патогенез и других заболеваний, связанных с гибелью клеток и воспалением, как то: инфаркт миокарда , , нейродегенеративные заболевания , и эндотоксиновый шок . Возможно, пироптоз связан с развитием системной красной волчанки . Повреждение печени при тепловом ударе происходит из-за пироптоза .
Исследования 2014 года показали, что при ВИЧ-инфекции пироптоз лежит в основе уменьшения количества CD4+ Т-клеток и воспаления — двух характерных событий, которые происходят при переходе ВИЧ -инфекции в стадию СПИД . Из-за пироптоза при ВИЧ-инфекции создаётся «порочный круг»: погибающие пироптозом Т-клетки выделяют провоспалительные сигналы, которые привлекают другие Т-клетки в заражённую лимфоидную ткань , где они тоже умирают; таким образом, развивается хроническое воспаление и разрушение тканей. Возможно, безопасные и эффективные ингибиторы каспазы 1 могут разорвать этот цикл. Эти агенты могут стать новыми препаратами против ВИЧ-инфекции, которые действуют не на сам вирус, а на организм хозяина. Интересно, что дефектные по каспазе 1 мыши не демонстрируют видимых отклонений и развиваются нормально, поэтому ингибирование этого белка не будет иметь выраженных побочных действий у ВИЧ-инфицированных людей .
Примечания
- ↑ Vanden Berghe T. , Linkermann A. , Jouan-Lanhouet S. , Walczak H. , Vandenabeele P. (англ.) // Nature reviews. Molecular cell biology. — 2014. — Vol. 15, no. 2 . — P. 135—147. — doi : . — .
- ↑ Jorgensen I. , Miao E. A. (англ.) // Immunological reviews. — 2015. — Vol. 265, no. 1 . — P. 130—142. — doi : . — .
- Kaczmarek A. , Vandenabeele P. , Krysko D. V. (англ.) // Immunity. — 2013. — Vol. 38, no. 2 . — P. 209—223. — doi : . — .
- Sosna J. , Voigt S. , Mathieu S. , Lange A. , Thon L. , Davarnia P. , Herdegen T. , Linkermann A. , Rittger A. , Chan F. K. , Kabelitz D. , Schütze S. , Adam D. (англ.) // Cellular and molecular life sciences : CMLS. — 2014. — Vol. 71, no. 2 . — P. 331—348. — doi : . — .
- Bortoluci K. R. , Medzhitov R. (англ.) // Cellular and molecular life sciences : CMLS. — 2010. — Vol. 67, no. 10 . — P. 1643—1651. — doi : . — .
- Matzinger P. (англ.) // Science (New York, N.Y.). — 2002. — Vol. 296, no. 5566 . — P. 301—305. — doi : . — .
- Ogura Y. , Sutterwala F. S. , Flavell R. A. (англ.) // Cell. — 2006. — Vol. 126, no. 4 . — P. 659—662. — doi : . — .
- Kufer T. A. , Sansonetti P. J. (англ.) // Current opinion in microbiology. — 2007. — Vol. 10, no. 1 . — P. 62—69. — doi : . — .
- Franchi L. , Warner N. , Viani K. , Nuñez G. (англ.) // Immunological reviews. — 2009. — Vol. 227, no. 1 . — P. 106—128. — doi : . — .
- ↑ Yang Y. , Jiang G. , Zhang P. , Fan J. (англ.) // Military Medical Research. — 2015. — Vol. 2. — P. 12. — doi : . — .
- ↑ Li P. , Allen H. , Banerjee S. , Franklin S. , Herzog L. , Johnston C. , McDowell J. , Paskind M. , Rodman L. , Salfeld J. (англ.) // Cell. — 1995. — Vol. 80, no. 3 . — P. 401—411. — .
- ↑ LaRock C. N. , Cookson B. T. (англ.) // PLoS pathogens. — 2013. — Vol. 9, no. 12 . — P. e1003793. — doi : . — .
- Zamboni D. S. , Lima-Junior D. S. (англ.) // Immunological reviews. — 2015. — Vol. 265, no. 1 . — P. 156—171. — doi : . — .
- Croker B. A. , Silke J. , Gerlic M. (англ.) // Current opinion in hematology. — 2015. — Vol. 22, no. 4 . — P. 293—301. — doi : . — .
- Davis B. K. , Wen H. , Ting J. P. (англ.) // Annual review of immunology. — 2011. — Vol. 29. — P. 707—735. — doi : . — .
- Vandanmagsar B. , Youm Y. H. , Ravussin A. , Galgani J. E. , Stadler K. , Mynatt R. L. , Ravussin E. , Stephens J. M. , Dixit V. D. (англ.) // Nature medicine. — 2011. — Vol. 17, no. 2 . — P. 179—188. — doi : . — .
- Strowig T. , Henao-Mejia J. , Elinav E. , Flavell R. (англ.) // Nature. — 2012. — Vol. 481, no. 7381 . — P. 278—286. — doi : . — .
- Neven B. , Prieur A. M. , Quartier dit Maire P. (англ.) // Nature clinical practice. Rheumatology. — 2008. — Vol. 4, no. 9 . — P. 481—489. — doi : . — .
- Church L. D. , Cook G. P. , McDermott M. F. (англ.) // Nature clinical practice. Rheumatology. — 2008. — Vol. 4, no. 1 . — P. 34—42. — doi : . — .
- Magna M. , Pisetsky D. S. (англ.) // Scandinavian journal of immunology. — 2015. — Vol. 82, no. 3 . — P. 218—224. — doi : . — .
- Geng Y. , Ma Q. , Liu Y. N. , Peng N. , Yuan F. F. , Li X. G. , Li M. , Wu Y. S. , Li B. L. , Song W. B. , Zhu W. , Xu W. W. , Fan J. , Su L. (англ.) // Journal of hepatology. — 2015. — Vol. 63, no. 3 . — P. 622—633. — doi : . — .
- ↑ Doitsh G. , Galloway N. L. , Geng X. , Yang Z. , Monroe K. M. , Zepeda O. , Hunt P. W. , Hatano H. , Sowinski S. , Muñoz-Arias I. , Greene W. C. (англ.) // Nature. — 2014. — Vol. 505, no. 7484 . — P. 509—514. — doi : . — .
- Monroe K. M. , Yang Z. , Johnson J. R. , Geng X. , Doitsh G. , Krogan N. J. , Greene W. C. (англ.) // Science (New York, N.Y.). — 2014. — Vol. 343, no. 6169 . — P. 428—432. — doi : . — .
- Kuida K. , Lippke J. A. , Ku G. , Harding M. W. , Livingston D. J. , Su M. S. , Flavell R. A. (англ.) // Science (New York, N.Y.). — 1995. — Vol. 267, no. 5206 . — P. 2000—2003. — .
Литература
- Winkler S. , Rösen-Wolff A. (англ.) // Seminars in immunopathology. — 2015. — Vol. 37, no. 4 . — P. 419—427. — doi : . — .
- 2021-09-06
- 1