Биомаркеры старения
- 1 year ago
- 0
- 0

Генами старения можно назвать гены , выключение которых способно замедлить старение. Старение организма является комплексным явлением, в ходе которого происходит ослабление его жизненных функций. Этот процесс неразрывно связан с генетикой организма, и были обнаружены гены, выключение которых приводит к увеличению продолжительности жизни .
Функция генов старения, несмотря на их название, состоит, как правило, не в том, чтобы старить организм: эти гены обычно являются участниками различных метаболических каскадов . Открыты гены старения были в конце XX века на круглых червях . Изучение этих генов связано с исследованиями на модельных организмах , например с экспериментами на дожитие.
Нематода Caenorhabditis elegans , жизнь которой длится около трёх недель, широко используется в экспериментах по изучению старения . Для C. elegans обнаружена обратная зависимость скорости потери подвижности и продолжительности жизни , то есть для нематод-долгожителей характерен более длительный период активности . Роль в старении нематоды C. elegans играют, в частности, гены daf . Эти гены контролируют переход в dauer-форму – состояние червя, в котором не происходит развития или размножения. Эта форма представляет собой особую личиночную стадию развития и помогает животному увеличить шансы на выживание в неблагоприятных условиях внешней среды . Типичными сигналами перехода в dauer-форму являются нехватка пищи, большая плотность особей, высокая температура. Нокаут некоторых генов сигнального пути перехода в dauer-форму приводит к увеличению продолжительности жизни особей C. elegans. Один из таких генов — daf-23 (age-1). В литературе можно встретить упоминание daf-23 и age-1 как двух разных генов , однако было показано, что daf-23 и age-1 — один и тот же ген .
Нокаут daf-23 способствует увеличению продолжительности жизни нематод более чем в 2 раза . Мутантные по гену daf-2 нематоды также живут в два раза дольше своих собратьев дикого типа .
Помимо увеличения продолжительности жизни, нокаут гена daf-23 приводит к повышенной устойчивости нематод к высоким температурам . Это наблюдение само по себе подчёркивает проявление повышенной устойчивости к стрессу у нематод-долгожителей.
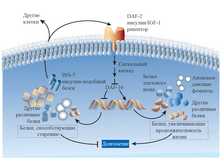
Ген daf-2 кодирует рецептор, похожий на инсулиновый рецептор человека . Этот рецептор, активируемый инсулиноподобным фактором роста 1 (IGF-1), необходим для функционирования сигнального пути, который широко распространён в природе и встречается у различных животных, в том числе у плодовых мух и мышей. Сигнальный путь IGF-1 аналогичен сигнальному пути инсулина у млекопитающих. Контроль работы множества генов позволяет гену daf-2 регулировать разнообразные физиологические процессы на разных стадиях жизненного цикла нематоды. Мутанты daf-2 - характеризуются повышенной экспрессией генов, связанных, в частности, с устойчивостью к стрессу, в то время как экспрессия генов чувствительности к стрессу снижена .
| Функциональный класс | Транскрипт |
|---|---|
| Повышенный уровень экспрессии | |
| Устойчивость к стрессу | hsp-16s , hsp-12s , СОД , глутатион-S-трансфераза |
| Синтез белка | Гены рибосомных субъединиц (rpl-, rps- гены) |
| Сигнальные пути | Гены транстиретина , фосфорилирования белков, рецепторов, сопряженных с G-белком |
| Экспрессия генов | Ген tts-1 |
| Коллагены | Гены col |
| Метаболизм | Гены fat |
| Протеолиз | Гены протеаз |
| Пониженный уровень экспрессии | |
| Фертильность | Вителлогенин |
| Клеточный ответ | Гены cey-1, cey-2, cey-3 |
| Рост клеток | Гены тубулина , актина , ДНК- и РНК- метаболизма, трансляции |
| Протеолиз | Гены asp, rpn, cct |

Одним из генов, регулируемых daf-2, является daf-16, кодирующий транскрипционный фактор DAF-16. В норме рецептор DAF-2 подавляет работу DAF-16 посредством фосфорилирования. В мутантах daf-2- DAF-16 не фосфорилирован, а значит активен. Экспериментально показано, что активация DAF-16 важна для увеличения продолжительности жизни нематод .
Гены daf контролируют метаболические перестройки нематоды в ответ на внешние стрессовые воздействия. При нокауте этих генов возрастает продолжительность жизни нематод, а ограничение питания нематод daf-23- в экспериментах дополнительно увеличивало продолжительность их жизни . При этом есть основания полагать, что продление жизни C. elegans через ограничение питания действует независимо от инсулин/IGF-1 сигнального пути .

Другие изменения наблюдаются в мутантах по гену clk-1. Этот ген влияет на эмбриональное и постэмбриональное развитие, скорость роста и другое . Было установлено, что продукт гена clk-1 участвует в метаболизме убихинона , а мутантные по этому гену нематоды накапливают деметоксиубихинон . Мутанты clk-1 - характеризуются замедленным развитием, повышенной устойчивостью к стрессу и большей продолжительностью жизни. В мутантах clk-1 - наблюдается повышенное содержание убихинона в плазматической мембране . Согласно одной из гипотез, стрессоустойчивость может быть следствием действия убихинона в плазматической мембране как антиоксиданта , а увеличение продолжительности жизни — прямым следствием повышенной стрессоустойчивости. Интересно, что гиперэкспрессия CLK-1 в нематодах дикого типа уменьшает продолжительность жизни C. elegans . Есть сведения об увеличении продолжительности жизни мутантов по генам clk-2, clk-3, gro-1, а нематоды daf-2 - clk-1 - живут в пять раз дольше, нежели черви дикого типа .
Как и у C. elegans, мутации по генам инсулин/IGF-1 сигнального каскада Drosophila melanogaster могут увеличивать продолжительность жизни мух: мутанты по гену инсулин-подобного рецептора InR, гомологичного гену daf-2 C. elegans, живут дольше (самки мух) или характеризуются пониженной смертностью в преклонном возрасте (самцы мух) . Мутации по гену chico, который кодирует субстрат рецептора InR, участвующий в инсулин/IGF-1 каскаде, также продлевают жизнь плодовых мух . Участие в контроле долголетия мух показано для гена dFOXO — гомолога daf-16 °C. elegans .
В результате повреждения гена Indy (сокращение для I`m not dead yet ) продолжительность жизни мух почти удвоилась без заметного снижения фертильности или физической активности , а мутантные по гену mth (сокращение для methuselah — Мафусаил ) мухи демонстрируют прирост продолжительности жизни в 35 % .
Мутация в гене, кодирующем адаптерный белок p66shc, повышает устойчивость мышей к стрессу и продлевает их жизнь на ~30 % . Белок p66shc участвует в ответе на окислительный стресс . Клетки мышей, у которых отсутствует p66shc, демонстрируют повышенную устойчивость к апоптозу, который типично следует за окислительным стрессом в клетках мышей дикого типа . При этом в клетках дикого типа стресс приводит к фосфорилированию p66shc, что, видимо, необходимо для стресс-индуцированного апоптоза . Не совсем ясно, почему мутантные по p66shc мыши живут дольше. Одна из гипотез состоит в том, что снижение у мышей клеточности в результате стресс-индуцированного апоптоза способствует старению, а у мутантов этого не происходит вследствие отсутствия p66shc. Другая возможность состоит в том, что отсутствие p66shc в первую очередь снижает степень повреждения, вызываемого окислительным стрессом, что положительно влияет на здоровье мышей и также снижает вероятность апоптоза. Важно также отметить, корреляция устойчивости к окислительному стрессу и долголетия мышей не является основанием для формулирования причинно-следственных связей .
Показано, что рецептор IGF-1 участвует в регуляции продолжительности жизни: гетерозиготные мыши Igf1r +/- живут в среднем на 26 % дольше мышей дикого типа, при этом не наблюдается изменений в их питании, физической активности, фертильности, энергетическом метаболизме . Для мутантов Igf1r +/- развитие карликовости не свойственно. Эти мутанты демонстрируют также повышенную устойчивость к окислительному стрессу. Гомозиготные мыши lgf1r -/- не выживают.
Карликовые мыши Ames не имеют гормона роста, пролактина и тироид-стимулирующего гормона. Эти мыши гомозиготны по мутации Prop-1df транскрипционного фактора Prop-1, весят в три раза меньше нормальных мышей и живут примерно на 1 год дольше . Prop-1 экспрессируется специфически в гипофизе и необходим для экспрессии Pit-1, который в свою очередь необходим для развития гипофиза . Известно, что для мышей Ames, как и для мышей с ограниченной калорийностью питания , характерна низкая температура тела , а гиперэкспрессия гормона роста в мышах способствует проявлению признаков ускоренного старения . Почему карликовые мыши Ames живут дольше ещё не выяснено.