Interested Article - Трихлорэтилен

- 2021-02-01
- 1
| Трихлорэтилен | |
|---|---|

|
|
| Химическое соединение | |
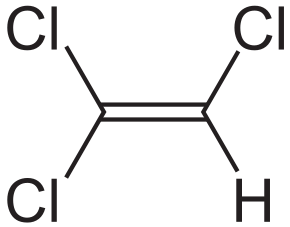
| Брутто-формула | C 2 HCl 3 |
| CAS | |
| PubChem | |
| DrugBank | |
| Состав | |
| Классификация | |
| АТХ | |
| Другие названия | |
| Трихлорэтилен для наркоза | |
Трихлорэтилен
(
Trichloraetylenum
), трихлорэтен —
хлорорганическое соединение
, бесцветная, прозрачная, подвижная, летучая жидкость со сладким запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Приблизительно в полтора раза плотнее воды.
Хорошо смешивается с органическими растворителями. Практически нерастворим в воде.
Трудногорюч (в нормальных условиях не воспламеняется и не взрывается).
Под действием света и воздуха разлагается с образованием
фосгена
и галогенсодержащих
кислот
, при этом приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 %
тимола
или 0.001%
фенола
.
Наркотик, токсичен.
Трихлорэтилен используется в промышленности в качестве растворителя и сырья для органического синтеза.
Физические свойства
В нормальных условиях трихлорэтилен находится в жидкой фазе. Замерзает при -73 °C, кипит при 86,7 °C .
Относительная плотность 1,462—1,466, 1,4642 .
Теплопроводность жидкости: 0,142 Вт/м·К при -40 °C, 0,138 Вт/м·К при 20 °C, 0,099 Вт/м·К при 80 °C . Теплопроводность пара: 0,00833 Вт/м·К при 86,7 °C .
Трихлорэтилен с водой образует азеотропную смесь с температурой кипения 73 °C (73 % трихлорэтилена, 7 % воды). В воде плохо растворяется, массовая доля в растворе от 0,017 % до 0,125 % в диапазоне температур 10–60 °C .
Химические свойства
Трихлорэтилен нельзя хранить на свету, так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена , который, в свою очередь, разлагается на фосген , угарный газ и хлороводород . Реакцию катализируют пары йода , минеральные кислоты и натронная известь . [ источник не указан 1305 дней ]
При окислении трихлорэтилена
озоном
образуются фосген,
хлористый водород
и
оксиды углерода
.
При окислении трихлорэтилена
кислородом
образуется окись трихлорэтилена и
дихлорацетилхлорид
.
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом , при этом происходит конденсация , полимеризация и осмоление .
Взаимодействует с фтором , хлором , бромом с образованием 1,2-дигалоген-1,2,2-трихлорэтанов. При хлорировании превращается в пентахлорэтан . С йодом не реагирует .
Получение
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования отходов производства винилхлорида или дихлорэтана (смесь хлорэтанов и хлорэтиленов ). Также получают из дихлорэтана и других отдельных соединений. Температуры каталитического хлорирования — от 350° до 450 °С в зависимости от состава сырья и катализатора .
Применение
Являясь хорошим растворителем, трихлорэтилен широко применяется в промышленности и быту. Используется для улучшения свойств инсектицидов . Применяется для обезжиривания металлов, для химической чистки тканей .
Используется в органическом синтезе для очистки полученных веществ и в качестве полупродукта. Добавляется в инсектициды для улучшения их свойств. Используется при синтезе лекарств, например, является промежуточным продуктом при синтезе левомицетина .
На основе трихлорэтилена разработаны удобные процессы получения разнообразных веществ. С его помощью изготавливают пестициды и инсектициды, среди его производных — огнезащитные агенты, пламегасители, регуляторы молекулярного веса в производстве синтетических материалов, полилактоны .
Биологическое действие
Трихлорэтилен является токсичным наркотическим веществом . Накапливается в организме, представляет опасность для сердечно-сосудистой и нервной систем, органов дыхания, зрения. При продолжительном воздействии на кожу вызывает её повреждение и дерматиты .
Трихлорэтилен до 500% повышает риск развития болезни Паркинсона
В организм человека трихлорэтилен, помимо проглатывания, может попадать при дыхании, проникает через кожу .
Предельно допустимая концентрация (ПДК) паров трихлорэтилена в атмосферном воздухе 1 мг/м³ (максимальная разовая — 4 мг/м³). Имеет третий класс опасности по ГОСТ 12.1.005. ПДК в воде — 0,06 мг/дм³ .
По данным ПДК в воздухе рабочей зоны равна 10 мг/м 3 среднесменная и 30 мг/м 3 максимально разовая. Порог восприятия запаха может достигать 538 мг/м 3 и 440-580 мг/м 3 . Соответственно, замена противогазных фильтров у СИЗОД по ощущению появления запаха в маске (как это советуют поставщики респираторов) приведёт к тому, что хотя бы часть работников будет менять фильтры запоздало. Необходимо использовать современные безопасные способы .
Ранее трихлорэтилен применялся для наркоза и обезболивания в качестве ингаляционного анестетика . В большинстве стран, в том числе в России, в этом качестве ныне не используется .
Ототоксичен (может ухудшать слух) .
Хранение
Трихлорэтилен хранится в сухом, прохладном, защищённом от света месте. [ источник не указан 1305 дней ]
Примечания
- ↑
- ↑ .
- , с. 687.
- , с. 686.
- ↑ , с. 673–674.
- ↑ , с. 688.
- ↑ , 3.4.2.
- Олег Пименов. . Сетевое издание "Волгоградская правда.ру" . ИД "Волгоградская правда" (20 марта 2023). Дата обращения: 12 июня 2023. 12 июня 2023 года.
- (Роспотребнадзор) . № 2121. Трихлорэтен (трихлорэтилен) // / утверждены А.Ю. Поповой . — Москва, 2018. — С. 144. — 170 с. — (Санитарные правила). 12 июня 2020 года.
- Torkelson T.R. and Rowe V.K. Halogenated Aliphatic Hydrocarbons Containing Chlorine, Bromine and Iodine // Patty’s Industrial Hygiene and Toxicology (англ.) / Clayton G.D. and F.E. Clayton (eds.). — 3ed ed., rev.. — New York: John Wiley & Sons, 1981. — Vol. 2B, Toxicology. — P. 3433–3601. — ISBN 978-0471079439 .
- Johannes May. Odor Thresholds of Solvents for Assessment of Solvent Odors in the Air [Geruchsschwellen von Losemitteln zur Bewertung von Losemittelgeruchen in der Luft] (нем.) // Staub, Reinhaltung der Luft. — Dusseldorf: VDI-Verlag GmbH, 1966. — September (vol. 26 ( H. 9 ). — S. 385–389. — ISSN .
- Капцов В.А. , Панкова В.Б. // Институт общей и неорганической химии им. Н.С. Курнакова РАН Химическая технология. — Москва: ООО "Наука и технологии", 2023. — Июнь ( т. 24 , № 6 ). — С. 230-240 . — ISSN . — doi : .
- ↑ Анестезиология : нац. рук. / Под ред. ак. РАМН А. А. Бунятяна, проф. В. М. Мизикова. — М. : ГЭОТАР-Медиа, 2013. — С. 306, 1022. — 1104 с. — 500 экз. — ББК 54.5я31 . — УДК . — ISBN 978-5-9704-2339-4 .
- Пьер Кампо, Кэти Маген, Стефан Габриэль, Анжела Мёллер, Эберхард Нис, Мария Долорес Соле Гомес и Эско Топпила. = Combined exposure to Noise and Ototoxic Substance (англ.) / Эусебио Риал Гонсалес и Джоанна Коск-Биенко (ред). — Люксембург: Европейское агентство по безопасности и гигиене труда, 2009. — 63 p. — ISBN 978-92-9191-276-612. — doi : . 9 декабря 2023 года. P. Campo, K. Maguin, S. Gabriel, A. Möller, E. Nies, M. Dolores, S. Gómez, E. Toppila. (англ.) / E.R. González, J. Kosk-Bienko. — Luxembourg: European Agency for Safety and Health, 2009. — 62 p. — (Literature reviews). — ISBN 978-92-9191-276-6 . — doi : .
- Ann-Christin Johnson and Thais C. Morata. (англ.) / Kjell Torén ed. — Arbete och Hälsa, Vetenskaplig skriftserie 2010; 44 (4) ISSN 0346-7821. — Gothenburg, Sweden: University of Gothenburg, 2010. — 190 p. — (Arbete och Hälsa / Work and Health). — ISBN 978-91-85971-21-3 . 11 мая 2023 года. от 24 мая 2023 на Wayback Machine
Литература
- Трегер Ю. А. Трихлорэтилен // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров . — М. : Большая Российская энциклопедия , 1998. — Т. 5: Триптофан — Ятрохимия. — С. [10—11] (стб. 12—13). — 783 с. — 10 000 экз. — ISBN 5-85270-310-9 .
- : Трихлорэтилен технический : Технические условия : Межгосударственный стандарт / Дата введения 1997-01-01. — 1997. — МКС 71.080.20. — ОКП 24 1226 0000.
- Кабердин, Р. В. : [ 23 июня 2020 ] / Р. В. Кабердин, В. И. Поткин // Успехи химии : журн. — 1994. — № 63. — С. 673–692. — УДК . — doi : .
- 2021-02-01
- 1