Interested Article - Окислы и гидроокислы (минералы)

- 2020-01-25
- 1
Окислы и гидроокислы — минералы , являющиеся соединениями металлов и неметаллов с кислородом . Общее количество свободных окислов в земной коре составляет около 17%. Из них на долю только одного кремнезема приходится 12,6%; окислы и гидроокислы железа составляют 3,9%. Из остальных наибольшее значение имеют окислы и гидроокислы алюминия , марганца , титана , хрома .
Свойства
Большинство минералов интенсивно окрашены в темные цвета, непрозрачны или просвечивают в осколках, имеют полуметаллический блеск и повышенную твердость (от 6 до 9). Плотность обычно прямо пропорциональна плотности составляющих элементов . Иногда отмечается магнитность. Среди минералов этого класса развит изоморфизм . В кристаллических структурах минералов этого класса катионы металлов находятся в окружении анионов кислорода (в окислах) или гидроксила (в гидроокислах).
Генезис и формы нахождения
Форма нахождения окислов в природе весьма разнообразна. Они встречаются в виде хорошо образованных кристаллов, сплошных зернистых масс, рыхлых, землистых или порошковатых, агрегатов, иногда скрытокристаллических, вплоть до коллоидных.
Основная часть окислов и гидроокислов сосредоточена в верхних слоях земной коры на границе с атмосферой , в которой имеется свободный кислород , а также в водных бассейнах — болотных, озерных и морских.
Окислы осадочного генезиса обычно порошковые, ноздреватые, простые агрегаты, конкреции , оолиты , натечные, почкообразные или сталактитовые формы. возникают они также и при магматическом, пегматитовом, гидротермальном процессах, региональном и контактовом метаморфизме .
В условиях выветривания многие из них устойчивы и накаливаются в россыпях.
Классификация
По химическим свойствам
- Кислотные или ангидриты (SiO 2 и другие).
- Основные (СаО и другие).
- Амфотерные (Al 2 O 3 и другие)
- Безразличные или индифферентные (редкие)
- Смешанные (FeFe 2 O 4 и другие).
По составу
Среди окислов выделяют: простые, сложные и гидроокислы.
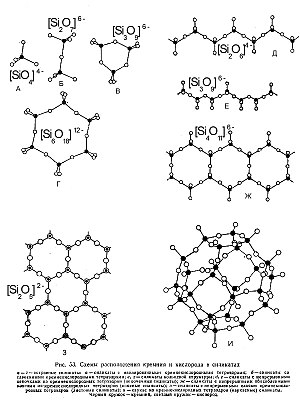
Простые окислы — это соединения одного элемента с кислородом . Широко распространены окислы двух-, трёх-, четырехвалентных элементов. Редки окислы с формулами А 2 О 3 , А 2 О 4 . Катион чаще всего представлен H, Si, Al, Fe, Ti, Mn, Sn, Pb, Mg, As, Sb, Bi, Cu, U и редко другими элементами.
Структура таких окислов очень проста. Координационные числа катионов обычно 4 или 6. Физические и оптические свойства простых окислов варьируются в широких пределах. Ряд простых окислов характерен для зон окисления, осадочных месторождений, эндогенных месторождений. Такие окислы как корунд , гематит и др., чаще всего встречаются в метаморфогенных месторождениях.
Сложные окислы — представляют собой соединения с кислородом двух или более металлов различной валентности. Поскольку окислы некоторых металлов, входящих в сложные окислы, являются ангидритами , эти сложные окислы могут рассматриваться как соли соответствующих кислот : Алюминаты , антимонаты , , , ниобаты , танталаты и т.п. Среди сложных окислов различного состава распространены окислы с формулой АВ 2 О 4 , в которых А = Mg, Fe 2+ , Zn, Mn 2+ , Ni, Be, Cu; В = Al, Fe 3+ , Cr, Mg 3+ . К ним относятся минералы рядов шпинели , магнетита , хромита и других. Весьма важные сложные окислы содержат Nb, Ta, Ti, U, Th, TR.
Сложные окислы обычно имеют твёрдость по шкале Мооса 4—8, повышенный удельный вес и высокий показатель преломления . Некоторые из них непрозрачны. Образуются они при различных процессах , однако, наиболее характерны для эндогенных, частично магматических, скарновых и высокотемпературных гидротермальных месторождений .
Гидроокислы - представляют собой соединения металлов с гидроксильной группой [OH] − , полностью или частично замещающую ионы кислорода в окислах. В них представлены катионы Fe 3+ , Al, Mg, Mn, Са, В, W и некоторых других металлов.
Большинство гидроокислов имеют слоистую структуру, характеризующуюся гексагональной или близкой к ней плотнейшей упаковкой ионов [OH] − . Большая часть гидроокислов образует пластинчатые кристаллы с совершенной спайностью , параллельной слоям структуры. Твердость по шкале Мооса 2—5, удельный вес малый. Образуются при низких температурах. Наиболее характерны для экзогенных месторождений и зон окисления.
Выделяют следующие группы минералов
- Окислы меди ( куприт )
- Окислы и гидроокислы алюминия ( Корунд , диаспор , бёмит , гидраргиллит , боксит , шпинель )
- Окислы и гидроокислы железа, окислы титана и хрома ( гематит , магнетит , гётит , лепидокрокит , лимонит , рутил , ильменит , хромит )
- Окислы и гидроокислы марганца ( пиролюзит , манганит , псиломелан , вад )
- Окислы и гидроокислы олова, урана, тантала и ниобия ( касситерит , уранинит , колумбит , танталит , пирохлор , микролит )
- Окислы мышьяка, сурьмы, висмута, молибдена и вольфрама ( арсенолит , , , бисмит , , ).
Использование
В основном окислы и гидроокислы являются важными рудами на Fe, Al, Mn, Cr, Sn, U, Cu и используются в ювелирном деле например разновидности кварца ( цитрин , гелиотроп , горный хрусталь , аметист ), халцедона ( агат ), корунда ( сапфир , рубин ).
Примечания
- ↑ М.И. Каденская. Руководство к практическим занятиям по минералогии и петрографии. — Москва: Просвещение, 1976. — С. 81—82. — 240 с.
Литература
- Геологический словарь, Т. 2. — М. : Недра, 1978.
- Минералогия и петрография,. — М. : Государственное научно-техническое издательство литературы по геологии и охране недр, 1958. — С. 143-157.
- 2020-01-25
- 1