Лейкоцитарная формула
- 1 year ago
- 0
- 0
Нейтрофи́лы , или нейтрофи́льные гранулоци́ты , или нейтрофи́льные сегментоя́дерные гранулоци́ты , или полиморфонуклеа́рные нейтрофи́лы , — наиболее многочисленная группа гранулоцитов , на долю которой приходится от 40 % до 70 % всех лейкоцитов у человека . Нейтрофилы являются частью врождённого иммунитета , их основная функция — фагоцитоз патогенных микроорганизмов ( бактерий , грибков , простейших ) и продуктов распада тканей организма .
Нейтрофилы представляют собой очень подвижные клетки, которые проникают даже в те ткани, которые недоступны для других лейкоцитов. В зависимости от морфологии ядра нейтрофилы подразделяют на палочкоядерные (незрелые) и сегментоядерные (зрелые) нейтрофилы . Развитие нейтрофилов находится под контролем цитокинов , прежде всего , а также GM-CSF , IL-3 и IL-6 . В условиях воспалительного ответа количество нейтрофилов увеличивается под действием и .
Нейтрофилы являются основными фагоцитами кровотока , но в ходе острого воспаления интенсивно мигрируют в очаг воспаления . Они проникают через стенки кровеносных сосудов и движутся по градиенту различных провоспалительных молекул в ходе хемотаксиса . Нейтрофилы — самые многочисленные клетки, входящие в состав гноя , именно они придают ему беловатый или желтоватый цвет .
Нейтрофилы — наиболее многочисленный подтип лейкоцитов у человека; каждый день в организме человека образуется порядка 10 11 новых нейтрофилов. В норме количество нейтрофилов в литре крови составляет от 2—2,5 до 7,5 миллиардов клеток. У людей африканского и средневосточного происхождения количество нейтрофилов может быть меньше 2,5 миллиардов на литр . В кровотоке находится лишь 1—2 % зрелых нейтрофилов, все остальные локализованы в тканях. Кроме того, в крови здорового человека присутствуют незрелые палочкоядерные нейтрофилы в количестве 0,04—0,3 × 10 9 на литр, что соответствует 1—6 % всех нейтрофилов . У человека повышение содержания палочкоядерных нейтрофилов в крови свидетельствует об остром воспалении, лейкозе или повреждении костного мозга , однако у некоторых животных существенная доля незрелых нейтрофилов в крови является нормой .
В мазках крови нейтрофилы имеют диаметр от 12 до 15 мкм . В суспензии человеческие нейтрофилы достигают 7—9 мкм в диаметре . Неактивированные нейтрофилы, плавающие в кровотоке, имеют сферическую форму; после активации форма нейтрофилов меняется, становится амёбоидной , появляются псевдоподии , с помощью которых нейтрофилы могут захватывать антигены .
На поверхности нейтрофилов присутствуют молекулы CD13 , служащей рецептором для некоторых вирусов , CD14 (рецептор липополисахарида ), β 2 - интегрины ( LFA-1 , Mac-1 и p155/95), Fc-рецепторы ( и CD16 ), ( , Mac-1, ) и рецепторы факторов хемотаксиса. Нейтрофилы постоянно экспрессируют главный комплекс гистосовместимости I класса ( ), а под действием некоторых цитокинов, таких как GM-CSF, начинают экспрессировать . Нейтрофилы несут рецепторы для ключевых факторов, влияющих на их развитие, миграцию и активацию: G-CSF (главный регулятор развития нейтрофилов), IL-17 и IL-23, основного фактора хемотаксиса IL-8 (рецепторы CXCR1 и CXCR2 ), а также хемокина SDF-1 , определяющего связь нейтрофилов с тканями (соответствующий ему рецептор известен как CXCR4 ) .
У человека выделяют пять групп антигенов нейтрофилов, которые обозначают HNA 1—5. Три антигена группы HNA-1 (a, b, c) располагаются на Fc-рецепторе CD16. Единственный антиген группы HNA-2, HNA-2a, входит в состав поверхностного гликопротеина CD177 . Антигены группы HNA-3, a и b, входят в состав белка . Группы HNA-4 и HNA-5 содержат по два антигена, a и b, которые располагаются на интегрине β 2 .
Морфология ядра нейтрофилов


Подобно базофилам и эозинофилам , зрелые нейтрофилы имеют дольчатое клеточное ядро из 2—5 сегментов, соединённых тонкими перемычками. У некоторых животных ядро зрелых нейтрофилов не имеет отчётливой сегментации . По мере созревания нейтрофила ядрышко исчезает (исчезновение ядрышка происходит лишь у некоторых типов дифференцированных клеток, имеющих ядро). Центр ядра составляет эухроматин , а гетерохроматин сосредоточен на периферии. У женщин некоторые нейтрофилы несут инактивированную X-хромосому в виде тельца Барра , которое выглядит как придаток в виде барабанной палочки у одного из сегментов ядра . Поскольку промоторы многих генов в ядре нейтрофила недоступны для дифференцировочных факторов, экспрессия генов и возможность к биосинтезу макромолекул у нейтрофилов ограничены. Тем не менее нейтрофилы всё же сохраняют способность к биосинтезу, хотя и ограниченному. У незрелых палочкоядерных нейтрофилов ядро не подразделено на сегменты, хотя содержит уплотнённый хроматин .
Аппарат Гольджи , как правило, слабо развит, митохондрии и рибосомы редки, шероховатый эндоплазматический ретикулум (ЭПР) отсутствует. В цитоплазме имеется от 50 до 200 гранул, из которых приблизительно 10—20 % (по некоторым оценкам, до трети) составляют азурофильные гранулы , оставшиеся 80—90 % приходится на специфические гранулы. Азурофильные гранулы окружены одинарной мембраной , они более крупные, чем специфические, и имеют диаметр около 0,4 мкм, окрашиваются в фиолетово-красный цвет. Они представляют собой первичные лизосомы , содержат электронно -плотную сердцевину и ферменты , активные при низких значениях pH : кислую фосфатазу , , миелопероксидазу , которая продуцирует из перекиси водорода молекулярный кислород , имеющий антибактериальные свойства, , , , β-галактозидазу , , , лизоцим , нейтральные протеазы ( катепсин G , эластаза , , ). Кроме того, азурофильные гранулы содержат антимикробные пептиды из числа дефензинов , , гранулофизин, лактоферрин , кислые гликозаминогликаны . Поскольку в ходе дифференцировки нейтрофилов в костном мозге азурофильные гранулы появляются раньше специфических, их также называют первичными гранулами . азурофильных гранул — миелопероксидаза и мембранная молекула CD63 .
, или вторичные гранулы — более мелкие (диаметр около 20 мкм), светлые, многочисленные. Они электронно-прозрачны, но иногда содержат кристаллоид. В специфических гранулах содержатся белки с и бактерицидными свойствами — лизоцим, щелочную фосфатазу , лактоферрин , а также белок , связывающий витамин B 12 . В специфических гранулах в больших количествах содержится фермент NADPH-оксидаза , которая катализирует образование активных форм кислорода , выступающих в роли главных бактерицидных факторов фагоцитов . Кроме того, в состав специфических гранул входят разнообразные ферменты, разрушающие внеклеточный матрикс , такие как коллагеназы . Молекулярными маркерами специфических гранул являются лактоферрин и мембранная молекула CD66 .
Помимо первичных и вторичных гранул в нейтрофилах присутствуют третичные желатиназные и секреторные гранулы, или везикулы . Желатиназные гранулы содержат , также известную как матриксная металлопротеиназа 9 (MMP9). Они мельче специфических гранул и легче подвергаются экзоцитозу . В мембранах и специфических, и желатиназных гранул имеется флавоцитохром b558, который входит в состав NADPH-оксидазы. Секреторные везикулы содержат щелочную фосфатазу и несут на своей поверхности Fc-рецептор CD16, рецепторы комплемента (в том числе CD35), а также интегрины CD11b / CD18 , CD11c /CD18 и молекулы CD15 и CD14 . После того как в ходе экзоцитоза мембрана секреторной везикулы встроится в клеточную мембрану нейтрофила, перечисленные рецепторы могут быть моментально использованы клеткой , что может резко изменить её фенотип .
В таблице ниже перечислены основные компоненты мембран и матрикса гранул нейтрофилов .
| Компартмент гранулы | Азурофильные (первичные) гранулы | Специфические (вторичные) гранулы | Желатиназные (третичные) гранулы | Секреторные гранулы |
|---|---|---|---|---|
| Мембрана | CD63 , CD68 | CD15, CD66, CD67, , CD120 , b558 | CD11b/CD18, FPR, b558 | CD11b/CD18, CD13, CD14, CD16, FPR, CD35 |
| Матрикс | , катепсин G, эластаза, азуроцидин, лизоцим, BPI, α-дефензины | Лизоцим, кателицидин, BPI, , лактоферрин, фосфолипаза A2 , коллагеназа | Желатиназа B | Азуроцидин, альбумин , щелочная фосфатаза |
Нейтрофилы содержат гликоген , и основную роль в получении энергии у нейтрофилов играет гликолиз . Цикл Кребса и окислительное фосфорилирование вносят меньший вклад в энергообеспечение нейтрофила, о чём свидетельствует небольшое количество митохондрий у данного типа клеток. Способность нейтрофилов выживать в анаэробных условиях очень важна для их функционирования, поскольку позволяет им убивать и фагоцитировать бактерии даже в бедных кислородом тканях, например, в повреждённых или некротизированных тканях .

Нейтрофилы образуются в костном мозге из гемопоэтических стволовых клеток . Гемопоэтическая стволовая клетка даёт начало клетке — родоначальнице гранулоцитарного, эритроцитарного , моноцитарного и мегакариоцитарного рядов гемопоэза, которая, в свою очередь, дает начало олигопотентной клетке-предшественнице моноцитов и нейтрофилов. От неё происходит унипотентная клетка-предшественница нейтрофилов, дающая начало миелобластам . Композиция её поверхностных маркеров описывается как CD34 + CD33 +, а также рецепторы для GM-CSF, G-CSF, IL-1, IL-3, IL-6, , IL-12 . Далее последовательность клеток-предшественников выглядит следующим образом: миелобласт → промиелоцит → нейтрофильный миелоцит → метамиелоцит → палочкоядерный нейтрофил → сегментоядерный нейтрофил. Первичные гранулы появляются на стадии промиелоцитов, вторичные — на стадии миелоцитов. До стадии метамиелоцитов предшественники делятся митозом , а метамиелоциты и последующие стадии лишены способности к делению. На стадии метамиелоцитов увеличивается количество специфических гранул в цитоплазме, дальнейшее созревание ядра приводит появлению палочкоядерных нейтрофилов. Сегментация ядра палочкоядерных нейтрофилов приводит к их преобразованию в зрелые сегментоядерные нейтрофилы. Полный период развития нейтрофилов у человека составляет около 14 суток, из которых 7,5 суток приходятся на пролиферацию , а 6,5 — на постмитотическую дифференцировку . У взрослого человека за сутки из костного мозга в кровь выходит от 5 × 10 10 до 10 11 зрелых нейтрофилов .
Срок жизни неактивированного нейтрофила в кровотоке составляет, по разным оценкам, от 5 до 135 часов . При активации нейтрофилы приобретают способность протискиваться через эндотелий сосудов и мигрируют в ткани, где они живут от одного до двух дней. Около 30 % нейтрофилов, покидающих кровоток, мигрируют в костный мозг и печень , 20 % направляются в лёгкие , 15 % — в селезёнку . Главные факторы хемотаксиса нейтрофилов, направляющие их перемещение в ткани, — и IL-8. В процессе миграции нейтрофилов участвуют молекулы адгезии , а именно, β 2 -интегрины, P - и E-селектины , а также секретируемый нейтрофилами фермент . Нейтрофилы гораздо многочисленнее долгоживущих макрофагов , и патоген, проникнувший в организм, прежде всего сталкивается именно с нейтрофилами. Через 3—5 суток пребывания в тканях нейтрофилы подвергаются апоптозу и поглощаются резидентными макрофагами. Некоторые исследователи считают, что короткий срок жизни нейтрофилов является эволюционной адаптацией . Со смертью фагоцита погибают патогены, сохраняющиеся в нём, что защищает организм. Кроме того, ввиду высокой токсичности веществ, выделяемых нейтрофилами для борьбы с инфекцией , по отношению к тканям организма, быстрая гибель нейтрофилов обеспечивает действие противомикробных веществ только в очаге воспаления и защищает остальные ткани организма . Существуют сведения, указывающие на возможность перехода нейтрофилов в тканях в долгоживущую форму и даже в макрофаги .
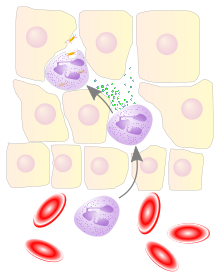
Воспалённые или повреждённые участки соединительной ткани требуют немедленной миграции разнообразных лейкоцитов, в том числе нейтрофилов, в очаг повреждения для удаления патогенных микроорганизмов и восстановления ткани. Наиболее хорошо процесс миграции в ткани изучен для нейтрофилов, которые прибывают в очаг воспаления первыми, существенно быстрее моноцитов, и способны развивать защитные метаболические реакции (в частности, « », сопровождающийся продукцией активных форм кислорода) в течение секунд. Активация нейтрофилов сопровождается в первую очередь высвобождением содержимого секреторных гранул. При развитии локального воспаления макрофаги, активированные бактериями или повреждениями ткани, выделяют , такие как IL-1 или фактор некроза опухоли α (TNF-α). Также к факторам хемотаксиса нейтрофилов относят компоненты комплемента , вещества, выделяемые тучными клетками , , эндотоксины и бактериальные пептиды , а также наполненные лизосомы, выходящие в ткань при распаде погибших нейтрофилов и макрофагов . Под действием провоспалительных цитокинов в эндотелиальных клетках, выстилающих ближайшие к очагу воспаления посткапиллярные венулы , увеличивается количество селектинов на поверхности, обращённой в просвет сосуда. Нейтрофилы, циркулирующие в посткапиллярных венулах и имеющие подходящий набор поверхностных гликопротеинов, связываются с селектинами на поверхности эндотелиальных клеток. На данном этапе связывание с эндотелием непрочное, и нейтрофилы продолжают «катиться» по поверхности эндотелия. Провоспалительные цитокины запускают экспрессию интегринов в катящихся нейтрофилах и лигандов интегринов, известных как ICAM-1 , на поверхностях эндотелиальных клеток. В то же время межклеточные контакты между клетками эндотелия ослабляются, и эндотелий становится более проницаемым. За счёт интегринов нейтрофилы прочно связываются с эндотелием и прекращают качение, и в конечном счёте приступают к прохождению через эндотелий с помощью псевдоподий (этот процесс известен как диапедез ). Проникновение нейтрофилов через эндотелий облегчается благодаря длинному и сегментированному ядру. Прохождение нейтрофилов через эндотелий и дальнейшая миграция к очагу воспаления стимулируются хемокинами . Базальные мембраны нейтрофилы преодолевают благодаря выделению содержимого желатиназных гранул .
Координированное перемещение нейтрофилов в очаг острого воспаления называют . Масштаб роения и его длительность определяются многими факторами, среди которых размер повреждённой области ткани и наличие патогенов . Явление роения нейтрофилов было изучено преимущественно у мышей на ткани уха и у рыбок данио-рерио .

Активированные нейтрофилы при встрече с микроорганизмами поглощают их с помощью псевдоподий, и микроорганизм оказывается внутри фагосомы . В течение нескольких секунд после активации нейтрофила изменяется его мембранный потенциал , в клетку входят ионы натрия и кальция , изменяется . Примерно через 30 секунд после поглощения частицы специфические гранулы сливаются с фагосомой, изливая в неё своё содержимое, после чего фагосома дополнительно закисляется с помощью мембранных протонных помп . С закисленными фагосомами сливаются азурофильные гранулы (примерно через 1—3 минуты после поглощения частицы). В ходе фагоцитоза в нейтрофиле образуются активные формы кислорода, такие как супероксид - анион и перекись водорода, и другие компоненты гранул с бактерицидными свойствами. Активные формы кислорода используются для уничтожения бактериальной клетки, наряду с содержимым специфических и азурофильных гранул. Белок лактоферрин, входящий в состав специфических гранул, не убивает бактерию напрямую, а прочно связывает ионы железа , делая их недоступными для бактерии и, в результате, приводя к её смерти. Содержимое гранул (в частности, азурофильных) может высвобождаться в ходе , после которой восстановления гранул не происходит. Комбинация описанных механизмов способна убить практически любую бактерию, и погибшие бактериальные клетки впоследствии расщепляются лизосомными ферментами. Наиболее чувствительны к компонентам гранул нейтрофилов дрожжи ( Candida ) и бактерии из числа стрептококков и стафилококков . Нейтрофилы, погибшие апоптозом, бактерии, полуразрушенные останки клеток и тканевая жидкость формируют густой гной белого или жёлтого цвета .

Ещё одна форма противомикробной активности нейтрофилов заключается в особом типе программируемой клеточной гибели , характерном для нейтрофилов, — нетозе . При нетозе погибающий нейтрофил выбрасывает свою ДНК наружу в виде так называемых внеклеточных ловушек нейтрофилов (от англ. neutrophil extracellular traps, NETs ). Внеклеточные ловушки нейтрофилов состоят из хроматина и сериновых протеаз и способны иммобилизовать и убивать микробные клетки . Таким образом, внеклеточные ловушки нейтрофилов также противодействуют распространению клеток патогенов по тканям. При сепсисе массовый нетоз происходит непосредственно в кровеносных сосудах . Образование внеклеточных ловушек нейтрофилов может вносить вклад в развитие ряда воспалительных заболеваний, таких как преэклампсия , а их образование в кровеносных сосудов может приводить к формированию тромбов , в том числе в коронарных артериях . В 2018 году было показано, что один и тот же нейтрофил может подвергаться и апоптозу, и нетозу одновременно; этот вид программируемой клеточной гибели нейтрофилов получил название апонетоз .
Многие исследователи выделяют две функционально различные субпопуляции нейтрофилов на основании различных интенсивности образования активных форм кислорода, проницаемости мембраны, активности ферментов гранул и способности к инактивации. Нейтрофилы с повышенной проницаемостью мембран называют нейтрофилами-киллерами. Нейтрофилы-киллеры интенсивно генерируют активные формы кислорода и инактивируются после взаимодействия с субстратом. Нейтрофилы второй субпопуляции образуют активные формы кислорода менее интенсивно, не прикрепляются к субстрату и не инактивируются .
Активность нейтрофилов зависит от возраста организма человека. У новорождённого нет адекватной продукции нейтрофилов, а в старческом возрасте способность нейтрофилов к фагоцитозу ограничена .
Нейтрофилы экспрессируют и продуцируют широкий спектр цитокинов, среди которых хемокины, , провоспалительные цитокины ( IL-1α , IL-1β , IL-6, IL-7, IL-18 , и другие), иммунорегуляторные цитокины (IL-12, , , , и другие), противовспалительные цитокины ( IL-1ra , TGFβ1 , ), факторы ангиогенеза и фиброгенеза ( VEGF , BV8, , , , , ангиопоэтин ), цитокины суперсемейства фактора некроза опухоли (TNF) и некоторые другие цитокины, такие как PBEF , , мидкин , , , эндотелин . За счёт выделения разнообразных цитокинов нейтрофилы могут быть вовлечены в процессы, не связанные с иммунной защитой, такие как гемопоэз, ангиогенез и заживление ран. Кроме того, нейтрофилы могут участвовать в развитии некоторых аутоиммунных и злокачественных заболеваний .
Иммуносупрессорные популяции нейтрофилов задействованы в поддержании иммунологической толерантности при беременности . В частности, иммуносупрессорные нейтрофилы низкой плотности могут подавлять пролиферацию CD4 + и CD8 + T-лимфоцитов , подвергая их воздействию активных форм кислорода. Кроме того, они подавляют цитотоксическую активность естественных киллеров и экспрессию Toll-подобных рецепторов на моноцитах . Нейтрофилы, располагающиеся в во время второго триместра беременности , стимулируют в ней дополнительный ангиогенез .

Состояние, при котором количество нейтрофилов снижено, называется . Нейтропения может быть наследственной или приобретённой, как при некоторых видах апластической анемии или лейкозов . Нейтропения может развиться вследствие приёма определённых препаратов, в частности, противораковой химиотерапии . Пациенты с нейтропенией отличаются повышенной уязвимостью к инфекционным заболеваниям бактериальной и грибковой природы. Чаще всего пациенты с нейтропенией страдают от таких заболеваний, как воспаление подкожной жировой клетчатки , фурункулёз , пневмония и септицемия . Степень нейтропении определяют с помощью параметра, известного как ( англ. Absolute neutrophil count, ANC ). Состояние с ANC < 1500 клеток / мм³ считается нейтропенией, а с ANC < 500 клеток / мм³ — тяжёлой нейтропенией .

Состояние, противоположное нейтропении, при котором количество нейтрофилов в крови повышено, называют нейтрофилией . Наиболее частой причиной нейтрофилии являются бактериальные инфекции, особенно сопровождающиеся гнойным воспалением . Повышение уровня нейтрофилов происходит при любом остром воспалении, поэтому нейтрофилия может появиться в результате инфаркта миокарда или ожога , а также аппендицита и спленэктомии . Уровень нейтрофилов может повышаться при некоторых злокачественных заболеваниях крови , таких как хронический миелоидный лейкоз , при котором происходит неконтролируемая пролиферация лейкоцитов .
Нейтрофилы, будучи иммунными клетками, принимают участие во взаимодействии с клетками опухолей . Нейтрофилы, инфильтрованные в опухоль, имеют повышенную, по сравнению с нейтрофилами в обычных тканях, продолжительность жизни. Нейтрофилы могут играть ведущую роль в онкогенезе за счёт взаимодействия с другими иммунными клетками , реагирующими на появление и рост опухоли. Нейтрофилы могут стимулировать пролиферацию опухолевых клеток и ангиогенез в опухоли, активировать метастазирование и подавлять иммунный ответ на злокачественные клетки. В то же время нейтрофилы могут обладать и противоопухолевой активностью .
Известно несколько наследственных расстройств, связанных с дисфункцией нейтрофилов. В некоторых случаях подвижность нейтрофилов снижена за счёт нарушений в полимеризации актина , а при недостаточной экспрессии гена, кодирующего NADPH-оксидазу, нейтрофилы теряют способность вырабатывать перекись водорода и гипохлорит , что уменьшает их противомикробные свойства. Дети, страдающие от таких наследственных нарушений, сильнее подвержены бактериальным инфекциям . Наследственная , связанная с мутациями в гене , кодирующем миелопероксидазу, рассматривается как первичный иммунодефицит .
Недостаточная или избыточная активность ряда белков, входящих в состав гранул нейтрофилов, приводит к болезненным состояниям. При наследственной болезни, известной как , эластаза в составе гранул нейтрофилов недостаточно ингибируется , что приводит к сильнейшим повреждениям тканей при воспалительных процессах, в частности, при хронической обструктивной болезни лёгких . Повышенная активность эластазы нейтрофилов может привести к разрушению лёгочного барьера и острому респираторному дистресс-синдрому . Эластаза нейтрофилов влияет на активность макрофагов, разрушая их Toll-подобные рецепторы и подавляя синтез цитокинов через ингибирование перемещения в ядро транскрипционного фактора NF-κB . При периодической болезни мутации в гене , кодирующем белок пирин, экспрессирующийся преимущественно в нейтрофилах, могут привести к хроническому острому воспалению, что выражается в лихорадке , артралгии , перитоните и, в конце концов, может стать причиной амилоидоза . Имеются данные о связи сниженной активности нейтрофилов, связанной с нарушениями активности миелопероксидазы и дегрануляции, с гипергликемией .
Нейтрофилы связаны с развитием многих хронических воспалительных заболеваний, в том числе аутоиммунных. Они поддерживают хроническое воспаление при системной красной волчанке , псориазе , , АНЦА-ассоциированном системном васкулите , связанном с образованием аутоантител к компонентам цитоплазмы нейтрофилов, ревматоидном артрите , идиопатическом юношеском артрите и (от англ. pyogenic arthritis-pyoderma gangrenosum-acne syndrome ) .

Впервые нейтрофилы описал французский исследователь Жан-Батист Сенак , который в 1749 году обнаружил белые клетки в гное. В 1843 году английский врач заметил, что белые клетки в составе гноя происходят от лейкоцитов, которые просочились через кровеносные сосуды. В 1845 году английский врач и физиолог сообщил, что лейкоз обусловлен накоплением белого гноя в кровеносных сосудах, но уже в 1847 году это представление было опровергнуто Рудольфом Вирховым , который показал, что патологические клетки при лейкозе происходят не из гноя, а из самой крови. Первое точное морфологическое описание различных гранулоцитов, в том числе и нейтрофилов, было выполнено Максом Шульце в 1865 году. Кроме морфологических описаний гранулоцитов, Шульце описал и фагоцитоз . Кроме того, в 1876 году фагоцитоз был отмечен Уильямом Ослером
Фагоцитоз был детально изучен и назван Ильёй Ильичом Мечниковым в 1882 году, когда им же была установлена роль фагоцитов в защите от бактерий . В 1879—1880 годах Пауль Эрлих опубликовал несколько работ, в которых детально описал морфологию белых клеток крови. Окрашивание кислыми и щелочными красителями позволило ему выявить соответственно эозинофилы и базофилы , а также тучные клетки . Впоследствии с помощью окрашивания нейтральными красителями он визуализировал сегментоядерные нейтрофилы и их гранулы (за что нейтрофилы и получили своё название). Первоначально Эрлих назвал нейтрофилы «клетками с полиморфными ядрами». Также он описал некоторые аспекты появления, функционирования и дальнейшей судьбы эозинофилов и нейтрофилов . В 1908 году Пауль Эрлих и Илья Мечников разделили Нобелевскую премию по физиологии и медицине .