Interested Article - Транспортно-матричная РНК

- 2020-04-15
- 1

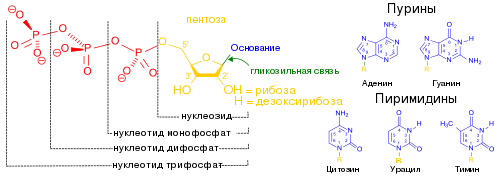
Тра́нспортно-ма́тричная РНК (тмРНК, англ. Transfer-messenger RNA ), также известна как 10Sa-РНК и SsrA-РНК , — небольшая РНК длиной от 260 до 430 нуклеотидов , которая участвует в высвобождении рибосом , «застрявших» во время трансляции проблемных участков мРНК , а также разрушении получившихся в ходе неполной трансляции дефектных пептидов . Механизм высвобождения рибосомы с дефектной мРНК при участии тмРНК получил название транс -трансляции. Первая тмРНК была обнаружена в 1994 году у кишечной палочки Escherichia coli , и с тех пор тмРНК были описаны у разных групп бактерий . Гены тмРНК обнаруживаются в геномах практически всех бактерий и многих органелл .
Структура и синтез
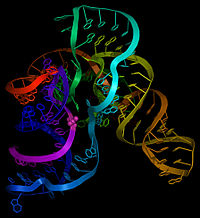
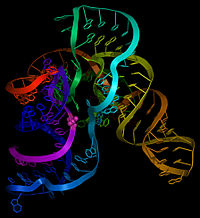
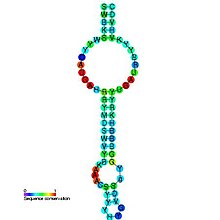
Как следует из названия, тмРНК сочетает в себе свойства и тРНК , и мРНК, и в состав молекул тмРНК входят домены, структурно и функционально близкие к тРНК и мРНК. Тем не менее, тмРНК крупнее тРНК почти в пять раз. Высококонсервативные концевые участки молекулы образуют структуру, похожую на акцепторный стебель тРНК. Рядом с этими участками находятся последовательности, похожие на T- и D-петли тРНК и имеющие соответствующие модификации нуклеотидов . В совокупности эти участки образуют структуру, похожую на L-форму тРНК, однако, лишённую антикодона .
мРНК-подобный домен представлен центральной частью молекулы тмРНК, в которой располагается открытая рамка считывания , кодирующая пептид из 10—27 аминокислот и заканчивающаяся стоп-кодоном . Старт-кодона она не имеет, поэтому её обычная трансляция невозможна. Допускается укорочение или удлинение открытой рамки считывания на один кодон без нарушения функционирования транс -трансляции . С 5'-конца к мРНК-подобному домену прилегает последовательность, формирующая псевдоузел , а с 3'-конца — ещё три псевдоузла. Псевдоузлы играют важную роль во взаимодействии молекулы с рибосомой и факторами трансляции . Псевдоузлы, как правило, консервативны, но иногда они подвергаются изменениям, например, у цианобактерий последний псевдоузел заменён двумя тандемно расположенными меньшими псевдоузлами. В ходе транс -трансляции спаривание оснований в области трёх последних псевдоузлов разрушается .
В некоторых случаях в тмРНК наблюдается круговые пермутации (то есть фрагмент гена тмРНК, кодирующего одну из двух функциональных частей тмРНК, повернут в обратную сторону, из-за чего тмРНК складывается из двух отдельных фрагментов). Они характерны для всех α-протеобактерий и примитивных митохондрий протистов группы , двух групп цианобактерий ( род и клады , содержащей род Prochlorococcus и многие виды рода ), а также для некоторых , например, . Такие тмРНК состоят из двух частей: акцепторной и кодирующей, кроме того, они никогда не содержат более двух псевдоузлов .
Типичная клетка E. coli содержит около 500 копий тмРНК. Как и многие другие РНК, тмРНК после транскрипции подвергается процессингу , который заключается в удалении нескольких нуклеотидов с обоих концов под действием нескольких РНКаз , в том числе , которая также функционирует в созревании тРНК, а также экзонуклеаз РНКазы T и . Процессированная тмРНК связывается с белком SmpB, и образовавшийся комплекс распознаётся , которая присоединяет к 3'-концу тмРНК один остаток аланина . В отличие от многих других аминоацил-тРНК-синтетаз, аланиновая аминоацил-тРНК-синтетаза не распознаёт антикодон аминоацилируемой тРНК, благодаря чему она может работать и с тмРНК, лишённой антикодона . Третья пара оснований акцепторного стебля — не уотсон-криковская, G - U , и именно она распознаётся аланин-тРНК-синтетазой .
Иногда тмРНК кодируются мобильными генетическими элементами , например, они имеются у 10 % . Многие мобильные элементы разрушают гены тмРНК. К их числу относятся самосплайсирующиеся , элементы риккетсий , а также кодирующие интегразу .
В 2015 году была запущена база данных tmRNA Website, содержащая последовательности тмРНК, их выравнивания и аннотации, а также последовательности белка SmpB, тесно связанного с тмРНК .
Функционирование

SmpB — важнейший белок , связывающийся с тмРНК. Он столь же сильно консервативен среди бактерий, как и тмРНК. SmpB связывается с тРНК-подобным доменом тмРНК и препятствует разрушению тмРНК, пока она находится вне рибосомы , а также усиливает аминоацилирование тмРНК. С тРНК-подобным доменом взаимодействует глобулярный домен белка , благодаря чему компенсируется отсутствие у тмРНК нижней половины L-формы тРНК. Таким образом, тРНК-подобный домен имитирует тРНК в комплексе с SmpB. В рибосоме E. coli имеется по меньшей мере два сайта связывания SmpB, один в A-сайте, другой — в её P-сайте, благодаря чему комплекс тмРНК и SmpB, имитирующий тРНК, сохраняется и в рибосоме. Кроме SmpB, с тмРНК могут связываться рибосомный белок S1 и фактор элонгации трансляции . S1 не является необходимым для первых событий транс -трансляции (до формирования новой пептидной связи ), однако может быть важен для последующих этапов. EF-Tu в комплексе с ГТФ связывается с тмРНК, несущей остаток аланина, и доставляет её в А-сайт рибосомы, как при обычной трансляции .
Остановка рибосом на мРНК может происходить при отсутствии в ней стоп-кодона, при наличии в ней группы кодонов, для которых в клетке нет аминоацилированных тРНК, а также в тех случаях, когда мРНК образует стабильную трёхмерную структуру, мешающую продвижению рибосомы. Впрочем, отмечается, что некоторые мРНК подвергаются транс -трансляции существенно чаще, чем другие, причём у разных видов бактерий активной транс -трансляции подвергаются разные мРНК. После доставки комплекса тмРНК с SmpB происходит гидролиз ГТФ до ГДФ , вызывающий конформационные перестройки, благодаря которым EF-Tu в комплексе с ГДФ покидают рибосому, а несущий аланин тРНК-подобный домен, связанный с SmpB, оказывается в А-сайте. В ходе этого процесса С-концевой хвост SmpB взаимодействует с каналом для мРНК, расположенным за А-сайтом. Если в канале есть мРНК, взаимодействие не произойдёт. После этого пептид, синтезированный до остановки рибосомы, переносится на аланиновый остаток тмРНК. Образовавшийся комплекс из пептида, тРНК-подобного домена и SmpB перемещается из А-сайта в Р-сайт рибосомы, причём для перемещения связь С-концевого хвоста SmpB с каналом для мРНК должна разорваться. Далее происходит конформационная перестройка С-концевого хвоста SmpB, благодаря которой может начаться трансляция тмРНК . Иными словами, вместо проблемной мРНК рибосома начинает транслировать открытую рамку считывания в тмРНК. При первой транслокации рибосомы мРНК при содействии фактора EF-G покидает рибосому, и её разрушают специфические РНКазы . Синтез белка, при котором последовательно используются две кодирующие РНК, называется транс -трансляцией. Когда рибосома завершает трансляцию тмРНК, образуется химерный пептид, C-конец которого считан с тмРНК. Он играет роль метки, распознаваемой бактериальными системами протеолиза , которые разрушают дефектный пептид .
Мутации тмРНК, делающие невозможным аминоацилирование, блокируют и способность тмРНК к кодированию пептида-метки, поэтому функционирование в роли тРНК преобладает над кодирующей способностью .
Для поступления в А-сайт рибосомы обычной тРНК необходимо взаимодействие с мРНК её антикодона. Однако у тмРНК антикодона нет, и, по-видимому, нижнюю часть тРНК, содержащую антикодон, имитирует SmpB. Для распознавания рибосомы, которую необходимо высвободить с транскрипта, необходим гидролиз ГТФ. Только после него SmpB принимает такую конформацию, которая позволяет ему оценить заполненность канала для мРНК .
Таким образом, транс -трансляция необходима для предотвращения накопления в клетке усечённых пептидов, а также дефектных мРНК. Так, РНКаза R связывается с SmpB в комплексе с тмРНК. Она активируется в условиях стресса, а у её активность зависит от стадии клеточного цикла .
Распространение
Анализ многочисленных бактериальных геномных последовательностей показал, что тмРНК и транс -трансляция есть в каждой бактериальной клетке. Область тмРНК, соответствующая тРНК, имеет консервативную последовательность, в отличие от остальной части молекулы. Последовательность пептида-метки и его длина не очень консервативны, однако четыре последних его аминокислотных остатка очень консервативны и образуют последовательность A L AA. Именно она является мишенью периплазматической протеазы и цитоплазматических АТФ-зависимых протеаз, которые разрушают дефектные полипептиды . Любопытно, что комплекс из тмРНК Mycobacterium tuberculosis и SmpB E. coli нефункционален, а комплекс из тмРНК E. coli и SmpB M. tuberculosis успешно работает .
В ядерном геноме эукариот не обнаруживается никаких бифункциональных РНК наподобие тмРНК. Вероятно, контроль качества трансляции им не нужен столь же остро, как бактериям, благодаря различным механизмам контроля качества мРНК . У дрожжей , впрочем, был описан механизм, похожий на транс -трансляцию, осуществляющийся белками. У Saccharomyces cerevisiae белки, транслированные с дефектной мРНК, убиквитинируются и направляются на разрушение в протеасоме . Нельзя исключать возможности наличия у эукариот бифункциональных белков, по функциям аналогичным тмРНК .
Впервые митохондриальная тмРНК была обнаружена у протиста из группы Jakobida . Впоследствии они были выявлены у подавляющего большинства представителей Jakobida . Гены тмРНК были также идентифицированы в митохондриальных геномах оомицетов . Митохондриальные тмРНК характеризуются круговыми пермутациями и состоят из двух частей, и только у Jakoba libera была обнаружена инверсия , восстановившая нормальную структуру гена тмРНК, благодаря чему с него синтезируется обычная одночастная тмРНК .
Физиологическое значение
Стоит отметить, что, помимо транс -трансляции, у бактерий существуют и другие способы высвободить рибосому с проблемной мРНК. Тем не менее, для некоторых бактерий, таких как Mycoplasma genitalium , Neisseria gonorrhoeae , Haemophilus influenzae , Helicobacter pylori , и Mycobacterium tuberculosis , транс -трансляция жизненно необходима. У тех бактерий, которые могут выжить без тмРНК, отсутствие транс -трансляции снижает устойчивость клеток к стрессу: высокой или низкой температуре , нехватке питательных веществ , обработке этанолом или кальцием , воздействию кислот и различных препаратов. Более того, в условиях стресса интенсивность транс -трансляции повышается, что, вероятно, связано с увеличением количества дефектных мРНК в этих условиях. При нехватке аминокислот происходит активация эндонуклеазы RelE, которая разрезает транскрипты с образованием мРНК без стоп-кодонов, которые разрушаются при участии тмРНК. транс -Трансляция также связана с регуляцией экспрессии генов , участвующих в ответе на стресс. Кроме того, при разрушении тРНК колицинами E5 и D E. coli входит в состояние бактериостазиса при участии тмРНК и SmpB . Нарушение транс -трансляции снижает патогенность некоторых бактерий, поэтому разрабатываются антибиотики , нарушающие этот процесс .
транс -Трансляция задействована и в клеточных процессах, не связанных со стрессом. Например, у Caulobacter crescentus клеточный цикл и инициация репликации ДНК находятся под контролем транс -трансляции. Экспрессия тмРНК и SmpB у этой бактерии повышается в поздней G1-фазе , однако при начале репликации ДНК быстро разрушаются. В ходе G1-фазы тмРНК стабильна, но в начале S-фазы её разрушает РНКаза R . У E. coli в отсутствие транс -трансляции происходит задержка инициации репликации ДНК и снижается скорость роста . У Bacillus subtilis транс -трансляция задействована в спорообразовании .
Эволюция
Многочисленные сходства структуры, например, консервативные шпильки и петли, свидетельствуют от том, что происхождение тмРНК тесно связано с тРНК. тмРНК демонстрирует многочисленные структурные сходства к интронам тРНК, которые у бактерий относятся к самосплайсирующимся интронам I типа. Однако остаётся неясным, произошла ли тмРНК от тРНК с интроном I группы или наоборот. Любопытно, что аланин (единственная аминокислота, которой аминоацилируется тмРНК), относится к числу аминокислот, кодоны для которых появились в самом древнем варианте предкового генетического кода ; возможно, это свидетельствует в пользу древности происхождения тмРНК. Ряд учёных рассматривают тмРНК как промежуточное звено между миром РНК и современной жизнью, основанной на синтезе белка с помощью рибосом. Предполагается, что самая первая форма тмРНК появилась путём слияния двух шпилечных коротких РНК; такие тмРНК содержали акцепторный стебель с большим интроном, а также открытую рамку считывания. Вероятно, древние тмРНК имели несколько акцепторных стеблей, несущих, помимо аланина, и другие аминокислоты. Впоследствии такие прото-тмРНК дали начало современным тРНК и мРНК, а также тмРНК современного типа .
Примечания
- ↑ Keiler K. C. , Ramadoss N. S. (англ.) // Biochimie. — 2011. — November ( vol. 93 , no. 11 ). — P. 1993—1997 . — doi : . — .
- Muto A. , Ushida C. , Himeno H. (англ.) // Trends In Biochemical Sciences. — 1998. — January ( vol. 23 , no. 1 ). — P. 25—29 . — .
- , с. 235.
- ↑ Hudson C. M. , Williams K. P. (англ.) // Nucleic Acids Research. — 2015. — January ( vol. 43 ). — P. D138—140 . — doi : . — .
- ↑ Himeno H. , Nameki N. , Kurita D. , Muto A. , Abo T. (англ.) // Biochimie. — 2015. — July ( vol. 114 ). — P. 102—112 . — doi : . — .
- , с. 235—236.
- Wower I. K. , Zwieb C. , Wower J. (англ.) // RNA (New York, N.Y.). — 2005. — May ( vol. 11 , no. 5 ). — P. 668—673 . — doi : . — .
- Zwieb C. , Wower I. , Wower J. (англ.) // Nucleic Acids Research. — 1999. — 15 May ( vol. 27 , no. 10 ). — P. 2063—2071 . — .
- ↑ Keiler K. C. , Shapiro L. , Williams K. P. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2000. — 5 July ( vol. 97 , no. 14 ). — P. 7778—7783 . — .
- Sharkady S. M. , Williams K. P. (англ.) // Nucleic Acids Research. — 2004. — Vol. 32 , no. 15 . — P. 4531—4538 . — doi : . — .
- Srivastava R. A. , Srivastava N. , Apirion D. (англ.) // The International Journal Of Biochemistry. — 1992. — May ( vol. 24 , no. 5 ). — P. 737—749 . — .
- Li Z. , Pandit S. , Deutscher M. P. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1998. — 17 March ( vol. 95 , no. 6 ). — P. 2856—2861 . — .
- , с. 236.
- ↑ Macé K. , Gillet R. (англ.) // Nucleic Acids Research. — 2016. — 30 September ( vol. 44 , no. 17 ). — P. 8041—8051 . — doi : . — .
- Hatfull G. F. , Pedulla M. L. , Jacobs-Sera D. , Cichon P. M. , Foley A. , Ford M. E. , Gonda R. M. , Houtz J. M. , Hryckowian A. J. , Kelchner V. A. , Namburi S. , Pajcini K. V. , Popovich M. G. , Schleicher D. T. , Simanek B. Z. , Smith A. L. , Zdanowicz G. M. , Kumar V. , Peebles C. L. , Jacobs Jr. W. R. , Lawrence J. G. , Hendrix R. W. (англ.) // PLoS Genetics. — 2006. — June ( vol. 2 , no. 6 ). — P. e92—92 . — doi : . — .
- Kirby J. E. , Trempy J. E. , Gottesman S. (англ.) // Journal Of Bacteriology. — 1994. — April ( vol. 176 , no. 7 ). — P. 2068—2081 . — .
- Williams K. P. (англ.) // Nucleic Acids Research. — 2002. — 1 January ( vol. 30 , no. 1 ). — P. 179—182 . — .
- Dwyer D. S. (англ.) // Science (New York, N.Y.). — 2001. — 12 January ( vol. 291 , no. 5502 ). — P. 252—253 . — .
- Williams K. P. (англ.) // Journal Of Bacteriology. — 2003. — February ( vol. 185 , no. 3 ). — P. 1059—1070 . — .
- , с. 236—237.
- Wower I. K. , Zwieb C. , Wower J. (англ.) // BMC Molecular Biology. — 2014. — 15 September ( vol. 15 ). — P. 19—19 . — doi : . — .
- Burger G. , Gray M. W. , Forget L. , Lang B. F. (англ.) // Genome Biology And Evolution. — 2013. — Vol. 5 , no. 2 . — P. 418—438 . — doi : . — .
- ↑ Jacob Y. , Seif E. , Paquet P. O. , Lang B. F. (англ.) // RNA (New York, N.Y.). — 2004. — April ( vol. 10 , no. 4 ). — P. 605—614 . — .
- Hafez M. , Burger G. , Steinberg S. V. , Lang B. F. (англ.) // RNA Biology. — 2013. — July ( vol. 10 , no. 7 ). — P. 1117—1124 . — doi : . — .
- Sakai F. , Sugita R. , Chang J. W. , Ogawa T. , Tsumadori N. , Takahashi K. , Hidaka M. , Masaki H. (англ.) // Microbiology (Reading, England). — 2015. — October ( vol. 161 , no. 10 ). — P. 2019—2028 . — doi : . — .
- Wurihan W. , Wunier W. , Li H. , Fan L. F. , Morigen M. (англ.) // Genetics And Molecular Research : GMR. — 2016. — 29 August ( vol. 15 , no. 3 ). — doi : . — .
Литература
- Миронова Л. Н., Падкина М. В., Самбук Е. В. РНК: синтез и функции. — СПб. : Эко-вектор, 2017. — 287 с. — ISBN 978-5-906648-29-7 .
- 2020-04-15
- 1