Interested Article - Альдегиды

- 2021-06-05
- 1

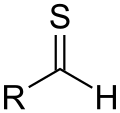
Альдеги́ды (от лат. al cohol dehyd rogenatus — спирт , лишённый водорода ) — класс органических соединений , содержащих альдегидную группу (-CHO) . ИЮПАК определяет альдегиды как вещества вида R-CHO, в которых карбонильная группа связана с одним атомом водорода и одной группой R .
Названия альдегидов
Этимология
Слово альдегид было придумано Юстусом фон Либихом как сокращение латинского alcohol dehydrogenatus — дегидрированный спирт (в некоторых источниках — alcohol dehydrogenatum ). Название радикала формил , а также другие однокоренные слова ( формальдегид , формиаты ), произошли от лат. formica — муравей .
Тривиальные названия
В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия альдегидов, которые вследствие сложившейся традиции используются вместо систематических названий. Тривиальные названия обычно происходят от названия соответствующих карбоновых кислот , а также от названия источника, из которого был выделен тот или иной альдегид. Так, например, метаналь называют муравьиным альдегидом, этаналь — уксусным, пентаналь — валериановым альдегидом, цитронеллаль получил своё название, поскольку был выделен из масла цитрусовых .
Исторически сложилось, что парфюмеры называют многие пахучие вещества альдегидами, даже те, которые не имеют ничего общего с ними. Среди таковых, например, , земляничный и , которые являются не альдегидами, а сложными эфирами или лактонами . Также некоторые альдегиды традиционно называются по числу атомов углерода, например, персиковый альдегид, обозначаемый как «альдегид C14», на самом деле имеет лишь 11 атомов углерода .
Систематическая номенклатура
По номенклатуре ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса - аль , а диальдегидов — суффикса - диаль (в данном случае атом углерода альдегидной группы уже входит в состав родоначального алкана). При этом в названии номер при альдегидной группе, как правило, не ставят, поскольку она всегда занимает крайнее положение. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл ), то к названию добавляется суффикс - карбальдегид .
Если в данном соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил -, указывая её положение .
В устаревших Женевской (1892) и Льежской (1930) номенклатурах, впоследствии заменённых систематической номенклатурой ИЮПАК , альдегиды обозначались при помощи суффикса - ал .

Классификация альдегидов
Альдегиды классифицируются следующим образом (в скобках приведены примеры) :
-
В зависимости от насыщенности углеводородного
заместителя
:
- предельные (насыщенные) альдегиды ( ацетальдегид );
- непредельные (ненасыщенные) альдегиды ( акролеин );
- ароматические альдегиды ( бензальдегид ).
-
По числу карбонильных групп:
- альдегиды с одной карбонильной группой ( формальдегид );
- диальдегиды ( глиоксаль );
- многоатомные альдегиды.
Нахождение в природе


Альдегидная группа содержится во многих природных веществах, таких, как углеводы ( альдозы ), некоторые витамины ( ретиналь , пиридоксаль ). Их следы содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид (в кассиевом масле его может быть до 75 %, а в цейлонском коричном масле даже до 90 %) и ванилин .
Алифатический альдегид СН 3 (СН 2 ) 7 С(Н)=О (тривиальное название — ) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор .
Цитраль содержится в лемонграссовом и кориандровом маслах (до 80 %), цитронеллаль — в цитронелловом (приблизительно 30 %) и эвкалиптовом, бензальдегид — в масле горького миндаля. Куминовый альдегид содержится в масле тмина , гелиотропин — в масле гелитропа и сирени, анисовый альдегид и жасминальдегид в небольших количествах содержатся во многих эфирных маслах .
Методы синтеза альдегидов
Лабораторные методы получения альдегидов
Окислительные методы
- Для получения альдегидов в лабораторных условиях часто используется реакция окисления первичных спиртов реагентами, представляющими собой комплексные соединения оксида хрома(VI) с третичными аминами , в частности, лучшими реагентами являются комплекс с пиридином (CrO 3 · 2C 5 H 5 N, реагент Саррета — Коллинза) и хлорхромат пиридиния (C 5 H 5 NH + CrO 3 Cl - , реагент Кори , PCC). Данные реагенты позволяют получать альдегиды с высоким выходом, а хлорхромат пиридиния также не затрагивает двойную связь . Для этих же целей применяют и другие окислители , например оксид марганца(IV) MnO 2 , карбонат серебра на цеолите , а также диметилсульфоксид в присутствии основания ( ) .


- Реакция окисления периодинаном Десса-Мартина. Первичные спирты при этом селективно окисляются до альдегидов.
- Как метод получения альдегидов может использоваться восстановительный симметричных дизамещённых алкенов либо циклических алкенов (в данном случае реакция приводит к образованию диальдегида). Аналогичное превращение может быть проведено под действием смеси OsO 4 и NaIO 4 .

- Также к данному типу реакций относится окисление вицинальных диолов йодной кислотой или тетраацетатом свинца .
- Важным методом также является — окисление алкинов , в ходе которого к алкину против правила Марковникова присоединяется диалкилборан (например, дисиамилборан ), а полученный продукт окисляется щелочным раствором пероксида водорода , что приводит к образованию альдегида .

Восстановительные методы
Ряд производных карбоновых кислот ( хлорангидриды , сложные эфиры , нитрилы , амиды ) могут быть восстановлены до альдегидов под действием специфических восстановителей .
- Так, например, в реакции Розенмунда хлорангидриды восстанавливают под действием водорода на палладиевом катализаторе . Аналогичное превращение можно провести под действием три( трет -бутокси)алюмогидрида лития .

- Сложные эфиры селективно восстанавливаются до альдегидов под действием диизобутилалюминийгидрида .
Синтез ароматических альдегидов
Ароматические альдегиды могут быть синтезированы принципиально отличными методами, основанными на реакциях ароматического электрофильного замещения .
- Альдегидную группу можно ввести в ароматические соединения реакциями Гаттермана , Гаттермана — Коха , Вильсмейера — Хаака , Рихе и Раймера — Тимана . Исторически первая реакция Гаттермана — Коха (1897) применима к бензолу и его алкилзамещённым производным, которые вступают в реакцию с оксидом углерода(II) CO и хлороводородом HCl в присутствии AlCl 3 и CuCl , давая соответствующие бензальдегиды (альдегидная группа вводится в пара -положение). Улучшенный метод (реакция Гаттермана) состоит в использовании цианида цинка Zn(CN) 2 и соляной кислоты и позволяет формилировать фенолы и гетероароматические соединения. Для формилирования фенолов также используется реакция Раймера — Тимана. Введение альдегидной группы в ароматические ядра, активированные гидроксильной, алкоксильной или диалкиламинной группой, осуществляется по реакции Вильсмейера — Хаака с использованием диметилформамида и хлорокиси фосфора (или аналогичных реагентов) .


- Также ароматические альдегиды могут быть получены окислением метилзамещённых бензолов под действием ряда окислителей, в том числе оксида хрома(VI) CrO 3 , оксида марганца(IV) MnO 2 и .
- Реакция Соммле позволяет окислять бензилгалогениды ArCH 2 X под действием уротропина с последующим гидролизом образующейся соли до альдегида. Данная реакция применима для синтеза разнообразных ароматических и гетероциклических альдегидов. Подобное превращение можно осуществить, также окисляя бензилгалогениды солями .

- Ароматические альдегиды можно получать из производных ароматических карбоновых кислот общими методами, однако существуют и специфические реакции. Например, позволяет восстанавливать ароматические нитрилы хлоридом олова(II) SnCl 2 с последующим гидролизом, что приводит к ароматическому альдегиду .
Другие методы
Альдегиды также можно получать реакциями гидратации алкинов ( реакция Кучерова ), пиролизом карбоновых кислот и их смесей в виде паров над оксидами некоторых металлов ( ThO 2 , MnO 2 , CaO , ZnO ) при 400—500 °C, гидролизом геминальных дигалогенопроизводных (если атомы галогена находятся у одного из крайних атомов углерода) и другими реакциями .
Промышленные методы получения альдегидов
Известно много методов синтеза альдегидов, однако их использование в промышленности зависит во многом от доступности исходного сырья. Основными промышленными методами получения насыщенных алифатических альдегидов являются :
- гидроформилирование алкенов (оксосинтез);
- дегидрирование или окисление первичных спиртов ;
- гидратация ацетилена ;
- окисление этилена ;
- окисление насыщенных углеводородов (С3, С4).
Также большое значение имеют некоторые специфические синтезы альдегидов, широко применяемых в парфюмерной промышленности .
Оксосинтез является наиболее важным процессом для получения альдегидов с тремя атомами углерода и выше. В этой реакции алкены реагируют с синтез-газом ( CO + H 2 ) с образованием альдегида, содержащего на один атом углерода больше, чем исходный алкен. При использовании несимметричных алкенов образуется смесь продуктов, соотношение которых можно варьировать путём подбора катализатора .

Среди процессов отщепления водорода от первичных спиртов различают дегидрирование, окисление и окислительное дегидрирование. Дегидрирование спиртов проводят при атмосферном давлении и температуре 250—400 °С в присутствии медного или серебряного катализатора . В ходе процесса выделяется водород , который можно использовать без очистки в других процессах. Дегидрирование имеет коммерческое значение в получении уксусного альдегида из этанола : реакцию проводят при 270—300 °С на медном катализаторе, активированном церием , при этом за цикл превращается 25—50 % этанола с селективностью 90—95 %. Побочными продуктами являются этилацетат , этилен , кротоновый альдегид и высшие спирты. Окисление спиртов проводится в избытке воздуха или кислорода при 350—450 °С на катализаторе, содержащем оксиды железа и молибдена . Процесс используется в производстве формальдегида . Данные процессы также применяются в синтезе душистых альдегидов .
Окисление алкенов является основным промышленным методом получения ацетальдегида и акролеина . В первом случае окислению подвергается этилен в присутствии хлоридов палладия и меди Вакер-процесс .
Процесс получения ацетальдегида, основанный на гидратации ацетилена , в последнее время потерял былое значение. Последние фабрики в Западной Европе, синтезирующие ацетальдегид по данной схеме, были закрыты в 1980 году. Причиной этому послужила бо́льшая доступность этилена в качестве сырья, а также токсичность катализатора — сульфата ртути .
Ежегодное мировое производство формальдегида (по данным на 1996 год) составило 8,7·10 6 т , ацетальдегида (на 2003 год) — 1,3·10 6 т .
Основным методом получения бензальдегида является гидролиз в кислой или щелочной средах. В качестве гидролизующих агентов могут применяться гидроксид кальция , карбонат кальция , гидрокарбонат натрия , карбонат натрия , а также различные кислоты с добавлением солей металлов. Исходное сырьё, в свою очередь, получают при хлорировании толуола в боковую цепь. Менее распространённый процесс основан на частичном окислении толуола .
Физические свойства альдегидов
Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С 12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом являются твёрдыми веществами.
Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Например, валериановый альдегид кипит при 100,4 °C, а изовалериановый — при 92,5 °C. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при 48,8 °C, а пропанол-1 при 97,8 °C. Это показывает, что альдегиды, в отличие от спиртов , не являются сильно ассоциированными жидкостями . Данное свойство используется в синтезе альдегидов путём восстановления спиртов: поскольку температура кипения альдегидов в целом ниже, они могут быть легко отделены и очищены от спирта перегонкой . В то же время их температуры кипения намного выше, чем у углеводородов с той же молекулярной массой, что связано с их высокой полярностью .
Вязкость , плотность и показатель преломления при 20 °C увеличиваются с увеличением молярной массы альдегидов. Низшие альдегиды являются подвижными жидкостями, а альдегиды от до имеют маслообразную консистенцию .
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 20 °С составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах , простых эфирах и других распространённых органических растворителях .
Низшие альдегиды имеют резкий запах, а высшие гомологи (С 8 -С 13 ) являются компонентами многих парфюмерных изделий .
| Название | Формула | Температура плавления, °C | Температура кипения, °C | Плотность, г/см³ (при 20 °C) |
|---|---|---|---|---|
| Формальдегид | HCHO | −93 | −21 | 0,82 (при –20 °С) |
| Ацетальдегид | CH 3 CHO | −123 | 21 | 0,778 |
| Пропаналь | CH 3 CH 2 CHO | −81 | 49 | 0,797 |
| Бутаналь | CH 3 CH 2 CH 2 CHO | −99 | 76 | 0,803 |
| Акролеин | CH 2 =CH–CHO | −88 | 53 | 0,841 |
| Кротоновый альдегид | CH 3 -CH=CH–CHO | −74 | 104 | 0,852 |
| Бензальдегид | C 6 H 5 CHO | −56 | 179 | 1,05 |
| Салициловый альдегид | о -HO–C 6 H 4 CHO | 2 | 197 | 1,16 |
| Ванилин |
|
82 | 285 | — |
Строение
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации . Углы R-C-H, R-C-O и H-C-O составляют приблизительно 120° (где R — алкил).
Двойная связь карбонильной группы сходна по физической природе с двойной связью между углеродными атомами, однако в то же время энергия связи С=О (749,4 кДж / моль ) больше, чем энергия двух простых связей (2×358 кДж/моль) C-O. С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы составляет ~9⋅10 −30 Кл·м . Длина связи С=О составляет 0,122 нм .
Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие :

Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов как выраженных электрофилов и позволяет им вступать в многочисленные реакции нуклеофильного присоединения .
Химические свойства
Высокая реакционная способность связана с наличием полярной связи С=О. Альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H + , ZnCl 2 , BF 3 , AlCl 3 и т. д. В общем случае химические свойства альдегидов аналогичны кетонам , однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе.
Реакции присоединения к карбонильной группе
Альдегиды содержат поляризованную карбонильную группу и склонны присоединять нуклеофильные реагенты , как нейтральные ( аммиак , амины , воду , спирты , тиолы и др.), так и анионные (цианид-ион CN - , алкоголяты , гидрид-ион H - , карбанионы и др.). За исключением реакций восстановления гидридами типа алюмогидрида лития LiAlH 4 , а также взаимодействия с реактивами Гриньяра, данные процессы являются обратимыми . Необходимо также различать два типа обратимых реакций присоединения: первый тип приводит к образованию тетраэдрического продукта присоединения, а второй тип включает в себя также последующую реакцию дегидратации , в результате которой происходит образование двойной связи между электрофильным атомом углерода и нуклеофилом. Реакции второго типа характерны, в основном, для азотсодержащих нуклеофилов .

В данных реакциях альдегиды являются более реакционноспособными по сравнению с кетонами. Это связано с большей термодинамической устойчивостью кетонов, а также меньшими пространственными затруднениями в случае присоединения к альдегидам .
Простейшей модельной реакцией данного типа является реакция гидратации альдегидов, протекающая в их водных растворах. Согласно правилу Эльтекова — Эрленмейера, образующиеся при этом 1,1-диолы неустойчивы и с отщеплением молекулы воды превращаются обратно в исходные карбонильные соединения. Гидратация наблюдается в существенной степени лишь для низших альдегидов. Так, формальдегид гидратирован на 99,999 %, ацетальдегид — на 58 %. Когда положительный заряд на атоме углерода увеличивается в достаточной степени за счёт связанных с ним радикалов, 1,1-диолы становятся устойчивыми и могут быть выделены (например, хлораль легко присоединяет воду с образованием устойчивого аддукта — хлоральгидрата ). Реакция гидратации катализируется как кислотами , так и основаниями .

Подобным образом протекает и реакция присоединения спиртов по карбонильной группе, имеющая важное значение в органическом синтезе для защиты карбонильной группы. Первичный продукт присоединения называется полуацеталем , далее под действием кислоты он превращается в ацеталь . При стоянии альдегиды также образуют циклические или полимерные ацетали (например, или параформ для формальдегида и паральдегид для ацетальдегида ). При нагревании этих соединений со следовыми количествами кислот происходит деполимеризация и регенерация исходных альдегидов .

Аналогичные превращения происходят также с участием серосодержащих аналогов спиртов — тиолов ; они приводят, соответственно, к , также играющим важную роль в тонком органическом синтезе .
Альдегиды могут присоединять циановодород HCN с образованием циангидринов , применяемых в органическом синтезе для получения α,β-ненасыщенных соединений, α-гидроксикислот, α- аминокислот . Данная реакция также является обратимой и катализируется основаниями. В лабораторных условиях циановодород (т. кип. 26 °C) обычно получают действием эквивалентного количества минеральной кислоты на цианид натрия или калия .

Относительно небольшие пространственные затруднения при присоединении нуклеофилов к альдегидам позволяют превращать их в бисульфитные производные под действием большого избытка гидросульфита натрия NaHSO 3 . Данные соединения представляют собой кристаллические вещества и часто используются для выделения, очистки или хранения соответствующих альдегидов, поскольку последние могут быть легко из них регенерированы под действием кислоты или основания .

Реакция альдегидов с - и приводит к образованию вторичных спиртов (в случае формальдегида — первичных). Процесс может осложняться побочными реакциями енолизации и восстановления карбонильного соединения, которые приводят к снижению выхода. При использовании литийорганических соединений эти помехи удаётся устранить .


При реакции альдегидов с первичными и вторичными аминами происходит образование иминов и енаминов соответственно. В основе обеих реакций лежит присоединение нуклеофильных реагентов по карбонильной группе с последующим отщеплением воды от полученного тетраэдрического интермедиата. Реакция образования иминов требует кислотного катализа и наиболее эффективно протекает в области pH от 3 до 5. Для получения енаминов с удовлетворительным выходом необходимо применять азеотропную отгонку воды, что позволяет сместить равновесие в сторону образования продукта. Обычно в качестве вторичных аминов используют циклические амины ( пирролидин , пиперидин или морфолин ) .

Аналогичным образом альдегиды реагируют с гидроксиламином , гидразином , 2,4-динитрофенилгидразином , семикарбазидом и другими подобными соединениями. Большинство получаемых при этом соединений являются кристаллическими и могут быть использованы для идентификации альдегидов по температуре плавления и другим характеристикам. Также эти соединения находят применение в органическом синтезе, например, гидразоны могут быть восстановлены по реакции Кижнера — Вольфа .

Реакции сопряжённого присоединения

Присоединение нуклеофильных реагентов к α,β-ненасыщенным альдегидам может протекать как по карбонильной группе, так и по «четвёртому» положению сопряжённой системы. Причина этого заключается в том, что двойная углерод-углеродная связь поляризуется под действием полярной карбонильной группы ( мезомерный эффект ), и дальний от карбонильной группы атом углерода двойной связи приобретает частичный положительный заряд. Реакция нуклеофила с данным атомом углерода называется сопряжённым присоединением, или 1,4-присоединением. Присоединение к карбонильной группе по аналогии называют 1,2-присоединением. Формальным результатом 1,4-присоединения является присоединение нуклеофила по углерод-углеродной двойной связи. Во многих случаях 1,2- и 1,4-присоединение являются конкурирующими реакциями, однако иногда удаётся проводить селективные реакции с получением продуктов 1,2- либо 1,4-присоединения .
Присоединение первичных и вторичных аминов к α,β-ненасыщенным альдегидам протекает в мягких условиях и приводит к образованию 1,4-продукта. Напротив, в случае циановодорода наблюдается конкурентное образование обоих продуктов с преобладанием продукта 1,2-присоединения. Чтобы в данной реакции исключить возможность 1,2-присоединения, используют специальный реагент — (C 2 H 5 ) 2 AlCN .
Литийорганические соединения присоединяются исключительно по карбонильной группе, давая аллиловые спирты. Сопряжённое присоединение проводят под действием медьорганических реагентов — диалкилкупратов, которые позволяют ввести в карбонильное соединение не только первичную, но также вторичную или третичную алкильную , алкенильную или арильную группу. Магнийорганические реагенты ( реактивы Гриньяра ), полученные из магния сверхвысокой чистоты, также присоединяются с образованием 1,2-продуктов, в то время как обыкновенные реактивы Гриньяра, предположительно из-за примесей других металлов (например, меди и железа ) вступают и в 1,2-, и в 1,4-присоединение, что регулируется пространственными факторами. В настоящее время магнийорганические реагенты утратили своё значение в данной области .
Борорганические соединения (триалкилбораны) реагируют с непредельными альдегидами, давая продукты 1,4-присоединения
Реакции α-метиленового звена
Альдегиды вступают в реакцию с галогенами ( хлором , бромом или иодом ), образуя галогенпроизводные, при этом галогенирование осуществляется исключительно в α-положение (в положение, соседнее с карбонильной группой) .
Альдегиды проявляют свойства слабых кислот: под действием оснований они способны отщеплять протон от α-метиленовой группы, превращаясь в енолят-ион . Обычно для достаточно полного депротонирования используют сильные основания ( гидрид натрия , гидрид калия , диизопропиламид лития и др.) в апротонных растворителях ( тетрагидрофуран , ДМСО ). Превращение карбонильной формы альдегидов в енольную форму протекает и в отсутствие сильных оснований. Образующиеся при этом енолы , как правило, намного менее стабильны, чем карбонильная форма, например, для ацетальдегида константа равновесия — только 6⋅10 −5 при комнатной температуре ). Данное равновесие, существующее между карбонильной и енольной формами называется кето-енольной таутомерией .

Благодаря способности образовывать енолят-ионы альдегиды вступают в ряд химических реакций, где эти частицы выступают как нуклеофилы . В частности, для них характерны реакции конденсации. В слабоосновной среде (в присутствии ацетата , карбоната или сульфита калия ) подвергаются альдольной конденсации , в ходе которой часть молекул альдегида выступает как карбонильная компонента (реагирует карбонильной группой), а часть молекул альдегида под действием основания превращается в енолят-ионы и выступает как метиленовая компонента (вступает в реакцию α-метиленовым звеном). Образующийся альдоль при нагревании отщепляет воду с образованием α,β-непредельного альдегида (переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией или альдольно-кротоновой конденсацией ) .

При реакции между двумя разными альдегидами образуется смесь четырёх различных альдолей. Исключение составляют случаи, когда разделение реагентов на карбонильную и метиленовую компоненту очевидно (например, один из альдегидов не содержит α-метиленового звена и может выполнять роль только карбонильной компоненты). Разработаны также методы повышения селективности подобных реакций. Перекрёстная конденсация ароматических альдегидов с кетонами, получила название . Известны также схожие реакции альдегидов: реакция Кнёвенагеля , реакция Тищенко , реакция Перкина , бензоиновая конденсация и другие .
Реакции окисления
Окисление альдегидов до соответствующих карбоновых кислот кислородом протекает по радикально-цепному механизму ( автоокисление ) с образованием промежуточных продуктов — пероксокислот.
Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Наиболее часто используются перманганат калия , а также ( CrO 3 + H 2 SO 4 ), который даёт наилучшие результаты (в течение короткого времени при низкой температуре достигается более чем 80%-ый выход карбоновой кислоты). Реагент Джонса также не лишён недостатков, в частности, он недостаточно селективен и окисляет другие функциональные группы, а кислая среда способствует нежелательной изомеризации или разложению субстрата .

Избежать этих проблем можно при использовании более мягкого окислителя — реактива Толленса (аммиачного раствора оксида серебра ), который не затрагивает кратные связи и гидроксильные группы спиртов. Эта реакция широко применяется для обнаружения альдегидов (реакция «серебряного зеркала») .

Окисление метиленовых групп в α-положении альдегидов диоксидом селена приводит к образованию 1,2-дикарбонильных соединений .
Альдегиды медленно окисляются на воздухе при комнатной температуре. Этот радикальный процесс ускоряется при облучении или в присутствии ионов Fe 2+ . Ароматические альдегиды подвергаются окислению легче, чем алифатические. Данная реакция не имеет синтетического значения, однако её протекание необходимо учитывать при хранении альдегидов: желательно хранить их в темноте и инертной атмосфере .
Ароматические альдегиды также окисляются до карбоновых кислот или сложных эфиров фенолов ( реакция Байера — Виллигера ) под действием надкислот , причём соотношение продуктов зависит как от заместителей в ароматическом ядре, так и от кислотности среды .

Реакции восстановления
Альдегиды можно восстанавливать до первичных спиртов . Наиболее распространённые методы восстановления включают реакции с комплексными гидридами: боргидридом натрия NaBH 4 , боргидридом лития LiBH 4 и алюмогидридом лития LiAlH 4 . Чуть реже применяется боргидрид цинка B 2 H 8 Zn.
Боргидрид натрия является более избирательным реагентом и позволяет восстанавливать карбонильную группу альдегидов и кетонов, не затрагивая сложноэфирные , нитрильные , амидные , лактонные и оксирановые группы. Он также не восстанавливает изолированную двойную углерод-углеродную связь. Алюмогидрид лития менее селективен и восстанавливает перечисленные выше функциональные группы, поэтому восстановление альдегидов с его применением возможно только в отсутствие этих групп .

Историческую роль играет , в которой в качестве восстановителя используется . В настоящее время этот метод вытеснен более эффективной реакцией восстановления альдегидов и кетонов изопропиловым спиртом в присутствии окиси алюминия .
Алифатические альдегиды обычно не гидрируют на палладиевых катализаторах, но для этих целей можно использовать рутений на угле, никель Ренея или платину .
Альдегиды как основания Льюиса
В соответствии с наличием неподелённых электронных пар атома кислорода карбонильной группы альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H + , ZnCl 2 , BF 3 , AlCl 3 и т. д. . В кислой среде альдегиды протонируются с образованием оксониевого катиона. Альдегиды являются очень слабыми основаниями, намного более слабыми, чем вода и спирты, но тем не менее эти свойства играют исключительно важную роль в химических реакциях .
Другие реакции
Альдегиды, не имеющие атомов водорода при α-углеродном атоме (то есть имеющие общую формулу R 3 CCHO) под действием водно-спиртового раствора щёлочи вступают в реакцию Канниццаро , в которой одновременно выступают в роли окислителя и восстановителя . Сфера применения данного процесса расширяется за счёт перекрёстной реакции Канниццаро, протекающей между ароматическим альдегидом и формальдегидом в присутствии щёлочи. При этом восстановителем является формальдегид, а другой альдегид восстанавливается до соответствующего спирта .

Альдегиды могут вступать в реакции с илидами фосфора по реакции Виттига , образовывая алкены с заданной конфигурацией двойной связи (как правило, образуются Z -алкены, но разработаны и модификации, позволяющие получать E -алкены). В данное время это один из лучших методов региоспецифического синтеза алкенов .

Также альдегиды взаимодействуют с илидами серы, давая оксираны ( ) .
Альдегиды подвергаются реакции в присутствии некоторых комплексов переходных металлов, например, катализатора Уилкинсона .
Химические методы идентификации альдегидов
Качественный анализ карбонильных групп
- Тест Бреди — 2,4-динитрофенилгидразин с альдегидами даёт жёлтый, оранжевый (если альдегид алифатический) или красный (если альдегид ароматический) осадок:
- RCHO + C 6 H 3 (NO 2 ) 2 NHNH 2 → C 6 H 3 (NO 2 ) 2 NHNCHR + H 2 O
- Реакция «серебряного зеркала» и реакция с фелинговой жидкостью предназначена для распознавания альдегидов и кетонов — альдегиды окисляются до карбоновых кислот, кетоны с этими реагентами не реагируют.
- Реакция с гидроксидом меди (II) , происходящая при нагревании, при этом альдегиды окисляются до карбоновых кислот, а гидроксид меди (II) восстанавливается до оксида меди (I) :
- RCHO + 2Cu(OH) 2 → RCOOH + Cu 2 O + 2H 2 O
- Реактив Шиффа (фуксинсернистая кислота) реагирует с альдегидами с образованием яркоокрашенного фиолетового продукта :
Количественный анализ альдегидов
- При действии хлорида гидроксиламиния образуется соответствующий альдоксим и выделяется эквивалентное количество хлоридной кислоты. Выделившуюся после реакции кислоту титруют щелочью; индикатор — раствор бромфенолового синего (окраска раствора изменяется от жёлто-зелёной до фиолетово-синей) :
- В аналитической практике используется окисление альдегидов и кетонов йодом в щелочной среде. Йод добавляют в избытке, а затем избыток его оттитровывают тиосульфатом натрия :
Спектральные методы анализа альдегидов
ИК-спектроскопические методы анализа альдегидов
Альдегиды легко идентифицировать по ИК-спектру — он содержит специфические полосы поглощения, относящиеся к валентным колебаниям связи C-H в альдегидной группе: два острых пика, расположенные далеко за пределами области поглощения, характерной для связей C-H обычного типа. Кроме того, в ИК-спектрах альдегидов обычно присутствуют полосы поглощения, обусловленные валентными колебаниями связей С=O и C-H: ν С=O =1725-1685 см −1 , ν С-H =2850; 2750 см −1 .
Масс-спектрометрические методы анализа альдегидов
Масс-спектры альдегидов имеют довольно выраженный молекулярный ион, хотя его содержание может быть довольно низким. Потеря алкильных радикалов приводит к образованию ацил-катионов. Для них особенно характерны α- и β-расщепление и перегруппировка Мак-Лафферти . Для альдегидов с подвижным γ-атомом H и не содержащих заместителя у α-углерода характерен пик m/z=44, а для содержащих заместитель появляется интенсивный пик замещённого иона с m/z=44+12n .
ЯМР-спектроскопические методы анализа альдегидов
В 1 Н ЯМР-спектре альдегида наиболее характеристичным является сигнал формильного протона, обычно расположенный в наиболее слабом поле в области δ 9,4—10,1 м д. (9,4-9,7 -алифатические, 9,6-10,1 -ароматические) . Сигнал альдегидной группы в 13 C ЯМР-спектре расположен в области 182—215 м д. .
УФ-спектроскопические методы анализа альдегидов
Два максимума поглощения от р до р* (<200 нм) и от n до р* (> 200 нм) .
Электронно-спектроскопические методы анализа альдегидов
Электронные спектры содержат полосы с λ макс 290 нм для RCHO (R=CH 3 , C 2 H 5 , C 3 H 7 ), 345 нм для акролеина и 327 для кротонового альдегида .
Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами .
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Ацетальдегид СН 3 СНО вызывает возбуждение, сменяющееся наркозом. Он является промежуточным продуктом метаболизма этилового спирта в организме. Действие тримера этого альдегида — паральдегида (С 2 Н 4 O) 3 — сильнее и продолжительнее, в то время как тетрамер — метальдегид (С 2 Н 4 O) 4 — является более токсичным. Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность .
Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля более выражены, чем у ацетальдегида. Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путём образования гидратной формы альдегида. Гидратные формы мало токсичны, в такой форме хлораль применяется в медицине под названием хлоралгидрата , проявляющего снотворное действие. Введение гидроксильных групп в молекулу альдегида или конденсация их с образованием альдолей существенно снижает реакционную способность, а также физиологическую активность соединений. Так, сахара представляют собой фармакологически инертные вещества. Большинство ароматических альдегидов имеет низкую токсичность, так как они легко окисляются до соответствующих кислот, которые обычно довольно инертны .
Лекарственные препараты, содержащие в молекуле альдегидную группу, и их основное действие на организм
| Название | Действие на организм |
|---|---|
| Формальдегид (формалин) | Антисептическое |
| Хлоральгидрат | Снотворное, противосудорожное |
| Цитраль | Снижает артериальное давление |
| Противомикробное |
Применение

Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной , меламином и фенолом ), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства ( уротропин ) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата , использующегося в производстве полиуретанов и гексогена (довольно сильной взрывчатки). Второй по масштабам производства альдегид — масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования ). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов углерода от 8 до 12) . Например, это коричный альдегид и его производные — цитраль и . Второй по масштабам производства альдегид — масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования ). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов углерода от 8 до 12) . Например, это коричный альдегид и его производные — цитраль и .
Ацетальдегид используется для синтеза уксусной кислоты , этилового спирта, бутадиена для получения производных пиридина , пентаэритрита и кротонового альдегида , а также при синтезе поливинилацетата и пластмасс.
Альдегиды применяют для синтеза спиртов (бутиловых, 2-этилгексанола, пентаэритрита), карбоновых кислот, полимеров, антиоксидантов, пиридиновых оснований .
Примечания
- ↑ Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М. : Советская энциклопедия, 1988. — С. 196-198. — 623 с. — 100 000 экз.
- . Дата обращения: 7 июля 2013. 9 июля 2013 года.
- Liebig J. (фр.) // Annales de chimie et de physique. — 1835. — Vol. 59 . — P. 290 .
- Senning A. Elsevier's Dictionary of Chemoetymology. — Elsevier, 2007. — P. 151. — ISBN 978-0-444-52239-9 .
- ↑ Леенсон И. А. . Дата обращения: 25 июня 2013. 29 июня 2013 года.
- (англ.) . ACD/Labs. Дата обращения: 24 августа 2009. 21 августа 2011 года.
- ↑ Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова, Р. А. Лидина. — М. : Химия, 1983. — С. 139—140.
- Справочник химика / Редколлегия: Никольский Б. П. и др.. — 2-е издание. — Ленинград, Москва: Химия, 1964. — Т. 2. — С. 270, 285, 295.
- ↑ Петров А. А., Бальян Х. В., Трощенко А. Т. Органическая химия. — Иван Федоров, 1981. — Т. 1. — С. 165-184. — 672 с. — ISBN 5-81940-067-4 .
- Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. — М. : Химия, 1974.
- , т. 2, с. 265—273.
- . www.khimia.ru. Дата обращения: 21 июля 2016. 22 августа 2016 года.
- , т. 3, с. 12—13.
- ↑ Шабаров Ю.С. Органическая химия. — Лань, 2011. — С. 218-221. — 848 с.
- , т. 1, с. 480—483.
- , т. 3, с. 13—14.
- , т. 3, с. 203—205.
- , т. 3, с. 235.
- Марч Дж. Органическая химия. — М. : Мир, 1987. — Т. Т. 2. — С. 359—363.
- ↑ , т. 3, с. 16—20.
- ↑ , p. 6—8.
- Reuss G., Disteldorf W., Gamer A. O., Hilt A. Formaldehyde // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi : .
- Eckert M., Fleischmann G., Jira R., Bolt H. M., Golka K. Acetaldehyde // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2006. — doi : .
- Brühne F., Wright E. Benzaldehyde // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2011. — doi : .
- ↑ , p. 2—3.
- , т. 3, с. 10—11.
- , p. 3, 13.
- , т. 3, с. 23.
- ↑ , т. 3, с. 23—26.
- , т. 3, с. 27—28.
- ↑ , т. 3, с. 29—37.
- ↑ , т. 3, с. 38—39.
- , т. 3, с. 40—42.
- ↑ , т. 3, с. 44—49.
- , т. 3, с. 59—60.
- , т. 3, с. 60—62.
- , т. 3, с. 62—64.
- , т. 3, с. 64—65.
- , т. 3, с. 86.
- March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8 .
- , т. 3, с. 95—99.
- ↑ , т. 3, с. 124—134.
- ↑ , т. 3, с. 75—76.
- ↑ , т. 3, с. 79—81.
- ↑ , т. 3, с. 69—75.
- .
- , т. 3, с. 82—83.
- , т. 3, с. 49—57.
- , т. 3, с. 57—59.
- , т. 3, с. 84—85.
- Цветков Л.А. § 26. Альдегиды // Органическая химия. Учебник для 10 класса. — 20-е изд. — М. : Просвещение , 1981. — С. 120—129.
- от 24 декабря 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- 24 декабря 2014 года. — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Пассет Б. В., Антипов М. А. Практикум по техническому анализу и контролю в производстве химико-фармацевтических препаратов и антибиотиков. — Медицина, 1981. — 272 с.
- Dr. Neil Glagovich. . 6 июля 2013 года.
- Н.С.Вульфсон, В.Г.Заикин,А.И.Микая. Масс-спектроскопия органических соединений. — Химия, 1986. — С. 197—198.
- ↑ Dr. Ian Hunt. (англ.) . Department of Chemistry University of Calgary . 6 июля 2013 года.
- Общая токсикология / под ред. А. О. Лойта. СПб.: ЭЛБИ-СПб., 2006
- ↑ . Дата обращения: 27 июня 2013. Архивировано из 29 июня 2013 года.
- G. Reuss, W. Disteldorf, A. O. Gamer, A. Hilt. "Formaldehyde" in Ullmann's Encyclopedia of Industrial Chemistry (англ.) . — 2005. — doi : .
- G. Reuss, W. Disteldorf, A. O. Gamer, A. Hilt. "Formaldehyde" in Ullmann's Encyclopedia of Industrial Chemistry (англ.) . — 2005. — doi : .
Литература
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М. : Советская энциклопедия, 1988. — 623 с. — 100 000 экз.
- Реутов О. А. и др. Органическая химия. В 4 частях. — М. : Бином. Лаборатория знаний, 2004.
- Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G. D. Aldehydes, Araliphatic // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi : .
- Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G. D. Aldehydes, Aliphatic // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi : .
- 2021-06-05
- 1
![{\displaystyle {\mathsf {R{-}CH_{2}OH{\xrightarrow[{DMP}]{}}R{-}CHO}}}](/images/008/285/8285731/7.jpg?rand=935765)
![{\displaystyle {\mathsf {CH_{2}(OH){-}CH_{2}(OH){\xrightarrow[{HIO_{4}}]{}}2CH_{2}O}}}](/images/008/285/8285731/9.jpg?rand=988397)





![{\displaystyle {\mathsf {[NH_{3}OH]Cl+RCOH\rightarrow RCH{=}N{-}OH+H_{2}O+HCl}}}](/images/008/285/8285731/40.jpg?rand=504715)