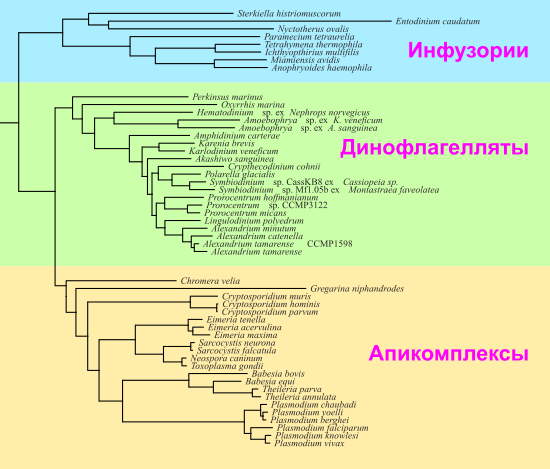
Interested Article - Динофлагелляты

- 2020-09-18
- 1
Динофлагелля́ты , или динофи́товые во́доросли , или динофи́ты , или перидине́и , или па́нцирные жгутиконо́сцы ( лат. Dinoflagellata syn. Dinophyta, Peridinea) — крупная группа протистов из надтипа альвеолят (Alveolata), которой традиционно присваивают ранг типа . Известно около 4000 ископаемых и более 2500 современных видов , из которых 90 % обитает в морях, остальные — в пресных водах . Около половины представителей — свободноживущие фотосинтезирующие организмы, однако известны и бесцветные гетеротрофные формы, и паразитические динофлагелляты . Некоторые виды являются симбионтами коралловых полипов и двустворчатых моллюсков .
Динофлагелляты представлены преимущественно одноклеточными монадными формами, подвижные клетки снабжены двумя неравными жгутиками . Клеточные покровы представлены (текой), состоящей из везикул , которые залегают под плазмалеммой . Митохондрии с трубчатыми кристами . Хлоропласты у разных представителей имеют различное происхождение и характеризуются различными фотосинтетическими пигментами . Обычно они окрашены в жёлто-бурый цвет, поскольку, кроме зелёных хлорофиллов , имеют дополнительные пигменты — например, . Геном хлоропластов часто фрагментирован на короткие кольцевые хромосомы. У многих видов имеется стигма (глазок) различного строения. Как правило, осморегуляцию осуществляют уникальные органеллы — . Нередко имеются стрекательные структуры ( трихоцисты и другие). Пресноводные формы запасают крахмал , морские — липиды и стеролы .
Хромосомы динофлагеллят обычно в течение всего клеточного цикла и лишены типичных эукариотных гистонов . Митоз закрытый, метафазная пластинка не образуется. Отличительной особенностью динофлагеллят, не встречающейся среди других эукариот, является частичное замещение тимина в их ядерной ДНК другим азотистым основанием — 5-гидроксиметилурацилом.
Размножение чаще всего происходит продольным делением клетки надвое. Бесполое размножение — зооспорами и апланоспорами . У некоторых видов описан половой процесс . У большинства представителей жизненный цикл гаплобионтный с зиготической редукцией, но есть и исключения. Многие виды способны образовывать покоящиеся формы ( цисты ).
Многие виды способны к биолюминесценции . Кроме того, часто в клетках динофлагеллят образуются токсины — например, гониатоксин . Данный токсин имеет свойство накапливаться в тканях моллюсков, ракообразных, рыб, что приводит к отравлению животных, питающихся ими, а также человека, если он употребит их в пищу .
Динофлагелляты играют важную роль в биоценозах морей и океанов, выступая, наряду с диатомеями , в качестве основных первичных продуцентов . Фототрофные динофлагелляты способны вызывать цветение воды , а массовые вспышки их численности в прибрежных водах ответственны за возникновение « красных приливов ». Паразитические динофлагелляты иногда служат причиной эпизоотий в популяциях рыб и ракообразных.
История изучения

Первые организмы, в настоящее время относимые к динофлагеллятам, были описаны в 1753 году английским натуралистом в трактате «Employment for the microscope» как «крошечные животные, которые вызывают свечение морской воды»; речь шла о ночесветках . В 1773 году датский натуралист Отто Фредерик Мюллер описал в своей книге два вида пресноводных динофлагеллят, дав им имена Bursaria hirundinella и Vorticella cincta (ныне известны соответственно как и ). В 1830-х годах немецкий естествоиспытатель Христиан Готфрид Эренберг , изучив множество проб морской и пресной воды, описал в статье «Beiträge zur Kenntnis der Organisation der Infusorien und ihrer geographischer Verbreitung, besonders in Sibirien» и ряде последующих работ несколько выделяемых и ныне родов динофлагеллят, среди которых , и . По имени первого из них представителей рассматриваемой группы стали именовать перидинеями .
В 1885 году немецкий учёный Отто Бючли выделил данную группу организмов в отряд простейших Dinoflagellata (в типифицированном варианте — Dinoflagellida ; данное название таксона длительное время использовалось протозоологами ). Название образовано от др.-греч. δῖνος ‘вращение’ и лат. flagellum ‘жгутик’ . В то же время альгологи Эугениус Варминг ( 1890 ) и Адольф Энглер ( 1892 ) поместили динофлагеллят в царство растений . Немецкий ботаник Адольф Пашер в своей системе водорослей ( 1914 ) выделил динофлагеллят в класс Dinophyceae в составе отдела Pyrrophyta (Pyrrhophyta, буквально «огненные растения» — от др.-греч. πυρρός ‘огненный’ и φυτóν ‘растение’; название дано из-за способности некоторых видов к биолюминесценции ). В позднейших ботанических классификациях динофлагеллят обычно либо трактовали как класс в составе Pyrrophyta, либо выделяли в самостоятельный отдел Dinophyta .
В 1950—1960-е годы появились первые подробные системы ископаемых динофлагеллят; наметившийся разрыв между классификациями современных и ископаемых динофлагеллят был в основном преодолён в 1990-е годы, чему способствовали более тщательное изучение морфологии ископаемых представителей (ставшее возможным с развитием электронной микроскопии ) и жизненных циклов современных видов .
Биология клетки
Вегетативная стадия жизненного цикла динофлагеллят преимущественно представлена монадными формами с дорсовентральным строением , гораздо реже встречаются ризоподиальные и коккоидные клетки . Однако другие стадии жизненного цикла могут быть представлены пальмеллоидными, амебоидными , нитчатыми и даже многоядерными формами . Так, паразитическая Pfiesteria piscicida на некоторых этапах своего жизненного цикла трансформируется в амебоидную форму. Другие динофлагелляты тоже могут менять свой облик. В частности, некоторые представители способны принимать форму «голого», лишённого жгутиков шара ( пальмеллы ). Делясь, одноклеточная пальмелла даёт начало плотному скоплению клеток. Динофлагелляты, обитающие в кораллах как , всегда имеют форму пальмелл .
Далее в этом разделе излагается строение вегетативной стадии динофлагеллят; строение других стадий жизненного цикла описывается в разделах и .
Форма динофлагеллят разнообразна: шаровидная, эллипсовидная, яйцевидная, обратнояйцевидная, грушевидная, звёздчатая, палочковидная , в виде полумесяца или тетраэдра . Клетки, как правило, уплощённые, в поперечном сечении имеют вид эллипса или пластинки, реже тело округлое и неуплощённое. Размеры клеток варьируют от 6 до 2000 мкм . Наиболее крупные динофлагелляты обитают в морях, а среди пресноводных представителей самые крупные клетки характерны для видов рода , их размер составляет до 450 мкм .
| Разнообразие форм клеток динофлагеллят | |||||||
|---|---|---|---|---|---|---|---|

|

|

|

|

|

|

|
|
| Ceratium | Gymnodinium | Ночесветка ( Noctiluca ) | Peridinium willei | Symbiodinium | Pfiesteria . Амёбоидная и жгутиковая формы, циста | Dinophysis acuminata | |
Клеточные покровы
У динофлагеллят клеточные покровы представлены наружной плазмалеммой и залегающей под ней амфиесмой , или текой — совокупностью цитоплазматической мембраны и ряда расположенных под ней амфиесмальных (текальных) везикул , или альвеол , каждая из которых представляет собой уплощённый пузырёк, окружённый одиночной мембраной . В покровах имеется множество пор, под которыми залегают трихоцисты . Число текальных везикул варьирует от нескольких сотен (например, ) до двух (например, ) на клетку. Их расположение также неодинаково: так, у текальные везикулы отделены друг от друга, а у некоторых других представителей они соприкасаются. У некоторых видов текальные везикулы заполнены только аморфной массой. Такие формы называют голыми, или беспанцирными . У других они содержат текальные пластинки, состоящие из целлюлозы и других полисахаридов , у некоторых видов они дополнительно затянуты белковой плёнкой ; покров таких динофлагеллят называют панцирем . Отмечено, что чем толще текальные пластинки, тем их меньше. У Katodinium пластинки относительно тонкие, а у и Ceratium они очень толстые и могут иметь разнообразные выросты, при этом их число сокращается до двух десятков. Выросты на панцирях динофлагеллят могут иметь форму рогов, крыльев, чешуй, они значительно увеличивают поверхность клетки . Показано, что некоторые динофлагелляты способны сбрасывать панцирь при некоторых условиях, например, при охлаждении до 4 °С, однако при переносе сбросивших панцирь клеток в обычные условия панцирь восстанавливается. Пластинки, образующие панцирь, играют ключевую роль в определении панцирных динофлагеллят. Они составляют так называемую формулу теки , где определённые пластинки обозначаются цифрами и буквами. В качестве систематических признаков используют также форму, количество, размещение пластинок и наличие выростов .

В амфиесме различают три части: верхнюю эпивальву (эпитека, эписома, эпикон), нижнюю гиповальву (гипотека, гипосома, гипокон) и среднюю — поясок , или цингулюм , который соединяет эпивальву и гиповальву. У панцирных форм эпивальва и гиповальва состоят из отдельных щитков, которые в определённом порядке соединяются швами. Именно за счёт разрастания швов происходит рост панциря. Эпивальва и гиповальва представляют собой две полусферы, сходящиеся в области пояска . Верхушка эпивальвы иногда оканчивается апексом , при этом нижний конец панциря называется антапексом . У многих видов на панцире имеется две перпендикулярные бороздки — поперечная и продольная, в которых залегают жгутики . Поперечная бороздка делит панцирь на эпивальву и гиповальву, она может быть смещена к переднему ( ) или заднему ( Katodinium ) концу или же проходить по экватору клетки. Поперечная бороздка может полностью опоясывать спинную сторону панциря, соединяясь (кольцевая) или не соединяясь (спирально завитая) с другим своим концом на брюшной стороне. Продольная бороздка располагается на брюшной стороне и проходит только по гиповальве, лишь иногда переходя на эпивальву. Однако у видов рода Gonyaulax она не только доходит до апекса, но и переходит на спинную сторону .
Под текальными везикулами залегает слой микротрубочек . Кроме того, у многих динофлагеллят в текальных везикулах под пластинами имеется добавочный слой, устойчивый к сильным кислотам и основаниям и состоящий из вещества, напоминающего . Кроме того, некоторые виды имеют дополнительную мембрану под текальными везикулами. У некоторых динофлагеллят, например, Amphidinium carterii , снаружи от плазмалеммы имеется гликокаликс , состоящий из кислых полисахаридов. Возможно, его образуют цитоплазматические мукоцисты .
На поверхности клеток некоторых динофлагеллят имеются органические чешуйки, например, у Lepidodinium viride . У Heterocapsa чешуйки формируются в аппарате Гольджи и в везикулах мигрируют к базальным тельцам жгутиков, откуда высвобождаются на поверхность клетки . У некоторых представителей имеется внутренний кремниевый скелет. Так, у фаготрофной динофлагелляты Actiniscus pentasterias около ядра располагаются две пятилучевые кремниевые звезды .
В некоторых источниках под «амфиесмой» понимают самые верхние слои клетки динофлагеллят (плазмалемму, текальные везикулы с пластинками и слой микротрубочек), а «текой» называют совокупность текальных везикул .
Теки динофлагеллят. Сканирующая электронная микроскопия
Жгутики
У различных динофлагеллят жгутики могут быть прикреплены по-разному. Если два неравных жгутика отходят от апикального конца клетки, то такой тип называется десмоконтным (например, у Prorocentrum ); такой вариант отхождения жгутиков считается примитивным. В этом случае при плавании один жгутик направлен вперёд, а другой — перпендикулярно первому. Однако у большинства динофлагеллят имеет место более эволюционно продвинутый вариант, при котором оба неравных жгутика отходят от вентральной стороны клетки ( диноконтный тип отхождения жгутиков). У этих динофлагеллят клетки разделены на эпивальву и гиповальву, причём поперечный жгутик лежит в поперечной бороздке, а продольный — в продольной .
Оба жгутика имеют типичную для эукариот аксонему (9 периферических дуплетов микротрубочек и 2 центральные микротрубочки). Каждый жгутик выходит из небольшого впячивания на поверхности клетки ( жгутикового канала ), которое открывается жгутиковой порой . У большей части динофлагеллят каждый жгутик имеет собственный жгутиковый канал. Переходная зона жгутиков у некоторых видов может включать 2 параллельных диска, залегающих при основании двух центральных микротрубочек и одно или два нижележащих кольца. Однако у большинства динофлагеллят переходная зона представлена сильно изогнутой поперечной пластинкой с мощными периферическими валиками и развитым утолщением в центре пластинки (аксосомой). У Gymnodinium lanskaya и Heterocapsa pigmaea над поперечной пластинкой располагается переходный цилиндр, а у последнего вида, кроме того, имеется две поперечные пластинки вместо одной .

Поперечный жгутик имеет вид волнистой ленты и по длине в 2—3 раза превосходит продольный жгутик. Он выходит из верхней жгутиковой поры и поворачивает влево, опоясывая клетку. Кроме аксонемы он имеет исчерченный параксиальный тяж, состоящий из белка — Ca 2+ -зависимого сократительного белка. Он выполняет механическую функцию и всегда короче аксонемы, которая располагается по левозакрученной спирали вокруг него. Сокращение жгутика сопровождается увеличением степени спирализации аксонемы. На мембране поперечного жгутика располагается ряд длинных (2—4 мкм длиной и 10 нм шириной) простых тонких волосков ( мастигонем ), которые могут быть как одинаковой, так и различной длины. Последний микрометр поперечного жгутика лишён волосков и параксиального тяжа. Этот жгутик движется короткими периодическими волнами против часовой стрелки, если смотреть с переднего конца клетки ( лейотропное направление), обеспечивая вращательные и поступательные (в виде толчков) движения клеток . Поперечный жгутик играет роль руля клетки. Клетка всегда вращается в направлении биения жгутика, так что жидкость направляется в противоположном ( дексиотропном ) направлении . У Noctiluca поперечного жгутика нет, и она не может вращаться во время плавания .
Продольный жгутик берёт начало в нижней жгутиковой поре и тянется вдоль клетки, выходя за её пределы. Этот жгутик имеет обычное строение, и нередко волоски (длиной до 0,5 мкм и шириной до 10 нм) на его мембране располагаются в два ряда. Иногда в продольном жгутике имеется и параксиальный тяж. Вдоль длины продольного жгутика проходит R-волокно. Сокращение жгутика происходит при сокращении R-волокна на треть своей длины, которое вызывается входом ионов Ca 2+ в продольный жгутик. Он движется волнообразно, и с его помощью клетка осуществляет поступательное движение по направлению вперёд, резко останавливается и движется назад. Механическое воздействие на клетки Ceratium tripos вызывает сокращение продольного жгутика, так что он укладывается в продольную бороздку .
Среди фотосинтезирующих одноклеточных организмов динофлагелляты — самые быстрые пловцы, их скорость передвижения составляет 200—500 мкм/с. Впрочем, они всё-таки уступают Mesodinium — организму, представляющему собой эндосимбиоз инфузории и криптофитовой водоросли . Клетки плавают с линейной скоростью 250 мкм/с при температуре 20 °С, а клетки Gyrodinium при той же температуре развивают линейную скорость 319 мкм/с .
Базальные тела жгутиков динофлагеллят имеют типичное для эукариот строение. Они могут располагаться под углом почти 180°, перпендикулярно или параллельно друг другу. От базального тела продольного жгутика начинается лентовидный корешок из микротрубочек, проходящий под продольной бороздой. Базальное тело поперечного жгутика связано с микротрубочковым корешком из одной или двух микротрубочек, к которым под прямым углом, подобно гребёнке, прикрепляется ещё один ряд микротрубочек. Базальные тела соединены друг с другом поперечнополосатым соединением из центрина. У различных динофлагеллят корешковая система может как редуцироваться, так и усложняться добавлением дополнительных компонентов .
Динофлагелляты с немонадным типом организации таллома — коккоидным (роды Cystodinium , Stylodinium , Tetradinium и другие), ризоподиальным ( Dinamoebidium ), пальмеллоидным ( Gloeodinium ), нитчатым ( Dinothrix , Dinoclonium , Rufusiella ) — на стадии зооспоры являются подвижными клетками с двумя жгутиками, напоминающими вегетативные клетки гимнодиниума, а позднее жгутики сбрасывают. При этом у организмов с нитчатым талломом после отбрасывания жгутиков клетки совершают несколько делений, но не расходятся, а образуют слабо ветвящуюся нить из округлых клеток .
Ядро и генетический аппарат
Морфология ядра

Организация ядра и генетического аппарата динофлагеллят в высшей степени необычна; по этой причине ядро динофлагеллят получило название мезокарион , или динокарион . В частности, хромосомы динофлагеллят на протяжении всего клеточного цикла (в том числе и в интерфазе ). Интересно, что основным структурным белком хроматина у динофлагеллят является белок вирусного происхождения, совершенно не похожий на гистоны , вирусный нуклеопротеин динофлагеллят (dinoflagellate viral nucleoprotein; DVNP). Однако, у большинства исследованных видов, гистоны также экспрессируются . Так как хромосомы в ядрах динофлагеллят не претерпевают циклических преобразований и постоянно конденсированы, некоторые авторы предлагают называть такой тип организации ядер хромосомным. Обычно хромосомы располагаются в нуклеоплазме на некотором расстоянии друг от друга, заполняют всё пространство ядра и почти полностью маскируют его содержимое; так происходит, например, у Gloeodinium montanum и Amphidinium elegans . У некоторых динофлагеллят, в основном свободноживущих, часть хромосом прикреплена к оболочке и находится в таком состоянии на протяжении всего митоза. Иногда отдельные хромосомы погружаются в ядрышко . Из-за постоянной конденсированности хромосом динофлагеллят их даже считали переходным звеном между прокариотами и эукариотами ( мезокариотами ), пока не была установлена связь динофлагеллят с Alveolata .
Ядро в клетках динофлагеллят может быть самой разнообразной формы: сферической, яйцевидной, треугольной, серповидной, многолопастной, подковообразной, почковидной или притуплённо-конической формы. Размеры ядра также варьируют в широких пределах: от 0,37 мкм ( Cochlodinium heterolobatum ) до 40—50 мкм ( Ceratium cornutum ). Обычно ядро располагается в центре клетки, однако может смещаться к переднему или заднему концу. Его расположение в клетке зависит от стадии жизненного цикла, а также наличия или отсутствия пищеварительной вакуоли . В каждом содержится одно или несколько способных к слиянию ядрышек . Иногда ядро динофлагеллят окружено, помимо двухмембранной оболочки, ещё и каналом эндоплазматического ретикулума ( Ceratium hirundinella ), а у Nematodinium armatum выявлено несколько таких каналов . Для клеток динофлагеллят характерно очень высокое содержание ДНК . В клетках других эукариот, как правило, содержится от 0,046 до 3 пг ДНК на клетку, а у динофлагеллят — 3—250 пг ДНК, то есть общий размер содержащейся в их клетках ДНК составляет от 3000 до 215 000 мегабаз (Мб, миллионов пар оснований). Для сравнения: гаплоидный геном человека имеет размер 3180 Мб, а гексаплоидный геном пшеницы составляет 16 000 Мб .
Количество хромосом у динофлагеллят варьирует в широких пределах: от 4 у Syndinium borgertii и 12—18 у Prorocentrum balticum до 260—280 у Ceratium hirundinla , 325 у Endodinium chattonii и 500—600 у отдельных видов Gymnodinium . Как правило, у свободноживущих динофлагеллят хромосом больше, чем у паразитических. Размеры хромосом сильно варьируют даже в пределах одного кариотипа . Например, у Prorocentrum micans их длина достигает 10—15 мкм, у Woloszynskia stoschii — 1,3—3,3 мкм, у Gymnodinium indicum — от 0,75 до 1,5 мкм, а у Katodinium rotundata диаметр почти сферических хромосом не превышает 0,5 мкм. Такие короткие хромосомы лишены центромер и вторичных перетяжек и слабо дифференцируются по длине. Различна и форма хромосом, причём форма хромосом связана с их размером: длинные — нитевидные ( Prorocentrum micans ), короткие — стержневидные ( Gymnodinium vitiligo ), мелкие — точкообразные или бочонковидные ( Amphidinium klebsii ). Обычно кариотип одного вида представлен хромосомами одной формы, которые морфологически неотличимы. С этим связаны трудности подсчёта количества хромосом у динофлагеллят, поэтому обычно их количество удаётся оценить лишь примерно .
Динокарион имеется не у всех динофлагеллят. У некоторых представителей ядра обычные эукариотические ( Noctiluca , ); у некоторых представителей в вегетативных клетках ядра обычные и динокарион присутствует на других стадиях клеточного цикла (например, гаметах). У свободноживущего динофлагеллята хромосомы менее конденсированы, чем в динокарионе, и содержат типичные эукариотические гистоны .
У некоторых динофлагеллят имеется два ядра, причём, в отличие от других многоядерных клеток (например, инфузорий ), эти ядра содержат ДНК различного происхождения: одно ядро содержит генетическую информацию динофлагелляты, а другое ядро, по сути, является ядром симбиотической диатомовой водоросли . Интересно, что не только ядро, но также митохондрии и пластиды диатомеи сохраняют функциональность .
ДНК

Вегетативная фаза динофлагеллят гаплоидна, исключение составляет лишь диплоидная ночесветка ( Noctiluca ) . Хромосомы динофлагеллят морфологически одинаковы и конденсированы на протяжении всего клеточного цикла — в отличие от прочих эукариот, у которых хромосомы конденсируются только при митозе , а в интерфазе, когда идёт активная транскрипция , степень конденсации значительно ниже. Впрочем, недавние исследования Pyrocystis lunula выявили наличие у этой динофлагелляты 49 пар хромосом различного размера и морфологии, что свидетельствует о её диплоидности . В световой микроскоп они видны как чёткие структуры, а на ультраструктурном уровне они имеют фибриллярное строение . Конденсация хромосом в интерфазе наблюдается также у эвгленовых , но, в отличие от них, для ДНК динофлагеллят характерен ещё и необычный химический состав . Хромосомы динофлагеллят лишены центромер , и во время митоза они прикрепляются кинетохорами напрямую к ядерной мембране .
У динофлагеллят отсутствуют типичные эукариотические коровые гистоны ( , , H3 , ), однако у них имеется возможный гомолог гистона , который регулирует компактизацию ДНК. Впрочем, недавние анализы транскриптома выявили наличие у динофлагеллят транскриптов не только всех коровых гистонов, но и некоторых их вариантов ( и ). Эти белки заведомо не задействованы в упаковке большей части геномной ДНК (по крайней мере на вегетативной стадии жизненного цикла большинства динофлагеллят). Возможно, они участвуют в упаковке лишь очень малой доли генома и по этой причине не определяются экспериментально; а может быть, они упаковывают ДНК только на некоторых стадиях жизненного цикла (в том числе в цистах) . Из-за этого у динофлагеллят нет нуклеосом , и ДНК упакована иначе: она неоднократно спирализована и образует толстые нити, хотя элементарные фибриллы (микрофибриллы) у них имеют толщину 2—8 нм, как у бактерий , вместо более толстых эукариотических фибрилл толщиной 10—25 нм . Хромосомы динофлагеллят различаются по плотности, которая прямо зависит от того, как плотно упакованы микрофибриллы хромосом. Этот фактор может зависеть от стадии клеточного цикла, изменения светового режима, концентрации питательных веществ , так что у организмов одного вида можно встретить то более, то менее рыхлые хромосомы .
Среди азотистых оснований у динофлагеллят явно преобладают фракции аденина и тимина , в очень незначительном количестве (0,4 ± 0,3 %) имеется . Как было показано в 1973 году Питером Рэем, изучавшим состав ядерной ДНК у вида Gyrodinium cohnii , около 37 % тимина в ней было замещено другим пиримидиновым основанием — 5-гидроксиметилурацилом . Позднейшие исследования показали, что доля замещённого тимина у различных видов динофлагеллят составляет от 12 % до 70 %, и это — уникальная их особенность, не встречающаяся у других эукариот; в то же время 5-гидроксиметилурацил является естественным компонентом генома некоторых бактериофагов — например, фагов сенной палочки ( Bacillus subtilis ). У большинства эукариот данное азотистое основание образуется при окислении тимина или и быстро репарируется . Функциональное значение 5-гидроксиметилурацила в ядрах динофлагеллят остаётся неизвестным . Как и у большинства других эукариот, у динофлагеллят имеются метилированные мотивы mCpG и 5-метилцитозин, а также необычный N 6 -метиладенин . Синтез ДНК у динофлагеллят не приурочен к определённой фазе клеточного цикла, как у других эукариот, а идёт непрерывно, как у прокариот .
Вместо типичных гистонов у динофлагеллят имеются особые основные гистоноподобные белки ( англ. histone-like proteins, HLP ), которые и осуществляют упаковку ДНК. По вторичной структуре они напоминают гистоноподобные белки бактерий. По сравнению с коровыми гистонами эти белки имеют очень слабое сродство к ДНК. HLP динофлагеллят ассоциированы с ядрышком и петлями, выступающими из конденсированных хромосом. Концентрации этих белков чрезвычайно низки, и соотношение основные белки: ДНК составляет всего 0,08—0,13, при том что у большинства эукариот это значение приближается к 1 . Только лишь 20 % геномной ДНК защищено белками, и обычно защищённые участки длиной 10—15 килобаз разделяются длинными незащищёнными участками. Было показано, что ДНК в хромосомах динофлагеллят может находиться в двух состояниях: основная фракция, которая содержит транскрипционно неактивную ДНК, и диффузная периферическая фракция, содержащая транскрипционно активную ДНК. Эти данные подтверждают давнюю гипотезу о том, транскрипция у динофлагеллят происходит вне хромосом, где соответствующие ферменты могут получить доступ к последовательностям ДНК вне конденсированных хромосом . HLP способны регулировать уровень конденсации ДНК в зависимости от собственной концентрации, поэтому, вероятно, они отвечают за конденсацию выступающих петель и регулируют доступ транскрипционных факторов к генам .
Эксперименты по ренатурации показали, что даже у динофлагеллят с огромными геномами имеется большая доля уникальных последовательностей. Так, у Heterocapsa pygmaea она составляет 75 %, у Crypthecodinium cohnii — 40—45 % и у Glenodinium foliaceum — 56 % . У гетеротрофа Crypthecodinium cohnii уникальные последовательности (1—3 копии) разделяются областями повторов длиной около 600 нуклеотидов . Общая длина уникальных последовательностей у этой динофлагелляты составляет 1,5 × 10 9 пар оснований, что типично для «высших» эукариот. У автотрофной динофлагелляты Wolosynskia bosteniensis длина уникальных последовательностей оценивается в 1,32 × 10 10 , что на порядок больше аналогичного параметра у млекопитающих . По этой причине гипотеза, объясняющая большое количество ДНК в клетках динофлагеллят полиплоидностью, неверна: при полиплоидии доля уникальных последовательностей будет значительно ниже .
Экспрессия генов
В последнее время было сделано несколько важных открытий относительно особенностей транскрипции у динофлагеллят. Одним из них стало открытие 5'- транс -сплайсинга транскриптов динофлагеллят. Оказалось, что 5'-концы всех транскриптов, экспрессируемых в ядре, содержат одну и ту же лидерную последовательность длиной 22 нуклеотида. К настоящему моменту транс -сплайсинг описан у всех изученных динофлагеллят, даже тех, которые отделились очень рано в ходе эволюции, так что этот процесс, по-видимому, был одним из ранних приобретений ветви динофлагеллят. Сами лидерные последовательности кодируются рядами повторяющихся генов неизвестного размера и количества. Явление транс -сплайсинга описано для ограниченного количества мРНК у некоторых других эукариот, однако наиболее хорошо оно изучено у трипаносом , которые интенсивно используют его. Интенсивное использование 5'- транс -сплайсинга динофлагеллятами и трипаносомами является, по-видимому, результатом конвергентной эволюции .
Некоторые другие свойства генетического аппарата динофлагеллят также обнаруживают сходство с трипаносомами. Как и у трипаносом, у динофлагеллят гены собраны в тандемные ряды, кодирующие почти идентичные белки. Показано, что наиболее интенсивно экспрессируемые гены собраны в более крупные тандемные ряды, а гены, экспрессирующиеся на низком уровне, присутствуют в единичном экземпляре и содержат больше интронов . Транскрипты, как и у других эукариот, обычно содержат сигнал полиаденилирования (AAAAG/C). Иногда транскрипты динофлагеллят не содержат интронов, а зрелые мРНК могут быть как полицистронными , так и дискретными, а также, в некоторых случаях, лишены полиаденилирования . Важным процессом, влияющим на регуляцию экспрессии генов у динофлагеллят в ходе эволюции, может быть амплификация генов. Если у динофлагеллят, как и у трипаносом, экспрессия большинства генов , то амплификация генов в геноме может быть ключевым механизмом регуляции количества транскриптов генов в клетке. Некоторые гены в рядах лишены типичных промоторов , распознаваемых РНК-полимеразой II , хотя этот фермент у динофлагеллят всё же функционирует в качестве РНК-полимеразы . Вблизи генов динофлагеллят нет ТАТА-боксов , однако у был обнаружен видоизменённый (ТВР), который показал высокое сродство к мотиву ТТТТ. Подобных промоторов к настоящему моменту идентифицировано не было. Возможно, что целый ряд имеет единственный вышестоящий промотор. Поскольку у динофлагеллят ряды состоят из копий одного и того же гена, а не разных генов, как у трипаносом, отдельные могут всё же регулироваться на уровне транскрипции вышележащим промотором .
Вероятно, что в регуляции экспрессии генов динофлагелляты полагаются в основном на посттранскрипционные механизмы , хотя имеют место и . В некоторых случаях использование тех или иных механизмов зависит от внешнего стимула. Транскрипционная регуляция была показана для - хлорофилл a -связывающего белка, -подобного белка, -подобного белка, а также гистон-подобного белка. Посттранскрипционные механизмы были описаны в регуляции гена люциферин -связывающего белка и .
Несмотря на все отличия генетического аппарата динофлагеллят от остальных эукариот, оказалось, что сплайсинг и обеспечивающие его белки и РНК у них почти не отличаются от высших эукариот. Они имеют консервативные малые ядерные РНК U1—U6, которые имеют схожую с высшими эукариотами вторичную структуру и посттранскрипционные модификации . Ядерные тельца, содержащие белки сплайсинга, оказались похожими на тельца Кахаля других эукариот .
Показано, что у динофлагеллят экспрессия небольшой, но значимой доли генов зависит от различных условий. Анализ транскриптома Pyrocystis lunula с применением микрочипов показал, что количество транскриптов около 3 % генов значительно изменялось в соответствии с циркадными ритмами , а ещё 4 % — с окислительным стрессом . Проводились исследования по различиям транскриптомов токсинообразующих и не образующих токсинов штаммов динофлагеллят. Оказалось, что 4—7 % транскриптомов в этих случаях значительно различаются .
Митоз
Для митоза динофлагеллят характерен ряд особенностей: ядерная мембрана сохраняется (закрытый митоз), не формируется метафазная пластинка . Такой тип закрытого митоза получил название диномитоз . В качестве примера наиболее продвинутого типа митоза у динофлагеллят можно рассмотреть митоз . Начало деления знаменуется удвоением оснований жгутиков с двух до четырёх. В течение этой стадии ядро увеличивается в размерах и можно разглядеть много Y- и V-образных хромосом. В профазе митоза происходит продольное расщепление хромосом и образуются хроматиды , спирально закрученные вокруг друг друга. Продолжительность профазы у динофлагеллят в значительной мере определяется длиной хромосом: чем хромосомы длиннее, тем больше времени занимает их раскручивание .
Оболочка ядра остаётся интактной во время митоза, и во время митоза возникают её глубокие впячивания (у некоторых динофлагеллят ядерная оболочка растворяется). Некоторые из них образуют сквозные туннели, проходящие через всё ядро насквозь (образуется от 1 до 15 туннелей). Эти туннели заполнены цитоплазмой, и в них начинают собираться микротрубочки, которые, однако, не соединены с нетронутой ядерной оболочкой. Микротрубочки собираются в пучки по 25—40 сразу после разделения хромосом на хроматиды. У в ядре образуется 2—4 туннеля, у других видов их больше .
Выше уже было отмечено, что хромосомы прикрепляются к ядерной мембране напрямую через особые кинетохоры (кинетохорные пластинки). Кинетохорные пластинки появляются в полностью сформированных туннелях вместе с дифференциацией ядерной оболочки. Таким образом, ядерная оболочка как бы разграничивает хромосомы и микротрубочки веретена. Динофлагелляты — единственные водоросли со внеядерным веретеном деления .
В метафазе у динофлагеллят не формируется метафазной пластинки, характерной для митоза высших эукариот, и хромосомы остаются разбросанными по ядру. Ядрышко существует в течение всего клеточного цикла и делится путём образования сужения посередине. В анафазе клетка и ядро удлиняются в латеральном направлении, а хромосомы расходятся к противоположным концам ядра. Пока ещё происходит латеральное удлинение, в центре клетки ядерная мембрана образует перетяжку, и дочерние ядра становятся независимыми .
На полюсах веретена у динофлагеллят могут быть как типичные центриоли ( центрический митоз ), так и полярные образования совсем другой природы ( ацентрический митоз ). Полярные образования могут представлять собой область цитоплазмы с большим скоплением элементов эндоплазматического ретикулума и диктиосом ; в других случаях они являются бесструктурными полупрозрачными уплотнениями цитоплазмы; наконец, полярное образование может представлять собой морфологически дифференцированное бесструктурное многодольчатое тело .
Митохондрии

Митохондрии динофлагеллят имеет трубчатые кристы , отходящие от внутренней мембраны и суженные у основания . Организация митохондриального генома динофлагеллят имеет ряд уникальных особенностей. Их митохондриальный геном, как и у их близких родственников — апикомплексов , значительно сокращён: в нём имеется всего лишь 3 белок-кодирующих гена (кодируют (cob) , (cox1) и субъединицу 3 цитохромоксидазы (cox3) ), два гена, кодирующих рРНК (рРНК малой субъединицы (SSU) и большой субъединицы (LSU)), и совсем нет генов, кодирующих тРНК . И у динофлагеллят, и у апикомплексов митохондриальные гены рРНК значительно фрагментированы. Митохондриальный геном динофлагеллят подвергся значительной амплификации и рекомбинации , в результате чего в нём множество копий генов и фрагментов генов соединяются друг с другом в различных комбинациях. Подобным дупликациям и перестройкам подверглись и некодирующие последовательности . У некоторых динофлагеллят в митохондриальном геноме содержатся , способные формировать элементы вторичной структуры (например, шпильки ). Из-за дупликации и рекомбинации реальный размер и организация митохондриального генома динофлагеллят остаются неизвестными. Предварительные исследования с использованием гель-электрофореза показали, что митохондриальный геном рассредоточен по множеству линейных хромосом, размер которых не превышает 30 килобаз .

Кроме того, экспрессия митохондриальных генов динофлагеллят также характеризуется необычными особенностями. Белоккодирующие гены мтДНК лишены стандартных старт-кодонов AUG, более того, динофлагелляты не используют и обычные стоп-кодоны . Транскрипты cox1 и cob полностью лишены стоп-кодонов, в транскриптах cox3 стоп-кодон UAA всё же имеется, однако он не транскрибируется с ДНК, а образуется путём олигоаденилирования U , расположенного на конце исходного транскрипта и входящего в состав последней рамки считывания . У динофлагелляты Karlodinium micrum процессинг транскриптов cox3 включает транс -сплайсинг мРНК — процесс, при котором кодируемые независимо транскрипты-предшественники cox3 соединяются вместе, давая зрелый транскрипт. Транс -сплайсинг cox3 был описан и у других динофлагеллят .
В митохондриальных транскриптах большей части динофлагеллят происходит интенсивное редактирование РНК , затрагивающее до 6 % нуклеотидов . При редактировании РНК некоторые нуклеотиды, соответствующие нуклеотидам ДНК, заменяются на другие. К числу наиболее частых изменений, вносимых редактированием РНК, можно отнести транзиции С → U и U → C. У динофлагеллят кроме таких транзиций происходят также транзиции А → G и небольшое количество трансверсий . Интересно, что, хотя системы редактирования РНК функционируют у некоторых других эукариот, они отсутствуют у ближайших родственников динофлагеллят — инфузорий и апикомплексов. Это может свидетельствовать в пользу того, что механизм редактирования РНК возник на начальных этапах эволюции динофлагеллят независимо от других групп организмов .
Хлоропласты
Хлоропласты динофлагеллят дисковидные, однако они могут иметь пластинчатую, лентовидную или другую форму. В клетке они могут располагаться около границы клетки, а могут радиально расходиться от центра клетки. Количество хлоропластов в клетке варьирует от одного до множества .
Эндосимбионты
В отличие от других эукариот, у динофлагеллят процессы приобретения хлоропластов в ходе эндосимбиоза и их утери протекают сравнительно легко и являются обычным явлением. Этим, вероятно, и объясняется огромное разнообразие хлоропластов у динофлагеллят. Для большинства их разновидностей характерно наличие оболочки из трёх мембран, в состав которой не входит эндоплазматический ретикулум , тилакоиды собраны в стопки по три. Среди предполагаемых древних и недавно приобретённых эндосимбионтов динофлагеллят обнаружены:
- цианобактерии : например, у Ornithocercus magnificus , Citharistes regius ;
- красные водоросли : у всех динофлагеллят, содержащих хлоропласты с тремя мембранами и перидинином, например, у видов рода Ceratium ;
- гаптофитовые водоросли : например, у Gymnodinium mikimotoi , G. breve и G. galatheanum ;
- криптофитовые водоросли : например, у Gymnodinium eucyaneum , G. acidotum ;
- : например, у Lepidodinium viride , Gymnodinium chlorophorum ;
- диатомовые водоросли : например, у Peridimium balticum , P. foliaceum ;
- предполагаемые : например, у Podolampas bipes .
У некоторых динофлагеллят, например, у spp. и Amphidinium poecilchroum , имеет место клептопластия : в их клетках временно содержатся хлоропласты, заимствованные у фотосинтезирующей добычи . Для вида характерна двойная клептопластия: представители данного вида заимствуют пластиды у поедаемых ими инфузорий Myrionecta rubra , а те, в свою очередь, накапливают хлоропласты поглощаемых ими криптофитов вида .
Типы хлоропластов
Перидинин
Известно пять основных типов хлоропластов у динофлагеллят, каждый из которых имеет свою эволюционную историю и характеризуется наличием особого набора пигментов .
У динофлагеллят наиболее распространены хлоропласты , содержащие пигмент перидинин (перидининсодержащие хлоропласты) . Эти хлоропласты окружены тремя мембранами и являются результатом вторичного эндосимбиоза с красной водорослью. Перидинин — это основной каротиноидный пигмент динофлагеллят, он поглощает световую энергию в сине-зелёной области спектра (470—550 нм) и вместе с хлорофиллом входит в состав белкового светособирающего комплекса. Хлорофиллы а и и перидинин служат основными фотосинтетическими пигментами . Кроме перидинина, в хлоропластах динофлагеллят присутствуют β-каротин , диадиноксантин , диноксантин и прочие каротиноиды. В хлоропластах такого типа обнаружена форма II Рубиско , которая имеется, помимо динофлагеллят, у некоторых бактерий (подробнее ). Пиреноиды встречаются редко. Они могут быть различной формы: простые пиреноиды, расположенные внутри хлоропласта, сложные внутренние голые пиреноиды, пиреноиды, выступающие из хлоропластов в виде почки, а также пиреноиды, сидящие на одной или нескольких ножках. Функции пиреноидов в клетках динофлагеллят неизвестны .
Второй тип хлоропластов у динофлагеллят — фукоксантинсодержащие хлоропласты , которые имеются у видов Gymnodinium mikimotoi , G. breve и G. galatheanum . Эти хлоропласты тоже покрыты тремя мембранами, однако они произошли в результате третичного эндосимбиоза динофлагеллята, утратившего эндосимбионта-красную водоросль, и гаптофитовой водоросли. Они содержат гексаноилфукоксантин и/или бутаноилфукоксантин, хлорофиллы c 1 и c 2 , однако лишены перидинина .
Третий тип хлоропластов ведёт своё начало от эндосимбиотических криптофитовых водорослей и известен для представителей рода . Происхождение этих хлоропластов подтверждается как ультраструктурными особенностями и составом пигментов, так и последовательностью гена psbA и малой субъединицы рРНК. В отличие от криптофит, пластиды динофлагеллят покрыты двумя, а не четырьмя мембранами, и лишены нуклеоморфа . Может быть, что эти хлоропласты являются не постоянными, а клептопластами .
Четвёртый тип пластид имеется у Peridimium balticum и P. foliaceum . Эти пластиды произошли от диатомовых водорослей в результате третичного эндосимбиоза. Они отделены от цитоплазмы динофлагеллята-хозяина единственной мембраной, под которой находится ядро, митохондрии, рибосомы и хлоропласты с хлоропластным эндоплазматическим ретикулумом, ламеллами из трёх тилакоидов и опоясывающей ламеллой. Главные пигменты этих хлоропластов — хлорофилл c 1 и фукоксантин. Кроме того, хозяева-динофлагелляты содержат трёхмембранные производные сильно редуцированных перидининсодержащих хлоропластов. По-видимому, P. balticum и P. foliaceum представляют собой промежуточную стадию между поглощением эндосимбионта и его редукцией до маленького ядра (нуклеоморфы) и пластид .
Пластиды пятого типа произошли в результате вторичного эндосимбиоза с зелёной празинофициевой водорослью. Они имеются у по крайней мере двух динофлагеллят — Lepidodinium viride и Gymnodinium chlorophorum . Они покрыт двумя мембранами, содержат хлорофиллы a и b , празиноксантин .
Геном хлоропластов
Геном хлоропластов перидининсодержащих водорослей примечателен тем, что он представлен не единственной кольцевой молекулой ДНК, а разбит на миникольца размером 2—3 килобазы, содержащие один или несколько генов и некодирующую коровую последовательность, которая, судя по всему, содержит точку начала репликации . И репликация, и транскрипция пластидных миниколец происходит по механизму катящегося кольца . Было высказано предположение, что целое миникольцо транскрибируется в непрерывно в несколько оборотов, давая длинный транскрипт, содержащий несколько копий мРНК, соответствующей целому кольцу. Далее эндонуклеазы разрезают его на длинные мРНК -предшественники, которые далее подвергаются процессингу в зрелые мРНК, в том числе полиуридинилированию по 3'-концу. К настоящему моменту было описано только лишь 16 генов, кодируемых миникольцами, так что они являются наименьшими из известных на данный момент пластидных геномов. Гены на миникольцах кодируют 12 коровых субъединиц четырёх главных комплексов мембраны тилакоида ( фотосистемы I и II , цитохром b 6 -f комплекс и АТР-синтаза ), два рибосомных белка и два ещё не охарактеризованных белка. Остальные гены, необходимые для фотосинтеза, были перенесены в ядерный геном. Остаётся неясным, почему пластидный геном динофлагеллят подвергся столь значительному сокращению, однако, по-видимому, это было ранним событием в эволюционной истории динофлагеллят .
Известно, что гены, содержащиеся в геномах органелл , подвержены более интенсивному мутагенезу из-за близости активных форм кислорода . Кроме того, из-за отсутствия рекомбинации они накапливают мутации значительно быстрее ядерных геномов. Гены, перенесённые в ядро из пластид у динофлагеллят, включают 15 генов, которые у любого другого способного к фотосинтезу эукариотического организма кодируются геномом хлоропластов. Чем же можно объяснить тот факт, что 16 генов, тем не менее, всё-таки остались в пластидном геноме? Согласно одной из гипотез, гены, кодирующие ключевые элементы фотосинтезирующего аппарата, находятся под влиянием отбора, который удерживает их в хлоропластах, для того чтобы эти гены могли оперативно регулировать количество своих продуктов в ответ на изменения окислительно-восстановительных условий органеллы. Если бы эти гены содержались в ядре, то организмы, имеющие несколько пластид, не смогли бы оперативно доставлять необходимый белок в нуждающуюся органеллу. По этой причине набор генов в геноме перидининсодержащих хлоропластов может составлять тот самый минимальный набор генов, которые должны остаться в хлоропласте, чтобы поддерживать правильный окислительно-восстановительный баланс .
Белки, кодируемые генами пластид, переместившимися в ядро, характеризуются наличием трёхчленной сигнальной последовательности на N-конце , направляющей эти белки в хлоропласты, и гидрофобного участка, который облегчает попадание этих белков в транспортные везикулы. Эти транспортные везикулы далее сливаются с внешней мембраной хлоропласта. Такой белковый мотив, необходимый для попадания белка в хлоропласт, был независимо от динофлагеллят приобретён эвгленой , также имеющей трёхмембранные хлоропласты, которые, однако, происходят от зелёной , а не красной водоросли. Таким образом, в этом случае имеет место конвергентная эволюция. Ещё одной удивительной чертой перидининсодержащих пластид является то, что обычная I форма Рубиско у них заменена формой II, которая кодируется ядром. Вторая форма Рубиско имеет гораздо более низкое сродство к СО 2 по сравнению с первой формой фермента, и обычно она обнаруживается у протеобактерий , растущих в условиях высокого уровня СО 2 и низкого уровня О 2 . Возможно, у динофлагеллят имеются новые механизмы для концентрирования СО 2 , которые компенсируют низкое сродство фермента к СО 2 . Интересно, что недавно форма II Рубиско была найдена у двух других альвеолят, и родственного вида, пока ещё не получившего официального названия и известного как CCMP3115. Эти данные свидетельствуют о том, что форма II Рубиско появилась у общего предка динофлагеллят и апикомплексов .
Другие типы пластид, появившиеся в результате эндосимбиозов с не-красными водорослями, были приобретены позже перидининсодержащих пластид, и их геномы имеют вид, обычный для пластидных геномов (единственная кольцевая молекула ДНК) .
Эволюция хлоропластов
Считается, что исходным типом пластид для динофлагеллят стали перидининсодержащие пластиды, возникшие в результате вторичного эндосимбиоза с красной водорослью. Однако у видов, находящихся в основании эволюционного древа динофлагеллят ( и Oxyrrhis ) пластиды не обнаружены. Кроме того, недавно в лишённых света океанских глубинах была обнаружена новая группа предположительно гетеротрофных альвеолят, которые, по данном филогенетического анализа, находятся вблизи основания древа динофлагеллят . Способные к фотосинтезу динофлагелляты не образуют монофилетической группы. Последние филогенетические исследования показали, что у некоторых таксонов динофлагеллят, особенно тех, чьи хлоропласты не содержат перидинина, история взаимоотношения с эндосимбионтами довольно сложна: приобретение красной водоросли, затем её утрата и новое приобретение какой-нибудь другой водоросли, что указывает на возможность неоднократного эндосимбиоза. Кроме того, динофлагелляты сохраняют способность к приобретению эндосимбионтов и по сей день. Подтверждением этому может служить динофлагеллята Noctiluca scintillans ( ночесветка ), которая сама по себе гетеротрофна, однако внутри вакуолей особей этого вида иногда обнаруживаются свободноплавающие празинофициевые водоросли .
Остаётся неясным, о чём может свидетельствовать отсутствие пластид у видов, находящихся у основания древа динофлагеллят: о том, что динофлагелляты унаследовали древнее лишённое пластид состояние, или же предковые формы динофлагеллят утратили пластиды и впоследствии приобрели их заново. Если последнее предположение верно, то перидининсодержащие пластиды появились в результате третичного, а не вторичного, эндосимбиоза .
Не меньший интерес представляет эволюция перидининсодержащих хлоропластов. Филогенетический анализ 23S рРНК и гена psbA показал, что хлоропласты этого типа монофилетичны и, по всей вероятности, произошли от красных водорослей в результате вторичного эндосимбиоза, как это имело место у охрофитов и апикомплексов. Впрочем, анализ генов psaA , psbA и rbcL у различных красных, охрофитовых , гаптофитовых водорослей и динофлагеллят продемонстрировал, что динофлагелляты с перидинином и динофлагелляты с фукоксантином формируют монофилетическую группу, сестринскую гаптофитам. На основании этих результатов была выдвинута альтернативная гипотеза о происхождении перидининсодержащих пластид, согласно которой и перидининсодержащие, и фукоксантинсодержащие пластиды произошли от общего предка, которым была гаптофитовая водоросль, так что перидининсодержащие хлоропласты динофлагеллят представляют собой результат третичного эндосимбиоза .
Фототаксис
Все изученные динофлагелляты демонстрируют фототаксис в ответ на одну и ту же часть спектра , причём для волны длиной 450 нм степень проявления фототаксиса максимальна. Стигма (глазок) для фототаксиса необязательна, и лишённые стигмы клетки тоже могут реагировать на свет . Рецепторы, реагирующие на свет, определённо находятся не в стигме и, вероятно, связаны с плазматической мембраной .
Стигма есть у менее чем 5 % динофлагеллят, из которых большинство — пресноводные формы. Стигма простейшего строения, представленная группой липидных глобул , локализованных в цитоплазме и не окружённых какой-либо мембраной, имеется, например, у Woloszynskia coronata . Стигма второго типа представлена рядом липидных глобул, локализованных в хлоропластах, расположенных на периферии клетки (например, Peridinium westii , W. tenuissima ). Третий тип стигм характерен для Glenodinium foliaceum . У этой динофлагелляты стигма достигает 6 мкм в длину и 3 мкм в ширину. Она имеет более или менее прямоугольные очертания, уплощена и по внешнему виду напоминает мешок. Внутри неё находятся два ряда липидных глобул, разделённых зернистым пространством. Стигму окружает тройная мембрана, идентичная той, которая окружает хлоропласты. По соседству со стигмой находится не связанное с мембранами ламеллярное тельце, состоящее из уплощённых везикул, расположенных более или менее параллельно друг другу. Ламеллярное тельце достигает около 2 мкм в длину и 0,75 мкм в ширину и содержит до 50 везикул. Везикулы соединяются друг с другом в области концов, а на краю стопки — с шероховатым эндоплазматическим ретикулумом . Полагают, что стигма такого типа представляет собой сильно редуцированный перидининсодержащий хлоропласт .

Наиболее сложно устроенные стигмы, напоминающие по устройству глаз многоклеточных , характерны для членов семейства Warnowiaceae порядка . Такого рода стигмы получили название оцеллоидов . Оцеллоиды имеют структуры, аналогичные роговице , хрусталику и сетчатке глаз животных . При этом «роговица» представляет собой множество связанных в единую систему митохондрий, «хрусталик» ( линза ) состоит из мембран эндоплазматического ретикулума, а «сетчатка» (ретиноид) оказалась видоизменённым хлоропластом (виды семейства Warnowiaceae давно утратили способность к фотосинтезу) . Интересно, что в ходе недавних исследований в «сетчатке» была обнаружена экспрессия родопсина , похожего на бактериальный, что подтвердило участие этих стигм в определении направления света . Структура стигм Nematodinium armatum и Erythropsis cornuta была хорошо изучена, и их строение оказалось принципиально сходным. У N. armatum стигма располагается вверху нижней части клетки, рядом с пояском, и состоит из линзы и расположенного сзади неё пигментного бокала .

Ось, проходящая через центры линзы и пигментного бокала, практически перпендикулярна продольной оси клетки. Линза залегает сразу под плазмалеммой. Пигментный бокал состоит из трёх основных частей. Большая часть его стенки состоит из одного слоя крупных продолговатых пигментных гранул диаметром 0,3 мкм. При приближении к краю бокала пигментные гранулы становятся меньше и располагаются более свободно, формируя несколько слоёв. В основании бокала лежит плотный слой фибрилл диаметром 33 нм, параллельный оси стигмы. Этот слой покрывает слой поперечных фибрилл, получивший название ретиноид , поскольку он осуществляет восприятие света. Выше ретиноида располагается канал, который открывается в бороздку поперечного жгутика. Клеточная мембрана продолжается в мембрану канала .
Линза представляет собой сложную структуру, состоящую из сети митохондрий. Внутри митохондрий находится зернистый слой, отделённый от линзы мембраной. Центральная часть линзы представлена мембраносвязанным куполом или концентрическими слоями плотного материала. Большая часть линзы окружает этот кор и состоит из нескольких крупных, практически пустых лопастей. Между кором и лопастями находится сеть везикул среднего размера . Свет попадает на линзу, фиксируется и направляется концентрированным пучком на пигментные глобулы, проходя через ретиноид . Недавние исследования показали, что под действием света мембранные пузырьки стигмы становились более вытянутыми и плоскими . Линза способна менять форму, а пигментного бокал, в свою очередь, способен смещаться относительно линзы .
Питание

По типу питания динофлагелляты могут быть автотрофами, миксотрофами и гетеротрофами. По-видимому, автотрофии в строгом смысле среди динофлагеллят практически не бывает, зато чрезвычайно широко распространена миксотрофия. Известно только менее 10 чисто автотрофных видов, не нуждающихся в готовых органических соединениях. Большая часть динофлагеллят, способных к фотосинтезу, ауксотрофна по витаминам группы В (B 1 ( тиамин ), В 12 ( цианокобаламин ) и Н ( биотин )) и вынуждена получать их извне в готовом виде. Кроме того, известны фотосинтезирующие динофлагелляты, способные к фаготрофии .
Около половины известных видов динофлагеллят — облигатные гетеротрофы, лишённые пластид и поглощающие пищу осмотрофным или фаготрофным путём. Фаготрофия имеет более широкое распространение у динофлагеллят. Фаготрофные организмы поглощают твёрдые пищевые частицы и переваривают их в пищеварительных вакуолях. Они питаются другими водорослями , в том числе и другими динофлагеллятами, нематодами , личинками полихет , икрой рыб . Для захвата пищевых частиц они используют разнообразные специальные органеллы, среди которых стебельки (педункли), щупальца (тентакли), поршни (пистоны) и вуали (паллиум).
- Стебельки — небольшие подвижные пальцевидные выросты, которые располагаются в борозде у основания жгутиков. Вероятно, они выполняют сенсорные функции и обеспечивают прикрепление к субстрату.
- Щупальца — более удлинённые образования, служащие для захвата пищи и направления её к клеточному рту ( цитостому ). Щупальца описаны у Nocticula , Pronocticula , Pavillardia и др.
- Поршень представляет собой полый цилиндрический вырост, подтягивающий пищу к цитостому. Он может быстро удлиняться, причём его длина может в 15 раз превышать длину тела, расширяться, а потом быстро сужаться и сокращаться. Поршень проделывает отверстие в клетке-жертвы и высасывает из неё цитоплазму. Такой поршень характерен для Gymnodinium fungiforme , зооспор Pfiesteria piscicida , а также фотосинтезирующей динофлагелляты Amphidinium cryophilum .
- Вуаль — псевдоподиальная мембрана, выходящая из борозды вблизи основания жгутика и имеет вид ловчей сети, по размеру превышающей клетку. К этой сети прилипают отдельные крупные клетки и колониальные и диатомеи, далее они обволакиваются и их содержимое всасывается. Такой акт внеклеточного пищеварения длится 20—30 минут. Вуаль описана у некоторых видов родов Protoperidinium , Oblea и Diplopsalis . Первые питаются в основном диатомеями и динофлагеллятами, а все остальные могут ловить не только диатомей, но и гаптофитовых, празинофициевых и криптофитовых водорослей .
В клетках динофлагеллят может присутствовать большая везикула, содержащая останки переваренных органелл (тельце накопления). Вероятно, она соответствует везикулам с теми же функциями, имеющимся у криптофитовых водорослей и других жгутиконосцев . Тельце накопления особенно характерно для симбиотических динофлагеллят .
Осморегуляция

Сократительные вакуоли обнаружены лишь у нескольких пресноводных динофлагеллят. Одна или две сократительные вакуоли встречаются у членов семейства Protaspidaceae, а также на некоторых стадиях жизненного цикла у представителей порядка Phytodiniales, у них сократительные вакуоли исчезают при переходе на другую стадию жизненного цикла .
У остальных динофлагеллят пульсирующих сократительных вакуолей нет, и вместо них осморегуляторные функции выполняют пузулы — уникальные органеллы, присущие лишь динофлагеллятам. Они представляют собой впячивания цитоплазматической мембраны в виде мешка или трубки, вдающиеся в полость клетки. У морских представителей от этого мешка отходит система каналов и пальцеобразные впячивания — везикулы. Такие сложные пузулы видны в световой микроскоп. У пресноводных форм пузулы обнаруживаются лишь с помощью электронного микроскопа . Они имеют более простое строение и представляют собой одну крупную или несколько мелких вакуолей. Пузулы не способны к сокращениям, в отличие от сократительных вакуолей, однако открываются порами в жгутиковые каналы, откуда их содержимое изливается наружу без определённой периодичности. Обычно в клетке имеется две пузулы, каждая из которых связана с одним жгутиковым каналом .
Стрекательные структуры

Динофлагелляты имеют стрекательные структуры (экструсомы) трёх типов: трихоцисты , нематоцисты и мукоцисты. Трихоцисты располагаются перпендикулярно поверхности клетки по её периферии. Трихоциста состоит из тела и шейки и окружена одной мембраной . Внутри трихоцист находятся кристаллические белковые фибриллы длиной несколько микрометров (кор), которые закручены по спирали. Во внутренней части трихоцисты треть кора представлена короткими трубчатыми элементами, чуть выдающимися вперёд. На самом верху трихоцисты группа из 20—22 фибрилл выдаётся из кора в сторону закрывающей мембраны, и более тонкие фибриллы далее соединяют их с апикальной частью мембраны трихоцисты.

В пределах закрывающей мембраны трихоцисты находится тонкое непрозрачное кольцо. Внешняя часть мембраны трихоцисты прикрепляется к плазматической мембране между текальными везикулами или к текальным везикулам, расположенным под округлыми, тонкими областями текальных пластинок, которые формируют специальные поры для трихоцист .
Трихоцисты формируются в аппарате Гольджи и, вероятно, покидают его в виде сферических везикул, которые потом приобретают веретеновидную форму и развиваются в трихоцисты. При возбуждении «заряженная» трихоциста превращается в «незаряженную» в течение нескольких миллисекунд — возможно, из-за быстрого притока воды. «Незаряженные» трихоцисты представляют собой прямые конусовидные палочки, во много раз длиннее «заряженных» трихоцист (до 200 мкм у Prorocentrum ). Трихоцисты имеются у большинства динофлагеллят, но есть и исключения ( Gymnodinium neglectum , Aureodinium pigmentosum , Woloszynskia tylota , Symbiodinium microadriaticum ). Конкретная польза (если она есть) от трихоцист неясна. Они могут служить для быстрого отскакивания клетки в направлении, противоположном выбрасыванию нити, или для непосредственного поражения врага .
Нематоцисты обнаружены у немногих динофлагеллят (у родов Nematodinium , Warnowia , Proterythropsis и некоторых представителей рода Polykrikos , причём у последних нематоцисты заметно отличаются по своей морфологии ). Они крупнее трихоцист, достигают 20 мкм в длину; иногда их сравнивают с книдоцитами стрекающих . Мукоцисты — простые мешки, выделяющие слизь на поверхность клетки; они близки к аналогичным структурам эвгленовых . Такие мешки найдены у некоторых динофлагеллят в области брюшного поля (пластинок продольной борозды) под клеточной мембраной .
Покоящиеся формы

В условиях, которые не позволяют популяции увеличиваться дальше (например, при низком содержании питательных веществ ), динофлагелляты могут образовывать неподвижные покоящиеся споры, или цисты . Цисты динофлагеллят ( ) у большинства видов морфологически отличаются от вегетативных клеток. Они достигают 30—70 мкм в диаметре, имеют гладкую или шероховатую поверхность. Новообразованные цисты вида Scrippsiella trochoidea содержат в 10 раз больше углеводов , чем вегетативные клетки; при этом скорость окислительных процессов у них составляет 1,5 % от вегетативной стадии. Клеточные стенки цист отличаются высокой стойкостью и содержат , который химически близок к спорополленину, покрывающему пыльцу высших растений .
Процесс инцистирования, или образования покоящихся спор, регулируется сложным взаимодействием внешних факторов, в числе которых длина дня, температура и концентрация питательных веществ. В ходе инцистирования содержание мелатонина повышается в несколько раз, что может предотвращать окисление липидов цисты. У пресноводной динофлагелляты Woloszynskia tylota инцистирование включает в себя следующие этапы:
- Тека замещается тонкой аморфной наружной стенкой, которая значительно утолщается путём добавления нового материала с её внутренней стороны.
- На границе цитоплазмы формирующейся цисты формируется слой близко расположенных липидных капель.
- Цитоплазматические структуры, такие как хлоропласты, аппарат Гольджи и пузулы, уменьшаются в размерах или исчезают.
- Увеличение оранжево-коричневого тельца, располагающегося в центре клетки, и цитоплазматических вакуолей, содержащих кристаллы .
После своего образования циста перемещается на дно озера или океана, где сохраняет жизнеспособность многие годы. Океанические течения могут переносить эти бентосные цисты в другие места. Когда условия становятся благоприятными, цисты могут прорастать, давая начало живым плавающим клеткам. Образование цист, их перемещение и прорастание объясняют многие аспекты экологии и географии ядовитого цветения воды, вызванного динофлагеллятами. Этим объясняется тот факт, что цветения воды не обязательно происходят каждый год в одном и том же месте, а также то обстоятельство, что цветение воды связано с переизбытком питательных веществ в океане, вызванным, например, попаданием в него сточных вод или стоков с агрикультурных предприятий. Кроме того, из-за цист места цветения воды могут сменять друг друга каждый год .
Цисты можно опознать по отсутствию хлоропластов, наличию микрогранулярной коричневой цитоплазмы и красного глазка (если вегетативная стадия имеет глазок). У некоторых видов обызвествление осуществляется путём откладывания кристаллов карбоната кальция в узком промежутке между клеточной стенкой и плазматической мембраной. Цисты Ceratium hirundinella имеют наружный кремниевый слой .
Жизненный цикл и размножение

Динофлагелляты могут размножаться вегетативным , бесполым и половым путём. При вегетативном размножении клетка делится надвое в продольном или наклонном направлении, при этом оболочка исходной клетки по-разному участвует в создании оболочек дочерних клеток. Так, у беспанцирных динофлагеллят делятся пополам перетяжкой, и каждая дочерняя клетка наследует оболочку от материнской. У Ceratium деление происходит таким образом, что панцирь раскалывается косой бороздой на две неравные части, и каждая дочерняя клетка получает от материнской лишь половину панциря, а недостающую половину достраивает сама. У Peridinium материнская клетка сбрасывает теку (этот процесс называется экдизис ), после деления вокруг дочерних клеток образуется утолщённая пелликула, и клетка превращается в экдизальную цисту . Когда клетка выходит из состояния цисты, под её пелликулой формируются новые текальные везикулы. У экдизис индуцируется особым соединением глицерина , которое вырабатывает зелёная водоросль . Этот вид динофлагеллят обитает в непосредственной близости от таллома зелёной водоросли . В некоторых случаях дочерние клетки не расходятся в результате деления, и тогда формируются колонии-цепочки. В зависимости от видовой принадлежности и условий среды вегетативное размножение может происходить каждые 1—15 дней .
При бесполом размножении динофлагелляты образуют зооспоры и апланоспоры .
При недостатке азота и изменении температуры воды некоторые виды динофлагеллят приступают к половому размножению . У динофлагеллят описаны три типа полового процесса: изогамия , анизогамия и хологамия . Гаметы мельче вегетативных клеток, у панцирных видов могут быть голыми. Чаще всего при слиянии гамет образуется диплоидная планозигота, которая может существовать довольно долго. Обычно она крупнее гаплоидных вегетативных клеток, сохраняет 2 задних жгутика и отличается толстой, химически инертной, покрытой неровностями клеточной стенкой . Сначала следует период длительного роста планозиготы, а потом она может либо превратиться в покоящуюся клетку (гипнозиготу), период покоя которой длится от нескольких часов до нескольких месяцев, либо претерпевает мейоз и в подвижном состоянии даёт начало 4 гаплоидным вегетативным клеткам. У видов, чьи хлоропласты произошли от диатомовых и гаптофитовых водорослей, после слияния ядер гамет следует слияние эндосимбионтов и их ядер .

У подавляющего большинства динофлагеллят с изученными жизненными циклами они гаплобионтные : диплоидная стадия ограничивается зиготой . Исключение составляет Noctiluca , чей жизненный цикл диплобионтный. Ядро диплоидной вегетативной клетки делится мейозом, а затем митозом, давая начало более чем 2000 одинаковых гамет. При слиянии гамет образуется зигота, которая после периода покоя превращается в вегетативную клетку . Как и в случае некоторых красных водорослей , при выращивании некоторых динофлагеллят в лабораторной культуре оказалось, что морфологически различные протисты могут быть различными жизненными стадиями одного и того же вида .
Мейоз динофлагеллят изучен очень слабо. Его отличительными особенностями можно считать слабую спирализацию и укорочение хромосом, которые достигают максимума в период зиготены (этапа профазы I деления мейоза) .
Крайне необычный и сложный жизненный цикл характерен для динофлагелляты Pfiesteria piscicida . В отсутствие рыб вблизи дна Pfeisteria представлена бентосными цистами . Присутствие рыб вызывает прорастание цист в плавающую форму, которая выделяет токсическое вещество. Это вещество вызывает паралич дыхательной системы рыбы, и рыба в течение нескольких минут погибает от удушья и опускается на дно. Когда мёртвая рыба начинает разлагаться, динофлагелляты приступают к поеданию рыбы посредством стебельков. Когда рыба будет полностью съедена, жгутиконосные клетки снова превращаются в покоящиеся незаметные бентосные цисты, причём иногда на превращение уходит всего лишь два часа .
Биохимия
Особенности метаболизма

Пресноводные динофлагелляты запасают в основном крахмал , который откладывают в цитоплазме, а морские формы запасают преимущественно липиды . Кроме того, динофлагелляты могут запасать стеролы , преимущественно 4α-метилстеролы, чем они отличаются от всех остальных групп водорослей . Некоторые морские динофлагелляты и организмы, в которых в качестве эндосимбионтов обитают динофлагелляты, накапливают особый стерол .
Для жизнедеятельности большинства свободноживущих динофлагеллят, в отличие от их ближайших родственников — апикомплексов, ведущих паразитический образ жизни, необходим эффективный синтез АТР за счёт полного окисления углеводов . На важность этого пути указывает наличие гранул крахмала в цитоплазме многих динофлагеллят. Однако пируватдегидрогеназный комплекс , обеспечивающий превращение пирувата в ацетил-СоА у большинства других эукариот, у динофлагеллят отсутствует (как и у апикомплексов). Хотя в поддержании митохондриального пула ацетил-СоА могут участвовать и альтернативные, негликолитические пути (в частности, распад разветвлённых аминокислот , например, через 2-метилцитратный цикл), кажется маловероятным, чтобы конечным продуктом окисления углеводов у динофлагеллят оставался пируват. Вероятно, у динофлагеллят существуют другие пути и ферменты для дальнейшего окисления пирувата. Это предположение подтверждается результатами исследований с использованием радиоактивно меченного 13 C 3 -пирувата: в цикл трикарбоновых кислот вступал тоже меченный 13 C 2 -ацетил-СоА, по-видимому, полученный из 13 C 3 -пирувата. У динофлагеллят имеются гены, кодирующие все ферменты β-окисления жирных кислот , в том числе и карнитин-ацилкарнитин транслоказу . Этот метаболический путь является дополнительным источником ацетил-СоА в митохондриях, и его важность в метаболизме динофлагеллят подтверждается наличием запасов липидов у многих видов .

Геном динофлагеллят содержит все гены, кодирующие ферменты цикла трикарбоновых кислот (ЦТК). ЦТК играет ключевую роль в метаболизме динофлагеллят, как и всех свободноживущих аэробных организмов. Большинство эукариот имеют две формы (фермента ЦТК, катализирующего окисление изоцитрата до α-кетоглутарата ): NAD (H)-зависимую и NADP (H)-зависимую. Динофлагелляты, однако, утратили NAD(H) зависимую форму изоцитратдегидрогеназы, как и апикомплексы, хотя этот белок чрезвычайно консервативен как среди эукариот, так и среди прокариот . Другим интересным отличием ЦТК динофлагеллят от ЦТК остальных эукариот является наличие у них двух форм : имеющей железосерный кластер и лишённой его. Обычно среди представителей одного таксона имеется лишь одна форма этого фермента. Хотя динофлагелляты имеют обычную митохондриальную NAD-зависимую малатдегидрогеназу , окисляющую малат в оксалоацетат , они также имеют малат-хиноноксидоредуктазу — мембраносвязанный фермент, который тоже может окислять малат в оксалоацетат, однако с восстановлением FAD , а не NAD + . Этот фермент имеется у некоторых бактерий и апикомплексов, утративших митохондриальную форму малатдегидрогеназы, и, по-видимому, был приобретён общим предком динофлагеллят и апикомплексов ещё до их разделения. Впрочем, несмотря на все эти отличия, общая схема реакций ЦТК как у динофлагеллят, так и у апикомплексов не отклоняется от стандартной схемы .
В электрон-транспортной цепи динофлагеллят также произошли некоторые изменения. И динофлагелляты, и апикомплексы утратили комплекс I (NADH-дегидрогеназу) дыхательной цепи, характерный для большинства эукариот. Вместо него у динофлагеллят функционирует особый белок, который имеет сигнал митохондриальной локализации и работает в матриксе митохондрий, где его субстратом вместо NADH служит NADPH, полученный в ходе ЦТК. Судя по всему, типичная NADH-дегидрогеназа была утрачена свободноживущим предком динофлагеллят и апикомплексов. Причины этого неясны, однако возможно, что утрата NAD(H)-зависимой изоцитратдегидрогеназы способствовала распространению альтернативной . Кроме неё, в митохондриях динофлагеллят имеются другие белки, обеспечивающие вхождение электронов в ЭТЦ. Так, у них функционирует — фермент , который окисляет дигидрооротат до оротата в , причём электроны получает кофермент Q . Ещё один путь обеспечивает малат-хиноноксидоредуктаза и ЦТК, которые вносят вклад в увеличение пула восстановленного кофермента Q. Интересно, что у динофлагеллят отсутствует имеющийся у апикомплексов и инфузорий , при работе которого FAD-зависимая восстанавливает кофермент Q. Впрочем, у динофлагеллят имеется цитохром b 2 ( L-лактат : цитохром c оксидоредуктаза ), который располагается в межмембранном пространстве и окисляет цитозольный L-лактат в пируват, передавая электроны на цитохром с. У динофлагеллят обнаружены также белки, разобщающие ЭТЦ , то есть белки, обеспечивающие утечку протонов из межмембранного пространства в матрикс без синтеза АТФ. Этот процесс активируется свободными жирными кислотами и, хотя и снижает скорость синтеза АТР, сводит к минимуму количество активных форм кислорода , образующихся при работе ЭТЦ .
У динофлагеллят имеются белки , обеспечивающие транспорт дикарбоновых и трикарбоновых кислот через внутреннюю митохондриальную мембрану . Эти метаболиты используются в синтезе аминокислот, , глюконеогенезе , биосинтезе изопреноидов и ЦТК. К числу таких белков динофлагеллят относится α-кетоглутарат-малатный транспортёр, который обменивает митохондриальный α-кетоглутарат на цитозольные дикарбоновые кислоты, в частности, малат. Этот транспортёр связан с , который позволяет эффективно переносить в форме NADH в митохондрии из цитозоля. Для работы этого челнока также необходим аспартат - глутаматный переносчик, который, хотя и имеется у динофлагеллят, отсутствует у апикомплексов. У динофлагеллят, но не апикомплексов и инфузорий, также имеется оксодикарбоксилатный переносчик, который осуществляет обмен оксодикарбокислатов оксоадипата и α-кетоглутарата друг на друга. Этот переносчик необходим для синтеза лизина и глутамата в цитоплазме из митохондриального 2-оксоадипата, который, в свою очередь, образуется из α-кетоглутарата и ацетил-СоА. Обмен может идти и в обратном направлении, когда оксоадипат, образовавщийся при катаболизме цитозольного лизина, транспортируется в матрикс. Здесь оксоадипат декарбоксилируется и далее используется как источник ацетил-СоА. В митохондриях динофлагеллят имеются и другие обменники дикарбоксилатов и трикарбоксилатов, которые отсутствуют у апикомплексов .
Как и все альвеоляты, динофлагелляты имеют все белки, необходимые для синтеза железо-серных кластеров в митохондриях. Синтез тетрапирролов у динофлагеллят, как и у многих фотосинтезирующих организмов, идёт в пластидах, а не митохондриях .
Несколько отличается от обычного у динофлагеллят процесс фотодыхания : высшие растения , харовые , красные и используют для окисления гликолата фермент гликолатоксидазу, которая при участии молекулярного кислорода окисляет гликолат до глиоксилата с образованием перекиси водорода, разрушаемой каталазой . У динофлагеллят, а также некоторых других групп водорослей, этот фермент отсутствует, а окисление гликолата осуществляется другим энзимом — гликолатдегидрогеназой .
Биолюминесценция

Планктонные формы динофлагеллят, обитающие во всех океанах мира, обладают способностью к люминесценции (часто её ошибочно называют фосфоресценцией ), которую часто можно видеть летом ночью в потревоженной океанской воде. Люминесцирующие динофлагелляты населяют в основном поверхностные воды . Среди фотосинтезирующих протистов динофлагелляты — единственная группа, способная к биолюминесценции ; всего зарегистрировано около 85 фотосинтезирующих и гетеротрофных видов морских динофлагеллят, обладающих такой способностью (пресноводные виды ею не обладают). Возбуждённые клетки испускают вспышки сине-зелёного цвета (с максимумом излучения на длине волны 475 нм) длительностью обычно от 0,05 до 5 с .
Люминесценция воды, возникающая при движении корабля, и свечение тропических заливов обусловлены в основном видами класса Dinophyceae ; в умеренных широтах свечение моря обычно вызывает ночесветка . Словно бы пылающая морская вода с древних времён привлекала внимание мореплавателей, и долгое время этому сиянию воды приписывали сверхъестественное происхождение, пока в 1830 году не была экспериментально доказана биологическая природа данного свечения . Немецкий естествоиспытатель дал такое описание картины свечения моря, которую наблюдал в Неаполитанском заливе : «То вблизи, то вдали вспыхивали светлые, синеватые искры, вспыхивали и тотчас же исчезали. Всё сильнее и больше становился блеск моря, каждая волна при падении рассыпалась огненным дождём… Казалось, что мы плывём по лучезарному потоку; все вещи, опущенные в воду, казались залитыми жидким серебром. Когда мы поздно ночью стояли на молу, вся гавань и всё море, насколько хватал глаз, казались залитыми мягким огнём. Это было неописуемое зрелище, и лишь тот, который видел его во всей красе, может понять то неизгладимое впечатление, которое оно производит на каждого человека» .
Биолюминесценция предполагает трансформацию энергии , выделившейся в ходе экзергонической химической реакции , в световую энергию . Веществом, ответственным за биолюминесценцию, является люциферин , который окисляется кислородом под действием фермента люциферазы с высвобождением энергии в виде вспышки света. Люциферин и люцифераза — это общие названия соединений, связанных с люминесценцией, и они не характеризуются общей для всех люминесцирующих организмов химической структурой. Так, у бактерий люциферин — это восстановленный флавин , а у динофлагеллят — тетрапиррол. Люциферазы также имеют различную структуру у разных групп организмов, хотя все они являются оксидоредуктазами. Согласно общему уравнению биолюминесценции, под действием люциферазы люциферин окисляется кислородом с образованием возбуждённого продукта, который при переходе в невозбуждённое состояние испускает фотон .

Люциферин динофлагеллят представляет собой линейный тетрапиррол. При щелочных рН он связан с люциферин-связывающим белком ( англ. luciferin binding protein, LBP ), который высвобождает люциферин в кислых условиях. Была высказана гипотеза, что вспышка света происходит просто при понижении рН с 8,0 до 6,5. В возбуждённых клетках вакуолярная мембрана деполяризуется , из-за чего протоны (Н + ) выходят в цитоплазму и закисляют её периферические участки. Снижение рН запускает две рН-зависимые реакции: (1) LBP высвобождает люциферин и (2) люциферин активируется и испускает фотон сине-зелёного света .
Люциферин, LBP и люцифераза собраны в особые частицы диаметром 0,5—1,5 мкм — сцинтиллоны (вспыхивающие единицы). Вспышки света происходят в цитоплазматических впячиваниях вакуолярной мембраны. Вспышки сине-зелёного света происходят при прохождении потенциала действия через мембрану вакуоли, в результате чего протоны покидают закисленную среду вакуоли и выходят в цитоплазму. Возникающее падение рН в сцинтиллонах вызывает вспышку света .

люминесцирует в основном в ходе ночной фазы циркадного ритма . Это обусловлено более чем десятикратным увеличением количества люциферазы и LBP в ходе ночной фазы. Фотоингибирование биолюминесценции в течение дня, видимо, необходимо для сбережения энергии клеткой в тот момент, когда уровень света вокруг столь высок, что биолюминесценция неэффективна. У биолюминесценция может происходить в течение всех суток. В дневное время свечение испускают сферические тельца в плотно упакованных везикулах, собранных вокруг ядра, а ночью биолюминесцируют периферические слои цитоплазмы. Интересно, что хлоропласты при этом перемещаются в обратном направлении и ночью сгруппированы вокруг ядра, а днём располагаются на периферии клетки .
Динофлагелляты могут испускать свет тремя путями:
- при механической, химической, электрической стимуляции;
- спонтанно;
- тускло светиться поздней ночью .
Максимальное количество света , испускаемое при одной вспышке, значительно отличается у разных видов, причём крупные представители выпускают за одну вспышку больше света, чем мелкие. В популяции динофлагеллят за сутки в среднем одна клетка испускает одну вспышку. Неясно, действительно ли за этот период клетка светится один и только один раз, или же, напротив, некоторые клетки светятся многократно, а другие не светятся вовсе. На яркость свечения оказывает влияние снабжённость клетки питательными веществами. Ночесветки, имеющие зелёных водорослей-эндосимбионтов, выпускают тем больше фотонов, чем интенсивнее освещаются клетки и, соответственно, активнее идёт фотосинтез. Различные особи, относящиеся к одному и тому же виду родов Dissodinium и Pyrocystis , могут быть как способными к свечению, так и не способными .
Наиболее сильное свечение характерно для Pyrocystis , который обусловливает свечение морей в экваториальных районах. Клетка Pyrocystis испускает в 1000 раз больше света, чем особи рода Lingulodinium , и в 100 раз больше, чем клетка Ceratium fusus , Peridinium pentagonium и .
Существует две теории относительно адаптивного значение биолюминесценции у динофлагеллят.
- Гипотеза «сигнала тревоги». Согласно этой гипотезе, при появлении беспозвоночного , питающегося динофлагеллятами, динофлагелляты испускают свечение и указывают на нахождение этого животного. Этот сигнал воспринимается хищником, питающимся вышеназванным поедающим динофлагеллят беспозвоночным.
- Гипотеза «испуга». Согласно этой гипотезе, вспышка света, которую испускает динофлагеллята при механическом раздражении, вызываемым поедателем (например, веслоногим рачком ), пугает рачка и заставляет его уплыть прочь .
Биологические ритмы

У многих представителей Dinophyceae наблюдаются ритмические процессы, и наиболее известной водорослью, демонстрирующей ритмические изменения, является динофлагеллята . Этот вид способен к биолюминесценции и имеет собственные люциферин и люциферазу. Эти водоросли испускают вспышку света при резком встряхивании морской воды, в которой они плавают, или при её сильном волнении. При лабораторном измерении люминесценции встряхиваемой культуры оказывается, что количество света, которое испускают клетки в единицу времени, не одинаково и зависит от недавних событий. Если культура выращивалась при естественном освещении или в условиях с соблюдением режима день-ночь, то количество испускаемого света в значительной степени зависит от времени дня, в которое проводилось измерение. В дневное время количество испускаемого света очень низко, и, чтобы вообще вызвать какую-либо люминесценцию, культуру приходилось очень сильно встряхивать. Однако при стимуляции клеток в ночное время культура испускает гораздо больше света, и для возникновения вспышки достаточно лишь слабого воздействия. Если построить график зависимости люминесценции от времени дня, то график будет иметь такой вид, как на рис. Наибольшая люминесценция наблюдается в середине периода темноты, однако по мере приближения к утру вспышки становятся всё меньше и меньше, и для их получения требуется всё большая стимуляция клеток. Таким образом, интенсивность люминесценции подчиняется циркадным ритмам, поскольку при длительном нахождении клеток в темноте ритмичность изменения яркости вспышек всё равно сохранялась. В темноте цикл поддерживается в течение 4 дней, однако амплитуда изменения яркости вспышек значительно уменьшается. При продолжительном нахождении клеток на свету уменьшения амплитуды не наблюдается. В условиях непрерывного освещения правильной интенсивности цикл сохраняется как минимум 3 недели .
Измерения фотосинтеза у Lingulodinium polyedrum как по выделению кислорода , так и по фиксации углекислого газа показали, что эти процессы также являются ритмическими, точнее, подчиняются циркадным ритмам и не пропадают в условиях продолжительного освещения. Наибольшая интенсивность фотосинтеза, как и следовало ожидать, наблюдается в середине дня. Ритмичность фотосинтеза обеспечивается изменениями в фотосистеме II .
Третьим процессом у Lingulodinium polyedrum , согласующимся с циркадными ритмами, является деление клеток . В условиях смены дня и ночи деление клетки происходит каждые 30 минут. Когда соотношение день: ночь составляет 12:12, 30-минутные интервалы выражены особенно ясно. Исследования, проведённые в других условиях день: ночь, например, 7:7, показали, что для клеточного деления переход день—ночь не является решающим, поскольку клеточное деление происходит через 12 часов после начала периода темноты, даже если задолго до этого наступил новый световой период. В условиях продолжительного освещения светом низкой интенсивности все остальные циркадные ритмы Lingulodinium polyedrum сохраняются, однако клетки практически не делятся и суммарное время существования клетки увеличивается до почти 6 дней. Впрочем, те клетки, которые готовы делиться, делятся каждые 24 часа в одно и то же время .
Четвёртый тип циркадных ритмов у динофлагеллят — вертикальные миграции клеток в водяной колонке. Перед рассветом клетки поднимаются к поверхности, где они формируют крупные скопления (агрегации), однако к ночи они снова уплывают на глубину. В морских водах при вертикальных миграциях клетки находятся под действием следующих градиентов :
- Концентрация питательных веществ больше на глубине, так как они накапливаются вблизи дна или термоклина , в то время как в поверхностных водах питательных веществ почти нет.
- Температура вблизи поверхности больше температуры на глубине.
- Изменяется интенсивность света.
- В стоячих водах различия между поверхностными и глубинными слоями воды почти сводятся на нет приливными волнами .

У Lingulodinium polyedrum существует определённый контроль над люминесценцией, фотосинтезом и клеточным делением, так что каждый процесс достигает максимума и закономерно спадает строго упорядоченным образом каждые 24 часа. Все эти процессы могут находиться во власти единого механизма — биологических часов. Вполне может быть, что элементом клетки, управляющим биологическими часами, является плазматическая мембрана, поскольку в синхронизированных клетках наблюдается ритмическая реорганизация плазматической мембраны каждые 24 часа .

Хотя ритмические процессы у Lingulodinium polyedrum достигают пиков в различные фазы, предполагается, что они регулируются единым водителем ритма. По-видимому, ритмические процессы не имеют обратной связи и поэтому управляются вышестоящим механизмом. Так, фотосинтез можно эффективно подавить воздействием особого гербицида, однако ритм биолюминесценции сохраняется, и его фаза также не изменяется. Эти наблюдения говорят в пользу следующей модели относительно циркадных ритмов Lingulodinium polyedrum . Центральный водитель ритма регулируется солнечным светом и синхронизируется с ним посредством фоторецепторов, поддерживая 24-часовую периодичность циркадных ритмов. Он, соответственно, регулирует все остальные ритмические процессы: клеточное деление, биолюминесценцию, фотосинтез .
У динофлагеллят циркадными ритмами управляют две различные системы: чувствительная к красному свету система, которая увеличивает временные интервалы, и система, которая чувствительна к синему свету и синхронизирует ритмы с рассветом. Вероятно, эти системы стимулируют или подавляют образование мелатонина в клетках. Увеличение концентрации мелатонина, по-видимому, означает конец световой фазы. В образовании мелатонина прослеживается циркадный ритм: в конце световой фазы концентрация мелатонина быстро увеличивается, а во время темновой фазы постепенно спадает и к началу световой фазы достигает минимальных значений. Концентрация мелатонина в клетках динофлагеллят схожа с таковой в эпифизе млекопитающих . Таким образом, мелатонин лежит в основе фотопериодических явлений у столь далёких групп организмов, как динофлагелляты и млекопитающие. Этот факт подтверждает наличие древнего механизма, связывающего информацию об освещении с циркадными ритмами .
Распространение и экология
Среди свободноживущих динофлагеллят встречаются как морские (около 90 % всех динофлагеллят обитают в морских водах, где входят в состав как планктона , так и бентоса ), так и пресноводные формы . Наряду с диатомовыми водорослями они составляют основную часть морского фитопланктона , причём в тропических водах доминируют динофлагелляты, а в полярных и приполярных — диатомеи. Динофлагелляты занимают второе место после диатомей как продуценты первичной продукции в прибрежных морских водах. Наибольшее разнообразие и обилие динофлагеллят наблюдаются в неритической зоне океанов, где за счёт смывов с берегом содержится больше органики, однако они обитают и в пелагиали (открытая вода) в тропиках и субтропиках .
Среди бентосных динофлагеллят выделяются две основные экологические группы: псаммофильные виды, обитающие в морском песке, и эпифитные виды, живущие на морских водорослях и травах (к эпифитным динофлагеллятам, в частности, относятся известные своей токсичностью представители родов Prorocentrum и Gambierdiscus ) .
В пресноводном фитопланктоне динофлагелляты представлены значительно беднее (здесь наиболее часто встречаются виды Ceratium и Peridinium ) .
Судя по всему, большинство динофлагеллят — космополиты . Они встречаются в северных, умеренных и южных широтах, хотя наиболее обильны в тёплых водах, где их численность высока в течение всего года. В умеренных областях наибольшая численность динофлагеллят достигается только поздней весной и летом. Как в морских, так и в пресных водах перед массовым развитием динофлагеллят происходит массовое развитие диатомей. Существуют криофильные динофлагелляты, которые обитают в снегу и придают ему красную окраску. Среди динофлагеллят эпифиты и типичные бентосные формы гораздо более редки, чем планктонные .
Динофлагелляты способны за короткий срок давать большую биомассу , а потому служат важным звеном в цепи питания рыб , китообразных , коловраток , различных простейших и других гидробионтов — как непосредственно, так и после предварительного поедания представителями зоопланктона .

Нередко динофлагелляты выступают как симбионты ( ) других организмов — морских беспозвоночных ( губок , рифообразующих кораллов , медуз , плоских червей , моллюсков ) и протистов ( радиолярий , фораминифер , инфузорий ). В каждом из случаев симбиоза хозяину достаточно, проглотив динофлагелляту, инкорпорировать её, не переваривая в свои ткани ; после этого симбионт неоднократно делится и начинает синтезировать углеводы , которыми снабжает организм хозяина. Степень зависимости хозяина от такого симбиоза варьирует весьма значительно: так, актиния вполне может прожить без зооксантелл, а некоторые кораллы без симбионтов-динофлагеллят обойтись не могут . Известно по крайней мере 5 видов динофлагеллят (4 из которых относятся к роду Symbiodinium ), которые могут выступать в роли зооксантелл. Зооксантеллы покрыты тонкой оболочкой, способны к вегетативному размножению и образованию гимнодиниумподобных спор. Лучше всего изучена ассоциация зооксантелл и рифообразующих кораллов. Она представляет собой случай мутуализма , и оба организма извлекают из него выгоду. Зооксантеллы отдают своему хозяине до 50 % фиксированного углерода , большая часть которого поступает в виде глицерина , меньшая — в виде глюкозы , аланина , органических кислот . Показано, что кораллы с зооксантеллами быстрее обызвествляются. Коралл же снабжает водоросль некоторыми органическими соединениями ( мочевина , , аминокислоты ) и факторами роста .


Часто динофлагелляты сами являются хозяевами для многих симбиотических водорослей, как эндо-, так и . Так, цианобактерии и живут на поверхности клеток бесцветных динофит Citharister , , и Parahistioneis . Эндосимбионтами динофлагеллят могут выступать криптофитовые, зелёные и золотистые водоросли , а также бактерии. Так, в водах Новой Гвинеи встречаются зелёные Noctiluca , которые, однако, лишены хлоропластов, но содержат от 6 до 12 тысяч маленьких клеток зелёной водоросли .
Около 20 видов динофлагеллят являются паразитами беспозвоночных (в частности, мелких ракообразных ), рыб и нитчатых водорослей . Широко распространённая динофлагеллята Dissodinium pseudolunula — эктопаразит яиц копепод , имеет хлоропласты. Эктопаразиты, лишённые хлоропластов, паразитируют на рыбах, яйцах копепод, диатомеях и других водорослях (представители родов Chytriodinium , Paulsenella и др.). Два рода эндопаразитических динофлагеллят, обитающих в яйцах копепод — Blastodinium и Schizodinium — имеют хлоропласты. Эндопаразиты, не имеющие хлоропластов, обитают в других динофлагеллятах, сифонофорах и копеподах . Грань между симбионтами и паразитами иногда бывает размыта; так, виды рода Symbiodinium обычно выступают как симбионты кораллов и других беспозвоночных, но некоторые их виды ведут себя скорее как паразиты и способны вызывать массовую гибель кораллов .

Ряд видов динофлагеллят, размножаясь в значительных количествах, способны вызывать цветение воды . В частности, вспышка численности морских динофлагеллят в прибрежных водах, происходящая обычно в тёплое время года, приводит к явлению, получившему название « красный прилив » (в морях России красные приливы наблюдаются на Дальнем Востоке ). Во время красного прилива морская вода из-за наличия в ней микроскопических водорослей, содержащих фотосинтетические пигменты, приобретает необычный цвет — обычно красный, но иногда вишнёвый, коричневый или жёлтый . Появлению красных приливов способствуют свойства воды: тёплые поверхностные слои, высокое содержание питательных веществ , низкая солёность (что часто бывает после длительного периода дождей) и отсутствие сильного волнения. Если виды, вызывающие красный прилив, являются токсинообразующими, то результатом может быть массовая гибель рыб, моллюсков и ракообразных, питающихся планктоном (см. ; многие токсинообразующие динофлагелляты не изменяют окраску воды ) . Так, в конце августа 1987 года на западном побережье Флориды наблюдался самый сильный красный прилив за последние 150 лет, и пляжи были завалены сотнями тысяч мёртвых рыб. За это оказалась ответственной динофлагеллята Gymnodinium breve .

В пресноводных водоёмах цветение воды обычно вызывают водоросли, не относящиеся к динофлагеллятам; однако в некоторых местностях последние (особенно представители родов Peridinium , Ceratium и Peridiniopsis ) играют ведущую роль . Так, Ceratium hirundinella при массовом размножении придаёт воде буровато-белесую окраску (что можно наблюдать летом в заводях и пойменных озёрах рек Украины ) . Другой известный пример: наблюдавшееся до 1964 года в отдельные солнечные дни (в период с июля по сентябрь) окрашивание в интенсивный кроваво-красный цвет вод горного озера , лежащего на северо-западе провинции Тренто , Италия . Длительное время полагали, что за такое окрашивание ответственны виды рода Glenodinium , однако позднее было установлено, что окрашивание вызывали представители описанного в 2006 году вида Tovellia sanguinea (они встречаются в озере и ныне, но в небольшом количестве: преобладание перешло к другой динофлагелляте Baldinia anauniensis , имеющей зелёную окраску) .
С размножением пресноводных динофлагеллят обычно связывают и явление «Красного Нила» . Так называют вторую фазу летне-осеннего половодья в нижнем течении Нила , во время которого река выходит из берегов, оставляя затем на прилегающих полях очередной слой плодородного ила (во время первой фазы — «Зелёного Нила» — река благодаря присутствующим в ней микроскопическим водорослям принимает зелёный цвет, а во время второй — тёмно-красный). Конкретные виды динофлагеллят, ответственные за данное явление, пока не выявлены (некоторые авторы выдвигали предположения, по которым причиной красной окраски нильских вод могли быть цианобактерия Oscillatoria rubescens , эвгленоидея Euglena sanguinea или же зелёная водоросль Haematococcus pluvialis , но надёжного обоснования эти гипотезы не получили) .
Палеонтология
Ископаемые остатки динофлагеллят известны со среднего триаса ; в то же время остатки двух родов, Arpylorus и Palaeodinophysis , предположительно относящихся к динофлагеллятам, датируются соответственно поздним силуром и девоном . В раннем мезозое разнообразие динофлагеллят резко возросло, возникли их основные морфологические типы. В мелу динофлагелляты достигли наивысшего морфологического разнообразия, но с неогена происходит его уменьшение .
В ископаемом состоянии динофлагелляты представлены преимущественно , которые благодаря своей стойкости хорошо сохраняются в древних осадочных породах . Находки диноцист известны с перми , а для стратификации мезозоя и кайнозоя они имеют большое значение, поскольку по ним разработаны локальные стратиграфические шкалы . Представляют они ценность и для палеоэкологических исследований. Ископаемые цисты динофлагеллят называются гистрихосферидами (гистрихоспорами) и рассматриваются в составе акритархов — похожих на цисты структур ископаемых одноклеточных водорослей . При этом уже у раннекембрийских акритархов (520 млн лет назад) найдены диностеролы и 4α-метил-24-этилхолестен, специфичные для динофлагеллят; если предположения о связи акритархов и динофлагеллят верны, то эволюционную историю последних можно продлить до раннего кембрия и даже более раннего периода (800 млн лет назад) .
Гистрихосфериды были открыты независимо разными палеонтологами и классифицируются как отдельная таксономическая группа, представленная исключительно ископаемыми видами ; многие покоящиеся споры динофлагеллят идентичны кайнозойским гистрихосферидам, так что в этом случае одна структура имеет два названия. С перми известны и ископаемые остатки панцирей динофлагеллят, но они встречаются значительно реже .
Значение в природе и жизни человека
Значение динофлагеллят в биосфере весьма велико. В экосистеме коралловых рифов фототрофные динофлагелляты являются наиболее важными первичными продуцентами , а среди первичных морских продуцентов в целом они уступают только диатомеям . Гетеротрофные же морские динофлагелляты оказываются важными компонентами так называемой микробной петли , помогая направить значительные потоки энергии в планктонные пищевые сети .
Места с повышенной численностью динофлагеллят (места «цветения») являются одними из важнейших естественных хранилищ жиров (например, хранилище в Северном море ). Ископаемые породы, содержащие отмершие клетки динофлагеллят, также служат хранилищами накопленных в клетках жиров. Крупнейшее из таких хранилищ — ( англ. Kimmeridge Clay ) в Англии . В месторождениях нефти и древних осадочных пород также встречается 4α-метилстирольные углеводороды , которые, вероятно, произошли от 4α-метилстиролов динофлагеллят .
Паразитические динофлагелляты способны вызывать эпизоотии в популяциях рыб и ракообразных .
Многие динофлагелляты весьма чувствительны к присутствию в воде органических загрязнений, а поэтому используются как биоиндикаторы при санитарно-биологическом обследовании водных ресурсов . Ископаемые цисты динофлагеллят служат геологам для оценки возраста предполагаемых месторождений нефти .
Токсины
Некоторые виды динофлагеллят способные образовывать опасные токсины ; среди видов токсинообразующего фитопланктона на долю динофлагеллят приходится около 75—80 %, причём выделяемые динофлагеллятами токсины относятся к числу наиболее мощных из известных биотоксинов . Известно около 60 видов токсинообразующих динофлагеллят; более половины из них относятся к родам , и , в меньшей степени к Gambierdiscus , Ostreopsis и .
Некоторые токсины, вырабатываемые динофлагеллятами, летучи, и известны случаи, когда после вдыхания или попадания на кожу они вызывали отравление у учёных, изучавших динофлагеллят . Токсины динофлагеллят могут быть водо- и жирорастворимыми, оказывают цитолитическое, гепатотоксическое и нейротоксическое действие .
Нередко (особенно во время красных приливов) эти токсины накапливаются в тканях двустворчатых моллюсков , питающихся фитопланктоном, не причиняя им особого вреда, однако их уровень в тканях оказывается токсичным (зачастую летальным) для поедающих моллюсков позвоночных — для рыб или человека. У последнего они могут вызывать следующие заболевания :
| Заболевание | Токсин(ы) | Структурная формула | Возбудители | Механизм действия | Симптомы |
|---|---|---|---|---|---|
| ( англ. Paralytic shellfish poisoning , PSP) | Сакситоксины , , гониатоксины |
Сакситоксин

|
, Gymnodinium , , Pyrodinium и др. | Блокируют натриевые каналы в нервных и мышечных клетках . | Паралитическое отравление, смерть может наступить через 2—24 ч. |
| ( англ. Amnesic shellfish poisoning , ASP) | Домоевая кислота |
Домоевая кислота

|
Prorocentrum lima | Действует на каинатные рецепторы центральной нервной системы как глутаматный активатор, перевозбуждая нервную систему и вызывая в ней дегенеративные эффекты. | Амнезия (потеря кратковременной памяти ), токсические повреждения головного мозга ; при сильном отравлении — смерть. |
| ( англ. Diarrheal shellfish poisoning , DSP) | Динофизистоксины, , пектенотоксины, ессотоксины |
Окадаевая кислота
|
, Prorocentrum , Gonyalax grindleyi | Окадаевая кислота блокирует работу протеинфосфатаз в клетках кишечника . | Понос, рвота, боли в животе, диарея . Смертельные случаи неизвестны. |
| ( англ. Neurotoxic shellfish poisoning , NSP) | Бреветоксины |
Бреветоксин А

|
Karenis brevis | Действуют на потенциалзависимые натриевые каналы, вызывая постоянный ток ионов натрия в клетку и деполяризацию . | Провалы в памяти, паралич. Вдыхаемые вместе с брызгами токсины могут вызывать заболевания дыхательной системы . |
| Азаспирацидное отравление моллюсками (с, ASP) |

|
Виды рода Azadinium (ранее ошибочно считался Protoperidinium crassum, ошибка распространена в т.ч. в академических источниках) | Блокирует hERG калиевые каналы . Ингибируют синтез белков, вызывают апоптоз . [ источник не указан 514 дней ] | Симптомы — как при диаретическом отравлении моллюсками. | |
| Сигуатера ( англ. Ciguateric fish poisoning , CFP) | Сигуатоксины , майтотоксины |
Сигуатоксин

|
и др. | Сигуатоксины действуют на натриевые каналы | Отравление наступает при поедании рыб коралловых рифов. Неврологические и желудочно-кишечные симптомы. Смертельные исходы редки. |
| PEAS ( англ. Possible Estuary Associated Syndrome (плохо изученное заболевание) | Эстуарные динофлагелляты ( Pfiesteria piscicida и родственные виды) | Ухудшение памяти и обучаемости, повреждение кожи, респираторные эффекты. |
Некоторые динофлагелляты, выделяющие токсины, способные поражать рыб , млекопитающих и птиц , имеют большое хозяйственное значение, поскольку наносят вред хозяйствам, занимающимся разведением морских животных . К числу таких видов относится Pfiesteria piscicida , отличающаяся своим необычным жизненным циклом. Токсины, выделяемые этой динофлагеллятой, столь сильны, что рыбы, питающиеся ими (например, атлантическая сельдь , южная камбала ), погибают уже через несколько минут . За массовую гибель рыб во время красных приливов у атлантического побережья США несёт ответственность именно этот вид динофлагеллят .
В пищевой промышленности
Динофлагеллята Crypthecodinium cohnii используется для получения в промышленных масштабах докозагексаеновой (цервоновой) кислоты, относящейся к важнейшим для организма человека незаменимым омега-3-полиненасыщенным жирным кислотам .
Классификация и филогения

На протяжении почти всего XX века классификация динофлагеллят разрабатывалась протозоологами и ботаниками- альгологами практически независимо. Протозоологи трактовали таксон как отряд Dinoflagellida Bütschli, 1885 в составе типа Protozoa ; альгологи — либо как класс Dinophyceae Pascher, 1914 в составе отдела Pyrrophyta (включавшего также класс Cryptophyceae , а иногда — ещё и класс ) , либо как самостоятельный отдел Dinophyta Dillon, 1963 . При этом внутреннюю классификацию динофитовых водорослей ботаники строили на основе типа организации таллома , выделяя порядки Peridiniales (монадные формы), Dinamoebidiales (ризоподиальные формы), Gloeodiniales (пальмеллоидные формы), Dinococcales (коккоидные формы), Dinothrichales (нитчатые формы) . В конце XX века эти ранние классификации полностью устарели .
Современные исследования в области систематики динофлагеллят основаны на анализе их филогении , проводимом с учётом как морфологических , так и молекулярных данных . Согласно данным филогенетического анализа (2014 год), основывавшегося на сопоставлении нуклеотидных последовательностей РНК 76 видов альвеолят и гетероконтов (представители последних играли роль ), динофлагелляты в пределах альвеолят представляют собой монофилетическую группу, сестринскую апикомплексам, причём общий предковый таксон динофлагеллят и апикомплексов был сестринским по отношению к инфузориям. В пределах динофлагеллят из участвовавших в анализе видов наиболее рано отделился (по другим классификациям, и родственные им группы включают не в состав динофлагеллят, а в состав сестринской по отношению к ним группы ), вслед за ним — , ещё позже — клада , а оставшиеся группы динофлагеллят ( динокариоты ) образуют сестринскую по отношению к ней кладу. Внутренние взаимоотношения представителей динокариот ещё не ясны, а имеющиеся данные во многом противоречивы .
Система Фенсома с соавторами
Наиболее важный вклад в формирование современных представлений о систематике динофлагеллят внесла опубликованная в 1993 году система , предложенная Робертом Фенсомом с соавторами. Данная система объединяла в единой классификации современные и ископаемые роды и обобщала предыдущие достижения в области систематики динофлагеллят; она основывалась преимущественно на морфологических признаках (прежде всего, на особенностях клеточных покровов), но учитывала и молекулярные данные , полученные при сравнении нуклеотидных последовательностей отдельных генов рибосомной РНК . В последующие годы система получила широкое распространение; в то же время высказывались серьёзные сомнения в отношении монофилии ряда выделенных в ней подклассов и порядков .
В рамках данной системы классификация типа Dinoflagellata выглядит на верхнем уровне следующим образом :
Тип Dinoflagellata Bütschli, 1885 (динофлагелляты)
-
Подтип
Chatton, 1920
(синдинеи)
- Класс Loeblich III, 1976 (синдиниофициевые): порядок
-
Подтип
Fensome
et
al.
, 1993; Cavalier-Smith, 1993
(динокариоты)
-
Класс
Dinophyceae
Pascher, 1914
(динофициевые)
- Подкласс Gymnodiniphycidae Fensome et al. , 1993 : порядки Gymnodiniales, Ptychodiscales,
- Подкласс Peridiniphycidae Fensome et al. , 1993 : порядки ,
- Подкласс Dinophysiphycidae Möhn, 1984 : порядки † Nannoceratopsiales, Dinophysiales
- Подкласс Prorocentrophycidae Fensome et al. , 1993 : порядок
- Dinophyceae incertae sedis : порядки Desmocapsales, Phytodiniales, Thoracosphaerales
- Класс Blastodiniphyceae Fensome et al. , 1993 (бластодинифициевые): порядок Blastodiniales
- Класс Noctiluciphyceae Fensome et al. , 1993 (ноктилюцифициевые): порядок
-
Класс
Dinophyceae
Pascher, 1914
(динофициевые)
- Dinoflagellata incertae sedis : семейство † Arpyloraceae с родом Arpylorus
Авторы системы не стали включать в состав динофлагеллят отряды (паразиты ракообразных ) и (свободноживущие фаготрофные жгутиконосцы ), систематическое положение которых длительное время вызывало споры среди протозоологов . Позднее оказалось, что эллобиопсиды всё-таки относятся к динофлагеллятам , а эбрииды — нет: они нашли своё место в составе класса Cercozoa . Не был упомянут среди рассмотренных родов и жгутиконосец Oxyrrhis (ранее обычно включавшийся в состав синдиней в качестве единственной свободноживущей формы в данной группе ); позднейшие исследования показали, что в генеалогическом древе динофлагеллят он представляет особую, рано дивергировавшую ветвь .
Система Руджеро с соавторами
Исследования в области филогении динофлагеллят, развернувшиеся в конце XX — начале XXI веков, нашли отражение в системе таксона Dinoflagellata , предложенной в 2015 году Майклом Руджеро с соавторами и входящей как составная часть в представленную ими макросистему живущих организмов. Здесь данный таксон имеет ранг надкласса в составе типа Miozoa надтипа Alveolata (по поводу положения этого надкласса среди других альвеолят см. раздел «Классификация» в статье Альвеоляты ). Система доведена до уровня порядков и отрядов (по отношению к классу Dinophyceae авторы системы следуют правилам ботанической номенклатуры , по отношению к другим классам динофлагеллят — правилам зоологической номенклатуры ) и выглядит следующим образом :
Надкласс Dinoflagellata Bütschli, 1885 (динофлагелляты)
- Класс Cavalier-Smith, 1993 (эллобиопсеи): отряд
- Класс Cavalier-Smith, 1987 (оксирреи): отряды Acrocoelida, Oxyrrhida
- Класс Chatton, 1920 (синдинеи): отряды Rastrimonadida, Syndinida
- Класс Haeckel, 1866 (ноктилюцеи): отряд
-
Класс
Dinophyceae
Pascher, 1914
(динофициевые)
- Подкласс Cavalier-Smith & Chao, 2004 : порядок
- Подкласс Lindemann, 1928 : порядки † Nannoceratopsiales, Dinophysiales
- Подкласс Poche, 1913 : порядки ,
- Подкласс Cavalier-Smith, 2004 : порядки Gymnodiniales,
- Dinophyceae incertae sedis : порядки Actiniscales, Blastodinales, Coccidinales, Dinamoebales, Lophodinales, Pyrocystales, Thoracosphaerales
Динофлагелляты в культуре

Хотя динофлагелляты имеют микроскопические размеры, вызываемые ими при массовом размножении необычные природные явления издавна привлекали внимание людей и получили отражение в памятниках литературы — в том числе и весьма ранних .
О «красном Ниле» упоминают уже древнеегипетские тексты времён Нового царства . Отражено данное явление и в Библии : в книге « Исход » в качестве первой из « десяти казней египетских » упоминается наказание кровью : «…вся вода в реке превратилась в кровь, и рыба в реке вымерла, и река воссмердела, и египтяне не могли пить воды из реки; и была кровь по всей земле Египетской» .
Явление окрашивания в кроваво-красный цвет вод озера легло в основу легенды . Согласно ей, некогда к принцессе Трезенге, дочери последнего правителя Раголи , сваталось много женихов, но всем им она отказала. Один из отвергнутых женихов — Лавинто, правитель Туэнно , не смирился и попытался силой добиться согласия принцессы, послав войско против жителей Раголи. Те не захотели покориться высокомерному Лавинто и во главе с Трезенгой дали на берегах озера бой врагу, превосходившему их численно. К исходу дня защитники Раголи пали, а Трезенгу Лавинто собственноручно пронзил шпагой; озеро окрасилось кровью павших и с тех пор время от времени напоминало людям о храбрости жителей Раголи .
Образные описания свечения моря дали И. А. Гончаров в цикле путевых очерков « Фрегат „Паллада“ » (1855—1857) и Виктор Гюго в романе « Труженики моря » (1866). Вот картина данного явления, данная Гюго: «Казалось, вода была охвачена пожаром… Синеватые полосы на воде лежали складками савана. Широко разлившееся бледное сияние трепетало на водной поверхности. Но то был не пожар, а его призрак… Капли, срываясь с весла в волну, осыпают море звёздами… Опустишь руку в воду и вынимаешь её в огненной перчатке; пламя это мертво, его не чувствуешь» .
Примечания
- ↑ , с. 140.
- [www.vedu.ru/bigencdic/46086/ Отряд Панцирные жгутиконосцы или Перидинеи] — статья из Большого энциклопедического словаря
- ↑ , с. 118.
- , с. 141.
- , с. 60.
- Munday R., Thomas K., Gibbs R., Murphy C., Quilliam M. A. // Toxicon. — 2013. — Vol. 76, Dec. 15. — P. 77—83. — doi : . — .
- Baker M. . Of luminous water insects // Employment for the microscope. — London: Dodsley, 1753. — 403 p. — P. 399—403.
- Müller O. F. . . — Havniæ et Lipsiæ : Heineck and Faber, 1773. — xxxiv + 135 S. (недоступная ссылка) — S. 63, 98.
- Ehrenberg C. G. Beiträge zur Kenntnis der Organisation der Infusorien und ihrer geographischer Verbreitung, besonders in Sibirien // Abhandlungen der Königlich Preussischen Akademie der Wissenschaften zu Berlin gehalten in den Jahren 1830. — 1830. — S. 1–88.
- ↑ , с. 8.
- Bütschli O. . 3. Unterabtheilung (Ordnung) Dinoflagellata // Dr. H. G. Bronn's Klassen und Ordnungen des Thier-Reichs, wissenschaftlich dargestellt in Wort und Bild. Bd. 1. Protozoa. — Leipzig und Heidelberg: C. F. Winter, 1885. — xviii + 1097 S. — S. 906—1029.
- , p. 773.
- ↑ . // . Дата обращения: 29 июля 2015. 17 октября 2015 года.
- , с. 8—9.
- ↑ Курс низших растений / Под ред. М. В. Горленко . — М. : Высшая школа , 1981. — 504 с. — С. 220—222.
- ↑ , с. 142.
- , с. 67.
- ↑ , с. 119.
- ↑ , p. 265.
- , с. 82.
- ↑ , p. 263.
- , p. 142—143.
- , p. 303.
- ↑ , p. 143.
- ↑ , с. 144.
- , p. 265—267.
- ↑ , p. 268.
- ↑ Матвиенко А. М. Отдел пирофитовые водоросли (Pyrrophyta) // Жизнь растений. Т. 3. Водоросли. Лишайники / Под ред. М. М. Голлербаха . — М. : Просвещение , 1977. — 487 с. — С. 93—100.
- Sarjeant W. A. S. . Fossil and Living Dinoflagellates. — San Diego: Elsevier , 2013. — viii + 182 p. — ISBN 978-1-48-327232-0 . — P. 17-18.
- Georgi K. Marinov, Michael Lynch. (англ.) // G3: Genes, Genomes, Genetics. — 2016-02-01. — Vol. 6 , iss. 2 . — P. 397–422 . — ISSN . — doi : . 7 августа 2017 года.
- , с. 122.
- , с. 209.
- ↑ Wisecaver J. H., Hackett J. D. // Annual review of microbiology. — 2011. — Vol. 65. — P. 369—387. — doi : . — .
- , с. 122, 124.
- ↑ , с. 145.
- ↑ Hackett J. D., Anderson D. M., Erdner D. L., Bhattacharya D. // American Journal of Botany . — 2004. — Vol. 91, № 10. — P. 1523—1534. — doi : . — .
- ↑ , с. 207.
- ↑ , с. 121.
- , с. 145—146.
- Imanian B. , Pombert J. F. , Dorrell R. G. , Burki F. , Keeling P. J. (англ.) // Public Library of Science ONE. — 2012. — Vol. 7, no. 8 . — P. e43763. — doi : . — .
- , с. 146.
- ↑ Thomas G. Doak, Robert B. Moore, Ove Hoegh-Guldberg, Mary Alice Coffroth. . — 2005. 27 января 2017 года.
- Rae P. M. // Proc. Nat. Acad. Sci. USA . — 1973. — Vol. 70, № 4. — P. 1141—1145. — .
- Bayer T., Aranda M., Sunagawa S., Yum L. K., Desalvo M. K., Lindquist E., Coffroth M. A., Voolstra C. R., Medina M. // PLoS ONE . — 2012. — Vol. 7, № 4. — P. e35269. — doi : . — .
- , с. 206.
- ↑ Alverca E., Franca S., Díaz de la Espina S. M. // Biology of the Cell. — 2006. — Vol. 98, № 12. — P. 709—720. — doi : . — .
- , с. 84—85.
- ↑ , с. 124.
- ↑ , p. 275.
- , с. 124—125.
- ↑ Hoppenrath M., Saldarriaga J. F. . // . Дата обращения: 6 августа 2015. 13 октября 2012 года.
- ↑ Jackson C. J., Gornik S. G., Waller R. F. // Genome biology and evolution. — 2012. — Vol. 4, № 1. — P. 59—72. — doi : . — .
- ↑ , с. 147.
- Nishitani G., Nagai S., Baba K., Kiyokawa S., Kosaka Y., Miyamura K., Nishikawa T., Sakurada K., Shinada A., Kamiyama T. // Applied and Environmental Microbiology. — 2010. — Vol. 76, № 9. — P. 2791—2798. — doi : . — .
- Wisecaver J. H., Hackett J. D. // BMC Genomics. — 2010. — Vol. 11. — P. 366. — doi : . — .
- , p. 269.
- , с. 147—148.
- ↑ , с. 148.
- ↑ , с. 150.
- , p. 272.
- , p. 272—273.
- , с. 122.
- ↑ , с. 84.
- Gavelis G. S., Hayakawa S., White R. A. 3rd, Gojobori T., Suttle C. A., Keeling P. J., Leander B. S. // Nature . — 2015. — Vol. 523, № 7559. — P. 204—207. — doi : . — .
- ↑ Hayakawa S., Takaku Y., Hwang J. S., Horiguchi T., Suga H., Gehring W., Ikeo K., Gojobori T. // PLoS ONE . — 2015. — Vol. 10, № 3. — P. e0118415. — doi : . — .
- ↑ , p. 273—274.
- , с. 149.
- , с. 149—150.
- , p. 277.
- ↑ , с. 151.
- , с. 150—151.
- ↑ , p. 275—276.
- , p. 401.
- Hoppenrath M., Bachvaroff T. R., Handy S. M., Delwiche C. F., Leander B. S. // BMC Evolutionary Biology. — 2009. — Vol. 9. — P. 116. — doi : . — .
- , с. 25.
- ↑ , p. 277—278.
- ↑ , p. 278.
- ↑ , p. 304.
- , p. 264—265.
- ↑ , с. 152.
- , с. 152—153.
- ↑ , с. 161.
- ↑ , с. 153.
- , p. 415.
- , p. 305.
- ↑ , p. 144.
- ↑ , p. 285.
- ↑ Danne J. C., Gornik S. G., Macrae J. I., McConville M. J., Waller R. F. // Molecular biology and evolution. — 2013. — Vol. 30, № 1. — P. 123—139. — doi : . — .
- , с. 32.
- Suzuki K., Iwamoto K., Yokoyama S., Ikawa T. Glycolate-Oxidizing Enzymes in Algae // Journal of Phycology. — 1991. — Vol. 27, no. 4. — P. 492—498. — ISSN . — doi : .
- Hastings J. W. . // (5 февраля 2009). Дата обращения: 2 августа 2015. 24 сентября 2015 года.
- ↑ , с. 27.
- Тезинг К. . Свечение моря // Чудеса природы. Замечательные произведения живой и мёртвой природы в отдельных очерках выдающихся специалистов учёных / Под общ. ред. В. М. Шимкевича . — Пг. : Типолитография «Самообразование», 1914. — 495 с. — С. 71—74.
- , p. 285—286.
- ↑ , p. 286.
- ↑ , p. 287.
- , p. 287—288.
- , p. 288.
- ↑ , p. 289.
- , p. 290.
- , p. 290—291.
- . // Smithsonian National Museum of Natural History . Дата обращения: 5 августа 2015. 21 апреля 2015 года.
- , с. 37.
- ↑ Николаев И. И. Планктонные водоросли // Жизнь растений. Т. 3. Водоросли. Лишайники / Под ред. М. М. Голлербаха . — М. : Просвещение , 1977. — 487 с. — С. 44—54.
- , p. 798.
- ↑ , с. 154.
- Stat M., Morris E., Gates R. D. // Proc. Nat. Acad. Sci. USA . — 2008. — Vol. 105, № 27. — P. 9256—9261. — doi : . — .
- ↑ , с. 34.
- Langlois G. W., Tom P. D. . // (30 сентября 2008). Дата обращения: 3 августа 2015. 5 марта 2015 года.
- ↑ , с. 155.
- , p. 302.
- , с. 33.
- Moestrup Ø., Hansen G., Daugbjerg N., Flaim G., d’Andrea M. // European Journal of Phycology. — 2006. — Vol. 41, № 1. — P. 47—65. — doi : .
- Hansen G., Flaim G. // Journal of Limnology. — 2007. — Vol. 66, № 2. — P. 107—141. — doi : . .
- ↑ Trevisanato S. I. . . — Piscataway, NJ: , 2005. — P. 17-24. — viii + 196 p. — ISBN 978-1-59333-234-1 .
- Sarjeant W. A. S. Arpylorus antiquus Calandra emend., a dinoflagellate cyst from the upper Silurian // Palynology. — 1978. — Vol. 2. — P. 167—179.
- Vozzhennikova T. F., Shegeshova L. I. Palaeodinophysis gen. et sp. n. from the Devonian of the Rudnyy Altay (a unique find of dinoflagellate fossils) // Doklady Akademii Nauk SSSR. — 1989. — Vol. 307, № 2. — P. 442—445.
- , с. 40.
- ↑ Михайлова И. А., Бондаренко О. Б. . Палеонтология. Ч. 1. — М. : Изд-во Моск. ун-та, 1997. — 448 с. — ISBN 5-211-03841-X . — С. 101.
- , с. 123.
- , p. 284—285.
- , с. 39.
- ↑ , с. 28.
- , с. 155—157.
- Kurisu Y., Sato S., Kobayasi K., Ogata T., Kotaki Y. Detection of domoic acid in the culture of Prorocentrum lima // DINO7, Seventh International Conference on Modern and Fossil Dinoflagellates, September 21—25, 2003. DINO 7 Book of Abstracts / Ed. by K. Matsuoka, M. Yoshida, M. Iwataki. — Nagasaki: Nagasaki University, 2003. — 66 p.
- Dawson J. F., Holmes C. F. // Frontiers in bioscience : a journal and virtual library. — 1999. — Vol. 4. — P. D646–658. — .
- . // . Дата обращения: 13 сентября 2015. 15 сентября 2015 года.
- Watkins S. M., Reich A., Fleming L. E, Hammond R. // Marine Drugs. — 2008. — Vol. 6, № 3. — P. 431—455. — doi : . — .
- Urban Tillmann, Malte Elbrächter, Bernd Krock, Uwe John, Allan Cembella. // European Journal of Phycology. — 2009-02-01. — Т. 44 , вып. 1 . — С. 63–79 . — ISSN . — doi : .
- Michael J. Twiner, Gregory J. Doucette, Andrew Rasky, Xi-Ping Huang, Bryan L. Roth. (англ.) // Chemical Research in Toxicology. — 2012-09-17. — Vol. 25 , iss. 9 . — P. 1975–1984 . — ISSN . — doi : . 5 сентября 2022 года.
- Pearn J. // Journal of neurology, neurosurgery, and psychiatry. — 2001. — Vol. 70, № 1. — P. 4—8. — .
- . // Conners Clinic. Дата обращения: 13 сентября 2015.
- (5 февраля 2007). Дата обращения: 6 сентября 2018. Архивировано 5 февраля 2007 года.
- ↑ Bachvaroff T. R., Gornik S. G., Concepcion G. T., Waller R. F., Mendez G. S., Lippmeier J. C., Delwiche C. F. // Molecular phylogenetics and evolution. — 2014. — Vol. 70. — P. 314—322. — doi : . — .
- Хаусман К. Протозоология. — М. : Мир , 1988. — 336 с. — ISBN 5-03-000705-9 . — С. 45—46.
- Горбунова Н. П. Альгология. — М. : Высшая школа , 1991. — 256 с. — ISBN 5-06-000641-7 . — С. 162.
- ↑ Ruggiero Michael A. , Gordon Dennis P. , Orrell Thomas M. , Bailly Nicolas , Bourgoin Thierry , Brusca Richard C. , Cavalier-Smith Thomas , Guiry Michael D. , Kirk Paul M. (англ.) // PLOS ONE. — 2015. — 29 April ( vol. 10 , no. 4 ). — P. e0119248 . — ISSN . — doi : .
- ↑ Ruggiero M. A. , Gordon D. P. , Orrell T. M. , Bailly N. , Bourgoin T. , Brusca R. C. , Cavalier-Smith T. , Guiry M. D. , Kirk P. M. (англ.) // PLOS ONE. — 2015. — 11 June ( vol. 10 , no. 6 ). — P. e0130114 . — ISSN . — doi : .
- Fensome R. A., Taylor F. J. R., Norris G., Sarjeant W. A. S., Wharton D. I., Williams G. L. . A classification of living and fossil dinoflagellates. — Hanover, PA: Sheridan Press, 1993. — 351 p. — ( Micropaleontology . Special publication No. 7).
- , с. 8—9, 41.
- ↑ Околодков Ю. Б. Классификация и филогения динофлагеллят (Dinoflagellata) // Ботанический журнал . — 2000. — Т. 85, № 4 . — С. 1—14 .
- , с. 9—14.
- Околодков Ю. Б. Современная система динофлагеллят (Dinoflagellata) // Ботанический журнал . — 2001. — Т. 86, № 1 . — С. 110—125 .
- Gómez F., López-García P., Nowaczyk A., Moreira D. // Systematic parasitology. — 2009. — Vol. 74, № 1. — P. 65—74. — doi : . — .
- Hoppenrath M., Leander B. S. // Protist. — 2006. — Vol. 157, № 3. — P. 279—290. — doi : . — .
- Кусакин О. Г. , Дроздов А. Л. Филема органического мира. Ч. 2. — СПб. : Наука , 1997. — 381 с. — ISBN 5-02-026018. — С. 189, 193.
- ↑ Серавин Л. Н. Простейшие… Что это такое? / Отв. ред. Ю. И. Полянский . — Л. : Наука , 1984. — 176 с. — С. 137—147.
- Freni S. . // Sito web MeteoWeb.eu (3 июня 2014). Дата обращения: 5 августа 2015.
- Fusco F. . Lago di Tovel // . — Youcanprint, 2014. — 606 p. — ISBN 978-8-89-115824-6 . — P. 283—286.
Литература
На русском языке
- Белякова Г. А., Дьяков Ю. Т., Тарасов К. Л. . Ботаника: в 4 т. Т. 2. — М. : Издат. центр «Академия», 2006. — 320 с. — ISBN 978-5-7695-2750-1 .
- Мухин В. А., Третьякова А. С. . Биологическое разнообразие: водоросли и грибы. — Ростов н/Д. : Феникс, 2013. — 269 с. — ISBN 978-5-222-20177-0 .
- Околодков Ю. Б. . Dinoflagellata // Протисты: Руководство по зоологии. Часть 3 / Гл. ред. О. Н. Пугачёв . — СПб. ; М. : Товарищество научных изданий КМК, 2011. — 474 с. — ISBN 978-5-87317-809-4 . — С. 7–94.
- Рупперт Э. Э., Фокс Р. С., Барнс Р. Д. Зоология беспозвоночных: функциональные и эволюционные аспекты : в 4 т. Т. 1. — М. : Издат. центр «Академия», 2008. — 496 с. — ISBN 978-5-7695-3493-5 .
- Седова Т. В. . Кариология водорослей. — СПб. : Наука , 1996. — 386 с. — ISBN 5-02-026058-4 .
- Хаусман К., Хюльсман Н., Радек Р. . Протистология / Пер. с англ. С. А. Карпова. Под ред. С. А. Корсуна. — М. : Товарищество научных изданий КМК, 2010. — 495 с. — ISBN 978-5-87317-662-5 .
- Шуканов А. С., Стефанович А. И., Поликсенова В. Д., Храмцов А. К. . Альгология и микология. — Минск: БГУ , 2009. — 423 с. — ISBN 978-985-518-040-2 .
На английском языке
- Carty S., Parrow M. W. . // Freshwater Algae of North America: Ecology and Classification. 2nd edition / Ed. by J. D. Wehr, R. G. Sheath, J. P. Kociolek. — San Diego: Elsevier , 2015. — xvi + 1050 p. — (Aquatic Ecology). — ISBN 978-0-12-385876-4 . — P. 773–807.
- Lee R. E. . Phycology. — New York: Cambridge University Press, 2008. — 561 p. — ISBN 978-0-521-68277-0 .
- Margulis L. , Chapman M. J. . . — W. H. Freeman and Company, 2009. — lxxii + 659 p. — ISBN 978-0-12-373621-5 .
- Raven P. H., Evert R. F., Eichhorn S. E. . Biology of Plants. 7th edition. — New York: W. H. Freeman and Company Publishers, 2005. — 816 p. — ISBN 0-7167-1007-2 .
- Steidinger K. A., Tangen K. . // Identifying Marine Phytoplankton / Ed. by C. R. Tomas. — San Diego: Academic Press , 1997. — xv + 858 p. — ISBN 978-0-12-693018-4 . — P. 387–584.
Ссылки
- Анненкова, Наталия. // Сайт Biomolecula.ru (8 сентября 2014). Дата обращения: 18 марта 2018. 18 марта 2018 года.
|
Эта статья победила на конкурсе
статьи года
и была признана статьёй 2015 года русской Википедии.
|
|
|
Некоторые
внешние ссылки
в этой статье
ведут на сайты, занесённые в
спам-лист
|
- 2020-09-18
- 1